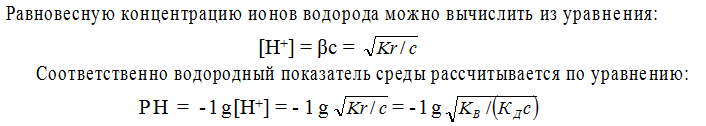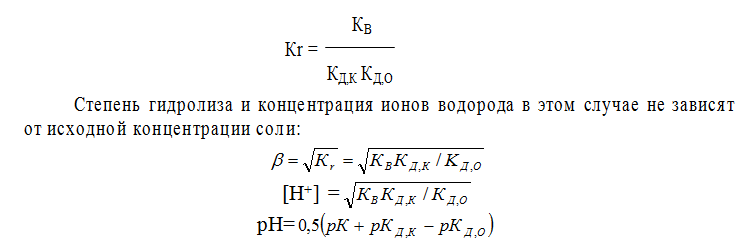При растворении в воде любой соли происходит диссоциация этой соли на катионы и анионы. Если соль образована катионом сильного основания и анионом слабой кислоты (например, нитрит калия KNO2), то нитрит-ионы будут связываться с ионами H + , отщепляя их от молекул воды, в результате чего образуется слабая азотистая кислота. В результате этого взаимодействия в растворе установится равновесие:
Таким образом, в растворе соли, гидролизующейся по аниону, появляется избыток ионов OH – (реакция среды – щелочная; pH > 7).
Если соль образована катионом слабого основания и анионом сильной кислоты (например, хлорид аммония NH4Cl), то катионы NH4 + слабого основания будут отщеплять ионы OH – от молекул воды и образовывать слабодиссоциирующий электролит – гидроксид аммония 1 .
В растворе соли гидролизующейся по катиону появляется избыток ионов H + (реакция среды – кислая pH + связываются с ионами OH – , отщепляя их от молекул воды, а анионы слабой кислоты F – связываются с ионами H + , в результате чего образуется слабое основание NH4OH и слабая кислота HF: 2
Реакция среды в растворе соли, гидролизующейся и по катиону, и по аниону определяется тем, какой из образующихся в результате гидролиза малодиссоциирующих электролитов является более сильным (это можно выяснить, сравнив константы диссоциации). В случае гидролиза NH4F среда будет кислой (pH –5 –4 .
Таким образом, гидролизу (т.е. разложению водой) подвергаются соли, образованные:
– катионом сильного основания и анионом слабой кислоты (KNO2, Na2CO3, K3PO4);
– катионом слабого основания и анионом сильной кислоты (NH4NO3, AlCl3, ZnSO4);
– катионом слабого основания и анионом слабой кислоты (Mg(CH3COO)2, NH4F).
C молекулами воды взаимодействуют катионы слабых оснований или (и) анионы слабых кислот; соли образованные катионами сильных оснований и анионами сильных кислот гидролизу не подвергаются.
Гидролиз солей, образованных многозарядными катионами и анионами, протекает ступенчато; ниже на конкретных примерах показана последовательность рассуждений, которой рекомендуется придерживаться при составлении уравнений гидролиза таких солей.
 |
1. Как уже отмечалось ранее (см. примечание 2 на стр. 5) существует альтернативная точка зрения, согласно которой гидроксид аммония является сильным основанием. Кислая реакция среды в растворах солей аммония, образованных сильными кислотами, например, NH4Cl, NH4NO3, (NH4)2SO4, объясняется при таком подходе обратимо протекающим процессом диссоциации иона аммония NH4 + ⇄ NH3 + H + или, более точно NH4 + + H2O ⇄ NH3 + H3O + .
2. Если гидроксид аммония считать сильным основанием, то в растворах солей аммония, образованных слабыми кислотами, например, NH4F следует рассматривать равновесие NH4 + + F – ⇆ NH3 + HF, в котором происходит конкуренция за ион H + между молекулами аммиака и анионами слабой кислоты.
Пример 8.1 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза карбоната натрия. Укажите pH раствора (pH>7, pH + + CO3 2–
2. Соль образована катионами (Na + ) сильного основания NaOH и анионом (CO3 2– ) слабой кислоты H2CO3. Следовательно, соль гидролизуется по аниону:
Гидролиз в большинстве случаев протекает обратимо (знак ⇄); на 1 ион, участвующий в процессе гидролиза, записывается 1 молекула HOH.
3. Отрицательно заряженные карбонат ионы CO3 2– связываются с положительно заряженными ионами H + , отщепляя их от молекул HOH, и образуют гидрокарбонат ионы HCO3 – ; раствор обогащается ионами OH – (щелочная среда; pH>7):
Это ионно-молекулярное уравнение первой стадии гидролиза Na2CO3.
4. Уравнение первой стадии гидролиза в молекулярном виде, можно получить, соединив все имеющиеся в уравнении CO3 2– + HOH ⇆ HCO3 – + OH – анионы (CO3 2– , HCO3 – и OH – ) с катионами Na + , образовав соли Na2CO3, NaHCO3 и основание NaOH:
5. В результате гидролиза по первой стадии образовались гидрокарбонат ионы, которые участвуют во второй стадии гидролиза:
(отрицательно заряженные гидрокарбонат ионы HCO3 – связываются с положительно заряженными ионами H + , отщепляя их от молекул HOH).
6. Уравнение второй стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении HCO3 – + HOH ⇆ H2CO3 + OH – анионы (HCO3 – и OH – ) с катионами Na + , образовав соль NaHCO3 и основание NaOH:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Пример 8.2 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза сульфата алюминия. Укажите pH раствора (pH>7, pH 3+ + 3SO4 2–
2. Соль образована катионами (Al 3+ ) слабого основания Al(OH)3 и анионами (SO4 2– ) сильной кислоты H2SO4. Следовательно, соль гидролизуется по катиону; на 1 ион Al 3+ записывается 1 молекула HOH: Al 3+ + HOH ⇆ … .
3. Положительно заряженные ионы Al 3+ связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH, и образуют ионы гидроксоалюминия AlOH 2+ ; раствор обогащается ионами H + (кислая среда; pH 3+ + HOH ⇆ AlOH 2+ + H + .
Это ионно-молекулярное уравнение первой стадии гидролиза Al2(SO4)3.
4. Уравнение первой стадии гидролиза в молекулярном виде, можно получить, связав все имеющиеся в уравнении Al 3+ + HOH ⇆ AlOH 2+ + H + катионы (Al 3+ , AlOH 2+ и H + ) с анионами SO4 2– , образовав соли Al2(SO4)3, AlOHSO4 и кислоту H2SO4:
5. В результате гидролиза по первой стадии образовались катионы гидроксоалюминия AlOH 2+ , которые участвуют во второй стадии гидролиза:
AlOH 2+ + HOH ⇆ Al(OH)2 + + H +
(положительно заряженные ионы AlOH 2+ связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH).
6. Уравнение второй стадии гидролиза в молекулярном виде, можно получить, связав все имеющиеся в уравнении AlOH 2+ + HOH ⇆ Al(OH)2 + + H + катионы (AlOH 2+ , Al(OH)2 + , и H + ) с анионами SO4 2– , образовав соли AlOHSO4, (Al(OH)2)2SO4 и кислоту H2SO4:
7. В результате второй стадии гидролиза образовались катионы дигидроксоалюминия Al(OH)2 + , которые участвуют в третьей стадии гидролиза:
(положительно заряженные ионы Al(OH)2 + связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH).
8. Уравнение третьей стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении Al(OH)2 + + HOH ⇆ Al(OH)3 + H + катионы (Al(OH)2 + и H + ) с анионами SO4 2– , образовав соль (Al(OH)2)2SO4 и кислоту H2SO4:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Пример 8.3 Запишите в молекулярном и ионно-молекулярном виде уравнения реакций гидролиза ортофосфата аммония. Укажите pH раствора (pH>7, pH + + PO4 3–
2. Соль образована катионами (NH4 + ) слабого основания NH4OH и анионами
(PO4 3– ) слабой кислоты H3PO4. Следовательно, соль гидролизуется и по катиону, и по аниону: NH4 + + PO4 3– +HOH ⇆ … ; (на одну пару ионов NH4 + и PO4 3– в данном случае записывается 1 молекула HOH). Положительно заряженные ионы NH4 + связываются с отрицательно заряженными ионами OH – , отщепляя их от молекул HOH, образуя слабое основание NH4OH, а отрицательно заряженные ионы PO4 3– связываются с ионами H + , образуя гидрофосфат ионы HPO4 2– :
Это ионно-молекулярное уравнение первой стадии гидролиза (NH4)3PO4.
4. Уравнение первой стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении NH4 + + PO4 3– + HOH ⇆ NH4OH + HPO4 2– анионы (PO4 3– , HPO4 2– ) с катионами NH4 + , образовав соли (NH4)3PO4, (NH4)2HPO4:
5. В результате гидролиза по первой стадии образовались гидрофосфат анионы HPO4 2– , которые вместе с катионами NH4 + участвуют во второй стадии гидролиза:
(ионы NH4 + связываются с ионами OH – , ионы HPO4 2– – с ионами H + , отщепляя их от молекул HOH, образуя слабое основание NH4OH и дигидрофосфат ионы H2PO4 – ).
6. Уравнение второй стадии гидролиза в молекулярном виде, можно получить, связав имеющиеся в уравнении NH4 + + HPO4 2– + HOH ⇆ NH4OH + H2PO4 – анионы (HPO4 2– и H2PO4 – ) с катионами NH4 + , образовав соли (NH4)2HPO4 и NH4H2PO4:
7. В результате второй стадии гидролиза образовались дигидрофосфат анионы H2PO4 – , которые вместе с катионами NH4 + участвуют в третьей стадии гидролиза:
(ионы NH4 + связываются с ионами OH – , ионы H2PO4 – – с ионами H + , отщепляя их от молекул HOH и образуют слабые электролиты NH4OH и H3PO4).
8. Уравнение третьей стадии гидролиза в молекулярном виде, можно получить, связав присутствующие в уравнении NH4 + + H2PO4 – + HOH ⇆ NH4OH + H3PO4 анионы H2PO4 – и катионами NH4 + и образовав соль NH4H2PO4:
В результате этих рассуждений получаем следующие уравнения гидролиза:
Процесс гидролиза протекает преимущественно по первой стадии, поэтому реакция среды в растворе соли, гидролизующейся и по катиону, и по аниону определяется тем, какой из малодиссоциирующих электролитов, образующихся на первой стадии гидролиза, является более сильным. В рассматриваемом случае
реакция среды будет щелочной (pH>7), поскольку ион HPO4 2– – более слабый электролит, чем NH4OH: KNH4OH = 1,8·10 –5 > KHPO4 2– = KIII H3PO4 = 1,3×10 –12 (диссоциация иона HPO4 2– – это диссоциация H3PO4 по третьей стадии, поэтому KHPO4 2– = KIII H3PO4).
Видео:Гидролиз солей. 9 класс.Скачать

Гидролиз солей, образованных кислотой и основанием
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Гидролиз солей.
Гидролиз – химическое обменное взаимодействие ионов растворенной соли с водой, приводящее к образованию слабодисcоциирующих продуктов (молекул слабых кислот или оснований, анионов кислых или катионов основных солей) и сопровождающееся изменением рН среды. Гидролизу не подвергаются соли, образованные сильными кислотами и основаниями, например КСl.
Гидролиз соли, образованной слабой кислотой и сильным основанием, например CH3COONa. Соль в растворе полностью диссоциирует на ионы:
Вода, как уже указывалось, является слабым электролитом:
Ионы водорода воды взаимодействуют с ацетат-ионами с образованием слабой уксусной кислоты
Таким образом, гидролиз в ионной форме можно представит уравнением
Как видно, в результате гидролиза появилось некоторое избыточное количество гидроксид-ионов, а реакция среды стала основной, следовательно, при гидролизе соли, образованной сильным основанием и слабой кислотой, происходит увеличение рН системы, т. е. среда становится основной (происходит подщелачивание раствора).
Показателем глубины протекания гидролиза является степень гидролиза β, представляющая собой отношение концентрации гидролизованных молекул сгидр к исходной концентрации растворенных молекул электролита:
Принимая для упрощения, что в разбавленных растворах активность ионов мало отличается от их концентрации сиона = аиона, запишем константу равновесия реакции гидролиза:
Так как концентрация воды при гидролизе изменяется очень мало, то принимаем ее постоянной и, умножая на константу равновесия, получим константу гидролиза Кr:
Как указывалось ранее, [OH – ][ Н + ] ≈ КВ, а отношение – [Н + ][А – ] / [НА]
является константой диссоциации КД слабой кислоты НА. Таким образом, константа гидролиза равна отношению ионного произведения воды и константы диссоциации слабого электролита:
Если выразить концентрацию ионов и молекул при установлении равновесия
через степень гидролиза β и исходную концентрацию иона с, то получаем, что
Подставив эти значения в уравнение
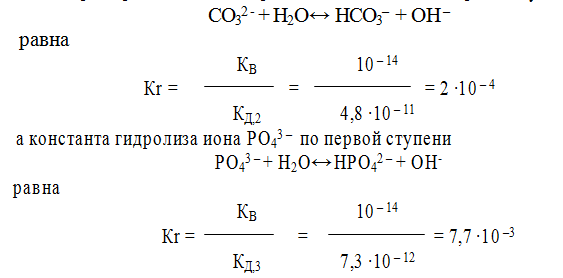
Если гидролизу подвергается многоосновной анион, то гидролиз протекает по стадиям:
Константа гидролиза по первой ступени значительно выше, чем константа гидролиза по последней ступени. Например, для гидролиза СО3 2 – , при 298 К
Поэтому, при расчете концентраций ионов [ОН – ] или [Н + ], второй и третьей ступенью гидролиза обычно пренебрегают. Анализ уравнений гидролиза показывает, что в уравнении Кr = КВ / КД для расчета константы гидролиза по первой ступени входит константа диссоциации слабого электролита по последней ступени. Например, константа гидролиза иона СО3 2- по первой ступени
Гидролиз солей, образованных сильной кислотой и слабым основанием, напримерNH4C1. В растворе соль NH4Cl диссоциирована
Гидролизу подвергается ион слабого основания NH4 +
Как видно, в результате гидролиза соли появляется некоторое избыточное количество ионов водорода, т. е. среда подкисляется. Таким образом, гидролиз соли, образованной сильной кислотой и слабым основанием, приводит к подкислению раствора.
Степень гидролиза и константа гидролиза в данном случае описываются теми же уравнениями, но лишь с включением константы диссоциации слабого основания.
Гидролиз соли, образованной слабым основанием и слабой кислотой, напримерNH4F
Как видно, в результате гидролиза образуются как ионы водорода, так и ионы гидроксида. Константа гидролиза зависит от константы диссоциации как слабого основания КД,О, так и слабой кислоты КД,К
Как видно, в зависимости от соотношения рКД,К и рКД,О среда может иметь как кислую, так и основную реакцию.
Гидролиз играет важную роль в природных и технологических процессах. Например, расщепление пищи в желудочно-кишечном тракте идет по реакции гидролиза ее компонентов. Энергия в организмах в основном переносится с помощью аденозинтрифосфата (АТФ), гидролиз которого характеризуется отрицательным значением энергии Гиббса (-30,5 кДж/моль).
Гидролиз используется в технике при получении ценных продуктов из древесины, жиров и других веществ.
Пример 1. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: a) KCN; б) Na2CO3; в) ZnSO4. Определите реакцию среды растворов этих солей.
Решение, а) Цианид калия KCN — соль слабой одноосновной кислоты (см. табл. 9) HCN и сильного основания КОН. При растворении в воде молекулы KCN полностью диссоциируют на катионы K + и анионы CN. Катионы K + не могут связывать ионы ОН воды, так как КОН — сильный электролит. Анионы же CN связывают ионы H + воды, образуя молекулы слабого элекролита HCN. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
CN – + H2O ↔ HCN + OH –
или в молекулярной форме
KCN + H2O↔ HCN + KOH
В результате гидролиза в растворе появляется некоторый избыток ионов ОН, поэтому раствор KCN имеет щелочную реакцию( рН > 7).
Таблица 19. Константы и степени диссоциации некоторых слабых электролитов
| Электролиты | Формула | Численные значения констант диссоциации | Степень диссоциации в 0,1 н. растворе, % |
| Азотистая кислота | HNO2 | K= 4,0 · 10 -4 | 6,4 |
| Аммиак (гидроксид) | NH4OH | K= 1,8 · 10 -5 | 1,3 |
| Муравьиная кислота | HCOOH | K= 1,76 · 10 -4 | 4,2 |
| Ортоборная кислота | H3BO3 | K1= 5,8 · 10 -10 | 0,007 |
| K2= 1,8 · 10 -13 | |||
| K3= 1,6 · 10 -14 | |||
| Ортофосфорная кислота | H3PO4 | K1= 7,7 · 10 -3 | 27 |
| K2= 6,2 · 10 -8 | |||
| K3= 2,2 · 10 -13 | |||
| Сернистая кислота | H2SO3 | K1= 1,7 · 10 -2 | 20,0 |
| K2= 6,2 · 10 -8 | |||
| Сероводородная кислота | H2S | K1= 5,7 · 10 -8 | 0,07 |
| K2= 1,2 · 10 -15 | |||
| Синильная кислота | HCN | K= 7,2 · 10 -10 | 0,009 |
| Угольная кислота | H2CO3 | K1= 4,3 · 10 -7 | 0,17 |
| K2= 5,6 · 10 -11 | |||
| Уксусная кислота | CH3COOH | K= 1,75 · 10 -5 | 1,3 |
| Фтороводородная кислота | HF | K= 7,2 · 10 -4 | 8,5 |
| Хлорноватистая кислота | HClO | K= 3,0 · 10 -8 | 0,05 |
б) Карбонат натрия Na2CO3 — соль слабой многоосновной кислоты и сильного основания. В этом случае анионы соли CO3 2- , связывая водородные ионы воды, образуют анионы кислой соли НСО3, а не молекулы Н2СО3, так как ионы НСО3 диссоциируют гораздо труднее, чем молекулы Н2СО3. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза
или в молекулярной форме
В растворе появляется избыток ионов ОН, поэтому раствор Na2CO3 имеет щелочную реакцию (рН > 7).
в) Сульфат цинка ZnSO4 — соль слабого многокислотного основания Zn(OH)2 и сильной кислоты H2SO4. В этом случае катионы Zn 2+ связывают гидроксильные ионы воды, образуя катионы основной соли ZnOH + . Образования молекул Zn(OH)2 не происходит, так как ионы ZnOH + диссоциируют гораздо труднее, чем молекулы Zn(OH)2. В обычных условиях гидролиз идет по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза
Zn 2+ + H2O ↔ ZnOH + + H +
или в молекулярной форме
В растворе появляется избыток ионов водорода, поэтому раствор ZnSO4 имеет кислую реакцию (рН 3+ + H2O ↔ AlOH 2+ + H +
Если растворы этих солей находятся в одном сосуде, то идет взаимное усиление гидролиза каждой из них, ибо ионы H + и ОH образуют молекулу слабого электролита Н2O. При этом гидролитическое равновесие сдвигается вправо и гидролиз каждой из взятых солей идет до конца с образованием А1(ОН)3 и СО2 (Н2СО3). Ионно-молекулярное уравнение:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Правильное составление ионно-молекулярных и молекулярных уравнений гидролиза солей
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Решение задач по химии на гидролиз солей
Задание 211.
Какие из солей RbCl, Сr2(SО4)3, Ni(NО3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН ( > 7
а) PbСl2 — соль слабого многокислотного основания Pb(OH)2 и сильной одноосновной кислоты. В этом случае катионы Pb 2+ связывают ионы ОН — воды, образуя катионы основной соли PbOH + . Образование Pb(OH)2 не происходит, потому что ионы PbOH + диссоциируют гораздо труднее, чем молекулы Pb(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
PbCl2 ⇔ Pb 2+ + 2C l- ;
Pb 2+ + H2O ⇔ PbOH + + H +
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору PbCl2 кислую среду, рН
в) Сr2(SO4)3 — соль слабого многокислотного основания Сr(OH) 3 и сильной многоосновной кислоты H2SO4. В этом случае катионы Cr 3+ связывают ионы ОН — воды, образуя катионы основной соли CrOH 2+ . Образование Cr(OH) 2+ и Cr(OH)3 не происходит, потому что ионы CrOH 2+ диссоциируют гораздо труднее, чем ионы Cr(OH) 2+ и молекулы Cr(OH)3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
Молекулярная форма процесса:
В растворе появляется избыток ионов водорода, которые придают раствору Cr2(SO4)3 кислую среду, рН
в) Ni(NO3)2 — соль слабого многокислотного основания Ni(OH)2 и сильной одноосновной кислоты HNO3. В этом случае катионы Ni 2+ связывают ионы ОН — воды, образуя катионы основной соли NiOH+. Образование Ni(OH)2 не происходит, потому что ионы NiOH + диссоциируют гораздо труднее, чем молекулы Ni(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору Ni(NO3)2 кислую среду, рН
г) Na2SO3 — соль сильного однокислотного основания NaOH и слабой многоосновной кислоты H2SO3. В этом случае анионы SO3 2- связывают ионы водорода Н + воды, образуя анионы кислой соли HSO3 — . Образование H2SO3 не происходит, так как ионы HSO3 — диссоциируют гораздо труднее, чем молекулы H2SO3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору Na2SO3 щелочную среду, рН > 7.
Задание 212.
К раствору Al2(SO4)3 добавили следующие вещества: а) Н2SО4; б) КОН; в) Na2SO3; г) ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
Решение:
Гидролиз соли Al2(SO4)3
а) Соль Al2(SO4)3 гидролизуется по катиону, а H2SO4 диссоциирует в водном растворе:
Если растворы этих веществ находятся в одном сосуде, то идёт угнетение гидролиза соли Al2(SO4)3, ибо образуется избыток ионов водорода Н + и равновесие гидролиза сдвигается влево.
б) KOH диссоциирует в водном растворе:
Если растворы этих веществ находятся в одном сосуде, то идёт гидролиза соли Al2(SO4)3 и диссоциации КОН, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН — = Н2О). При этом гидролитическое равновесие соли Al2(SO4)3 и диссоциация КОН сдвигаются вправо и гидролиз соли и диссоциация основания идут до конца с образованием осадка Al(OH)3. По сути, при смешивании Al2(SO4)3 и КОН протекает реакция обмена. Ионно-молекулярное уравнение процесса:
Молекулярное уравнение процесса:
в) Соль Al2(SO4)3 гидролизуется по катиону, а соль Na2SO3 – по аниону:
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н + + ОН — ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Al(OH)3 и слабого электролита H2SO3:
г) Соль Al 2 (SO 4 ) 3 и соль ZnSO4 гидролизуется по катиону:
Al 3+ + H2O ⇔ AlOH 2+ + H + ;
Zn 2+ + H2O ⇔ ZnOH + + H +
Если растворы этих солей находятся в одном сосуде, то идёт взаимное угнетение гидролиза каждой из них, ибо избыточное количество ионов Н + вызывает смещение гидролитического равновесие влево, в сторону уменьшения концентрации ионов водорода Н + .
Задание 213.
Какая из двух солей при равных условиях в большей степени подвергается гидролизу: Na2СО3 или Na2SO3; FеСl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
Решение:
Гидролиз солей
а) Na2CO3 и Na2SO3 – соли сильного основания и слабой кислоты гидролизуются по аниону:
При равных условиях гидролизу в большей степени будет подвергаться соль, у которой константа диссоциации кислоты, образующая соль, будет меньшей, т. е. гидролизу в большей степени подвергается соль, образованная относительно менее сильной кислотой. Так как КD(H2CO3) . 10 -7 ; КD(H2SO3) = 1,4 . 10 -2 ], следовательно, гидролизу в большей степени будет подвергаться Na2CO3.
б) FеСl3 или FeCl2 — соли слабого основания и сильной кислоты гидролизуются по катиону:
Fe 3+ + H2O ⇔ FeOH 2+ + H + ;
Fe 2+ + H2O ⇔ FeOH + + H +
При равных условиях гидролизу в большей степени будет подвергаться соль, у которой константа диссоциации основания, образующая соль, будет меньшей, т. е. гидролизу в большей степени подвергается соль, образованная относительно менее сильным основанием.
Так как КD[(Fe(OH)3] . 10 -11 ; КD[(Fe(OH)2]=1,3 . 10 -4 ], следовательно, гидролизу в большей степени будет подвергаться FeCl3.
Задание 214.
При смешивании растворов Al2(SO4)3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза.
Решение:
Гидролиз соли Al2(SO4)3
Соль Al2(SO4)3 гидролизуется по катиону, а соль Na2SO3 – по аниону:
Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н + и ОН — , связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н + + ОН — ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка Al(OH)3, газа СО2 и слабого электролита H2О:
Задание 215.
Какие из солей NaBr, Na2S, K2CO3, CoCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН (> 7 + и OH — . Ионы Na + , Br — , H + и OH — останутся в растворе. Таким образом, обратная гидролизу реакция нейтрализации протекает практически до конца. Так как в растворе соли присутствуют равные количества ионов H + и OH — , то раствор имеет нейтральную среду, рН = 0.
б) Na2S – соль сильного однокислотного основания NaOH и слабой многоосновной кислоты H2S. В этом случае анионы S 2- связывают ионы водорода Н + воды, образуя анионы кислой соли НS — . Образование H2S не происходит, так как ионы НS — диссоциируют гораздо труднее, чем молекулы H2S. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
Na2S ⇔ 2К + + S 2- ;
S 2- + H2O ⇔ НS — + ОH —
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору Na2S щелочную среду, рН > 7.
в) К2CO3 — соль сильного однокислотного основания КOH и слабой двухосновной кислоты Н2СО3. В этом случае анионы CO3 2- связывают ионы водорода Н + воды, образуя анионы кислой соли HCO3 — . Образование H2CO3 не происходит, так как ионы HCO3 — диссоциируют гораздо труднее, чем молекулы H2CO3. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по аниону. Ионно-молекулярное уравнение гидролиза:
или в молекулярной форме:
В растворе появляется избыток гидроксид-ионов, которые придают раствору К2CO3 щелочную среду, рН > 7.
г) СоСl2 — соль слабого многокислотного основания Со(OH)2 и сильной одноосновной кислоты. В этом случае катионы Со 2+ связывают ионы ОН — воды, образуя катионы основной соли СоOH + . Образование Со(OH)2 не происходит, потому что ионы СоOH + диссоциируют гораздо труднее, чем молекулы Со(OH)2. В обычных условиях гидролиз идёт по первой ступени. Соль гидролизуется по катиону. Ионно-молекулярное уравнение гидролиза:
СоCl2 ⇔ Со 2+ + 2Cl — ;
Со 2+ + H2O ⇔ СоOH + + H +
или в молекулярной форме:
В растворе появляется избыток ионов водорода, которые придают раствору СоCl2 кислую среду, рН
🌟 Видео
ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

11 класс. Гидролиз солей.Скачать

Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Химия | Молекулярные и ионные уравненияСкачать

Гидролиз солей. Классификация солей. Решение примеров.Скачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Гидролиз солей и среда водных растворов веществ, Задание 21 | ЕГЭ по химии 2024Скачать

Все реакции гидролиза солей для ЕГЭ. Необратимый гидролиз за 4 минутыСкачать

76. Гидролиз солей (часть 1)Скачать

Реакции ионного обмена. 9 класс.Скачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Необратимый гидролиз. Примеры уравнений с объяснением.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Гидролиз солей.ПримерыСкачать

Гидролиз солей. 10 класс.Скачать