Метан CH4 – это предельный углеводород, содержащий один атом углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, легче воды, нерастворим в воде и не смешивается с ней.
- Гомологический ряд метана
- Строение метана
- Изомерия метана
- Химические свойства метана
- 1. Реакции замещения
- 1.1. Галогенирование
- 1.2. Нитрование метана
- 2. Реакции разложения метана (д егидрирование, пиролиз)
- 3. Окисление метана
- 3.1. Полное окисление – горение
- 3.2. Каталитическое окисление
- Получение метана
- 1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)
- 2. Водный или кислотный гидролиз карбида алюминия
- 3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)
- 4. Синтез Фишера-Тропша
- 5. Получение метана в промышленности
- Неполное сгорание метана уравнение реакции
- Напишите уравнения реакций : а) неполного сгорания метана, б) изомеризации 2 — метилбутана, в) двух стадий хлорирования 2, 2 — дихлорпропана, если известно, что они протекают у одного и того же атома ?
- Напишите уравнение реакции :● Крекинг гептана?
- Напишите уравнения хлорирования этана, назовите продукты реакции, условия протекания реакции, тип реакции?
- Тема : Алкины?
- При помощи какого реактива можно отличить пропан от пропена?
- 1. Приведите структурные формулы алкенов, имеющих молекулярную формулы C4H8?
- Напишите уравнения химических реакций для следующих превращений Дайте названия продуктам реакции?
- Реакция хлорирования метана протекает по механизму?
- Помогите пожалуйста, очень нужно?
- Напишите уравнения реакции химических свойств алканов : хлорирование, нитрование, окисление, крекинг, дегидрирование, изомеризация?
- Напишите уравнение реакции нитрования и хлорирования 2 метилбутана назовите полученные в каждой реакции продукты?
Видео:Уравнивание реакций горения углеводородовСкачать

Гомологический ряд метана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Самый первый представитель гомологического ряда алканов – метан CH4, или Н–СH2–H.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Видео:29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать

Строение метана
В молекуле метана встречаются связи C–H. Связь C–H ковалентная слабополярная. Это одинарная σ-связь. Атом углерода в метане образует четыре σ-связи. Следовательно, гибридизация атома углерода в молекуле метана– sp 3 :
При образовании связи С–H происходит перекрывание sp 3 -гибридной орбитали атома углерода и s-орбитали атома водорода:
Четыре sp 3 -гибридные орбитали атома углерода взаимно отталкиваются, и располагаются в пространстве так, чтобы угол между орбиталями был максимально возможным.
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле метана CH4 атомы водорода располагаются в пространстве в вершинах тетраэдра, центром которого является атом углерода |
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Изомерия метана
Для метана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Видео:Горение. 7 класс.Скачать

Химические свойства метана
Метан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для метана характерны только радикальные реакции.
Метан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
Видео:Горение топлива и выделение энергии. 8 класс.Скачать

1. Реакции замещения
Для метана характерны реакции радикального замещение.
1.1. Галогенирование
Метан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании метана сначала образуется хлорметан:
Хлорметан может взаимодействовать с хлором и дальше с образованием дихлорметана, трихлорметана и тетрахлорметана:
| Химическая активность хлора выше, чем активность брома, поэтому хлорирование протекает быстро и неизбирательно. |
Бромирование протекает более медленно.
Реакции замещения в алканах протекают по свободнорадикальному механизму.
Свободные радикалы R∙ – это атомы или группы связанных между собой атомов, которые содержат неспаренный электрон.
Первая стадия. Инициирование цепи.
Под действием кванта света или при нагревании молекула галогена разрывается на два радикала:
Свободные радикалы – очень активные частицы, которые стремятся образовать связь с каким-либо другим атомом.
Вторая стадия. Развитие цепи.
Радикал галогена взаимодействует с молекулой алкана и отрывает от него водород.
При этом образуется промежуточная частица – алкильный радикал, который в свою очередь взаимодействует с новой нераспавшейся молекулой хлора:
Третья стадия. Обрыв цепи.
При протекании цепного процесса рано или поздно радикалы сталкиваются с радикалами, образуя молекулы, радикальный процесс обрывается.
Могут столкнуться как одинаковые, так и разные радикалы, в том числе два метильных радикала:
1.2. Нитрование метана
Метан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании до 140 о С и под давлением. Атом водорода в метане замещается на нитрогруппу NO2.
| Например. При нитровании метана образуется преимущественно нитрометан: Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  2. Реакции разложения метана (д егидрирование, пиролиз)При медленном и длительном нагревании до 1500 о С метан разлагается до простых веществ: Если процесс нагревания метана проводить очень быстро (примерно 0,01 с), то происходит межмолекулярное дегидрирование и образуется ацетилен: Пиролиз метана – промышленный способ получения ацетилена. Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать  3. Окисление метанаАлканы – малополярные соединения, поэтому при обычных условиях они не окисляются даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеАлканы горят с образованием углекислого газа и воды. Реакция горения алканов сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении алканов в недостатке кислорода может образоваться угарный газ СО или сажа С. Промышленное значение имеет реакция окисления метана кислородом до простого вещества – углерода: Эта реакция используется для получения сажи. 3.2. Каталитическое окисление
Продукт реакции – так называемый «синтез-газ». Видео:Горение метанаСкачать  Получение метанаВидео:Химические свойства алканов | Химия ЕГЭ для 10 класса | УмскулСкачать  1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения алканов. При этом происходит удвоение углеродного скелета. Реакция больше подходит для получения симметричных алканов. Получить таким образом метан нельзя. Видео:Метан. Состав. Строение. Свойства. Получение и применение метанаСкачать  2. Водный или кислотный гидролиз карбида алюминияЭтот способ получения используется в лаборатории для получения метана. Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать  3. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии ацетата натрия с гидроксидом натрия при сплавлении образуется метан и карбонат натрия: Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить метан: Видео:Химия. 11 класс. Алканы. Горение метана, этилена, ацетилена /16.09.2020/Скачать  5. Получение метана в промышленностиВ промышленности метан получают из нефти, каменного угля, природного и попутного газа . При переработке нефти используют ректификацию, крекинг и другие способы. Видео:Вся теория по алканам | Химия ЕГЭ для 10 класса | УмскулСкачать  Неполное сгорание метана уравнение реакцииГорением называют быстро протекающую во времени химическую реакцию соединения горючих компонентов топлива с кислородом воздуха, сопровождающуюся интенсивным выделением теплоты, света и продуктов сгорания. Для метана реакция горения с воздухом: Для СУГ: Продуктами полного сгорания газов являются водяные пары (H2O), диоксид углерода (CO2) или углекислый газ. При полном сгорании газов цвет пламени, как правило, голубовато-фиолетовый. Объемный состав сухого воздуха принимается: O2≈ 21%, N2 ≈ 79%, из этого след., что 1м 3 кислорода содержится в 4,76м 3 (≈5 м 3 ) воздуха. Вывод: для сжигания — 1м 3 метана необходимо 2м 3 кислорода или около 10м 3 воздуха, — 1м 3 пропана – 5м 3 кислорода или около 25м 3 воздуха, — 1м 3 бутана – 6,5м 3 кислорода или около 32,5м 3 воздуха, — 1м 3 СУГ 6м 3 кислорода или около 30м 3 воздуха. Практически при сжигании газа водяные пары, как правило, не конденсируются, а удаляются вместе с другими продуктами сгорания. Поэтому технические расчеты ведут по низшей теплоте сгорания Qн. Условия, необходимые для горения: 1. наличие топлива (газа); 2. наличие окислителя (кислорода воздуха); 3. наличие источника температуры воспламенения. Неполное сгорание газов. Причиной неполного сгорания газа является недостаточное количество воздуха. Продуктами неполного сгорания газов являются оксид углерода или угарный газ (CO), несгоревшие горючие углеводороды (CnHm) и атомарный углерод или сажа. Для природного газа CH4 + O2 → CO2 + H2O + CO + CH4 + C Для СУГ CnHm + O2 → CO2 + H2O + CO + CnHm + C Наиболее опасным является появление угарного газа, который действует на организм человека отравляюще. Образование сажи придает пламени желтую окраску. Неполное сгорание газа опасно для здоровья человека (при содержании 1% СО в воздухе 2-3 вздоха для человека достаточно, чтобы отравиться со смертельным исходом). Неполное сгорание неэкономично (сажа препятствует процессу передачи тепла, при неполном сгорании газа мы недополучаем тепло, ради которого сжигаем газ). Для контроля полноты сгорания обращают внимание на цвет пламени, которое при полном сгорании должно быть голубым, а при неполном сгорании – желтовато-соломенным. Наиболее совершенный способ контроля полноты сгорания – анализ продуктов сгорания с помощью газоанализаторов. Способы сжигания газа. Понятие о первичном и вторичном воздухе. Существуют 3 способа сжигания газа: 1) диффузионный, 2) кинетический, 3) смешанный. Диффузионный способ или способ без предварительного смешения газа с воздухом. Из горелки в зону горения поступает только газ. Воздух, необходимый для горения, смешивается с газом в зоне горения. Этот воздух называется вторичным. Пламя вытянутое, желтого цвета. a= 1,3÷1,5 t ≈ (900÷1000) о С Кинетический способ – способ с полным предварительным смешением газа с воздухом. В горелку подается газ и подается воздух дутьевым устройством. Воздух, необходимый для горения и который подается в горелку для предварительного смешения с газом, называется первичным. Пламя короткое, зеленовато-синеватого цвета. a= 1,01÷1,05 t≈ 1400 о С Смешанный способ – способ с частичным предварительным смешиванием газа с воздухом. Газ инжектирует первичный воздух в горелку. В зону горения из горелки поступает газовоздушная смесь с недостаточным для полного сгорания количеством воздуха. Остальной воздух – вторичный. Пламя средних размеров, зеленовато-голубоко цвета. a=1,1¸1,2 t ≈1200 о С Коэффициент избытка воздуха a=Lпр./Lтеор. — это отношение количества воздуха, необходимого для горения на практике к количеству воздуха, необходимого для горения и теоретически посчитанного. Всегда должен быть a>1, в противном случае будет недожог. Lпр.=a∙Lтеор., т.е. коэффициент избытка воздуха показывает во сколько раз количество воздуха, необходимого для горения на практике больше количества воздуха, необходимого для горения и посчитанного теоретически. Видео:Окисление метанаСкачать  Напишите уравнения реакций : а) неполного сгорания метана, б) изомеризации 2 — метилбутана, в) двух стадий хлорирования 2, 2 — дихлорпропана, если известно, что они протекают у одного и того же атома ?Химия | 10 — 11 классы Напишите уравнения реакций : а) неполного сгорания метана, б) изомеризации 2 — метилбутана, в) двух стадий хлорирования 2, 2 — дихлорпропана, если известно, что они протекают у одного и того же атома углерода. Дайте названия продуктам реакции по систематической номенклатуре. А) СH4 + O2 = C + 2H2O CH3 — CH — CH2 — CH3 — — — — — — — — — — — — — — — > ; CH3 — C — CH3 | | CH3 CH3 2, 2 — диметилпропан В) Cl Cl | | CH3 — C — CH3 + Cl2 = CH3 — C — CH2Cl + HCl | | Cl Cl 1, 2, 2 — трихлорпропан Cl Cl | | CH3 — C — CH2Cl + Cl2 = CH3 — C — CHCl2 + Hcl | | Cl Cl 1, 1, 2, 2 — тетрахлорпропан. Видео:Реакции горенияСкачать  Напишите уравнение реакции :● Крекинг гептана?Напишите уравнение реакции : ● Хлорирование цикла пентана на свету. Видео:Реакция Дюма. Получение метанаСкачать  Напишите уравнения хлорирования этана, назовите продукты реакции, условия протекания реакции, тип реакции?Напишите уравнения хлорирования этана, назовите продукты реакции, условия протекания реакции, тип реакции. Видео:Органическая химия. Химические свойства углеводородов. Горение метанаСкачать  Тема : Алкины?1)Осуществите превращение : + Br2 + 2Na + HNO3 CH4 — — — — — — — — — — > ; X1 — — — — — — — — — > ; X2 — — — — — — — — — — > ; C2H5NO2 2) Определите массовую долю углерода в пропине? 1) Написать уравнения реакций : а) изомеризации бутана б) горение пропана в кислороде в) 2 стадии хлорирования метана Дайте названия всем продуктам реакций. Видео:Химические свойства алканов. Реакция окисления алканов (механизм + сложные случаи). ЕГЭ по химии.Скачать 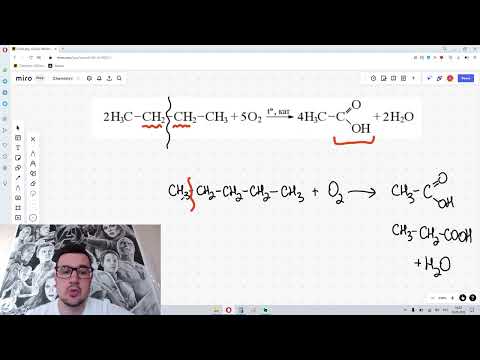 При помощи какого реактива можно отличить пропан от пропена?При помощи какого реактива можно отличить пропан от пропена? Приведите уравнение протекающей реакций и назовите образующийся продукт по систематической номенклатуре. Видео:Закон Авогадро. Молярный объем. 8 класс.Скачать  1. Приведите структурные формулы алкенов, имеющих молекулярную формулы C4H8?1. Приведите структурные формулы алкенов, имеющих молекулярную формулы C4H8. Назовите эти вещества по систематической номенклатуре. 3)акончите уровнение реакций : а)СH4 + O2 = . 4)При помощи какого реактива можно отличить метан от пропена? Приведите уравнение протекающей реакции и назовите образующийся продукт по систематической номенклатуре . Подробно опишите ход проведения эксперимента и наблюдаемые явления . 5)Массовые доли углерода и водорода в углеводороде составляют соответственно 92. 69%. Приведите молекулярную и структурные формулы данного вещества, если известно, что одна его молекула содержит шесть атомов углерода. Напишите уравнения химических реакций для следующих превращений Дайте названия продуктам реакции?Напишите уравнения химических реакций для следующих превращений Дайте названия продуктам реакции. Реакция хлорирования метана протекает по механизму?Реакция хлорирования метана протекает по механизму. Помогите пожалуйста, очень нужно?Помогите пожалуйста, очень нужно. Напишите уравнения реакций : а) полного сгорания пентана в атмосфере кислорода. Б) изомеризации 2, 2 — диметилпропана. В) двух стадий хлорирования 1, 1, 1 — трихлорэтана. Напишите уравнения реакции химических свойств алканов : хлорирование, нитрование, окисление, крекинг, дегидрирование, изомеризация?Напишите уравнения реакции химических свойств алканов : хлорирование, нитрование, окисление, крекинг, дегидрирование, изомеризация. Напишите уравнение реакции нитрования и хлорирования 2 метилбутана назовите полученные в каждой реакции продукты?Напишите уравнение реакции нитрования и хлорирования 2 метилбутана назовите полученные в каждой реакции продукты. Вы перешли к вопросу Напишите уравнения реакций : а) неполного сгорания метана, б) изомеризации 2 — метилбутана, в) двух стадий хлорирования 2, 2 — дихлорпропана, если известно, что они протекают у одного и того же атома ?. Он относится к категории Химия, для 10 — 11 классов. Здесь размещен ответ по заданным параметрам. Если этот вариант ответа не полностью вас удовлетворяет, то с помощью автоматического умного поиска можно найти другие вопросы по этой же теме, в категории Химия. В случае если ответы на похожие вопросы не раскрывают в полном объеме необходимую информацию, то воспользуйтесь кнопкой в верхней части сайта и сформулируйте свой вопрос иначе. Также на этой странице вы сможете ознакомиться с вариантами ответов пользователей. FeCl3 + NaOH = FeOH + NaCl3 K2CO3 + HNO3 = K2NO3 + H2CO3 BaCl2 + Na2SO4 = BaSO4 + NaCl2. Селен назван в честь Луны. HCl ; H2SO4 ; — кислоты ; Cu(NO3)2 ; FeCl3 ; — соли ; Na2O ; BaO ; Mg(OH)2 — основные оксиды ; СО2 — кислотный оксид ; KOH — основание( гидроксид калия). Ответ второй и четвертый. BaCl2 + 2H2O — > Cl2 + H2 + Ba(OH)2 Ba(OH)2 + H2SO4 — > BaSO4 + 2H2O. Рассчитывается по числу молекул. Здесь будет 5 ионов. CO2 + H2O H2CO3 (реакция обратимая, так как кислота неустойчива) Не уверена. |

























