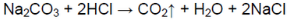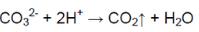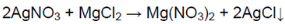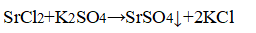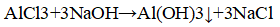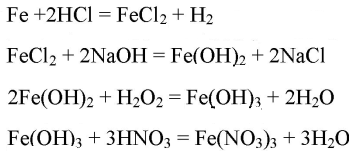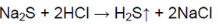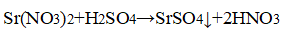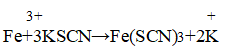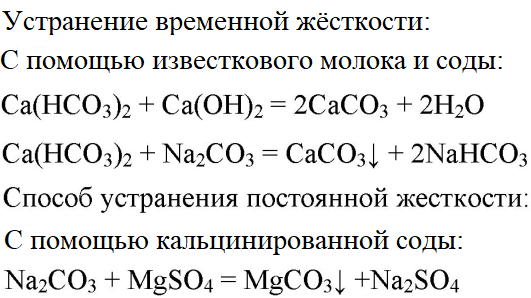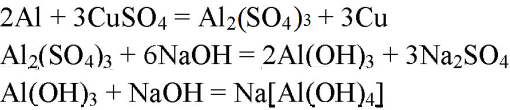- Название опыта
- Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 50. Практическая работа №7.
- Решение экспериментальных задач по теме: “Металлы”
- Вариант 1. Распознавание хлорида магния MgCl2, гидроксида натрия NaOH, карбоната натрия Na2CO3, нитрата натрия NaNO3 1. В четырёх пробирках даны следующие вещества в твёрдом виде: а) хлорид магния; 6) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
- 2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.
- 3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
- 4. Практически осуществите следующие превращения:
- Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
- Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
- 2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
- 3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
- 4. Практически осуществите следующие превращения:
- Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
- 5. Отчёт о работе оформите в произвольной форме.
- Практическая работа №4.
- Получение кислорода и изучение его свойств.
- 💥 Видео
Видео:Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Название опыта
Уравнение химической реакции.
1) Сгорание железа в кислороде
Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления)
2) Получение железа алюминотермическим способом
Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления)
3) Взаимодействие хлора с железом
Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления)
4) Получение гидроксида железа (III) и взаимодействие его с кислотами
Запишите УХР в молекулярном полном и кратком ионном виде:
Задача №2. Определение качественного состава соли. Распознавание солей.
В двух неподписанных флаконах выданы растворы солей – сульфата алюминия и сульфита алюминия. Как при помощи характерных реакций распознать каждое из веществ?
Загрузите и внимательно посмотрите следующие видео – эксперименты:
1) Обнаружение ионов алюминия;
2) Качественная реакция на сульфит- и сульфат-ионы.
Реактив, для качественного определения ионов
Раствор хлорида бария BaCl2
Раствор азотной кислоты HNO3
1) Сульфат алюминия
2) Сульфит алюминия
Запишите УХР в молекулярном полном и кратком ионном виде:
Видео:Практическая работа 3 "Признаки химических реакций". Урок 13. Химия 7 классСкачать

Вопросы к параграфу 50 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

§ 50. Практическая работа №7.
Решение экспериментальных задач по теме: “Металлы”
Вариант 1. Распознавание хлорида магния MgCl2, гидроксида натрия NaOH, карбоната натрия Na2CO3, нитрата натрия NaNO3 1. В четырёх пробирках даны следующие вещества в твёрдом виде: а) хлорид магния; 6) гидроксид натрия; в) карбонат натрия; г) нитрат натрия. При помощи химических реакций определите, в какой пробирке находится каждое из этих веществ.
Твёрдые вещества растворили в воде, далее прилили соляную кислоту.
В одной пробирке выделяется газ без цвета и запаха:
В пробирке — карбонат натрия.
К другим растворам добавили несколько капель фенолфталеина.
Содержимое одной из пробирок окрасилось с малиновый цвет.
В пробирке — гидроксид натрия (образует щелочную среду).
К оставшимся растворам добавили нитрат серебра.
В одной пробирке выпадает белый осадок:
В одной пробирке находится хлорид магния, в пробирке с осадком — нитрат натрия.
2. При помощи характерных реакций докажите, что выданное вам вещество — сульфат алюминия.
3. В одной пробирке дан раствор хлорида натрия, во второй — раствор хлорида стронция, а в третьей — раствор хлорида алюминия. Определите, в какой пробирке находится каждое из выданных веществ.
К растворам добавили сульфат калия.
В одной пробирке выпадает белый осадок:
В пробирке — хлорид стронция.
К оставшимся растворам прилили раствор гидроксида натрия.
В пробирке — хлорид аллюминия. В пробирке с осадком — хлорид натрия.
4. Практически осуществите следующие превращения:
Fe→FeCl2→Fe(OH)2→Fe(OH)3→Fe(NO3)3
Вариант 2. Распознавание карбоната кальция CaCO3, нитрата стронция Sr(NO3)2, сульфата натрия NaSO4, сульфида натрия Na2S. 1. В четырех пробирках даны следующие твёрдые вещества: а) карбонат кальция; б) нитрат стронция; в) сульфат натрия; г) сульфид натрия. Определите, в какой пробирке находится каждое из перечисленных веществ.
Растворили твёрдые вещества и добавили к растворам соляную кислоту.
В пробирке вещество не растворилось в воде, после добавления соляной кислоты выделился газ без запаха и цвета:
В пробирке — карбонат кальция.
В другой пробирке выделяется газ с характерным запахом тухлых яиц:
В пробирке — сульфид натрия.
К остальным растворам прилили раствор серной кислоты.
В одной из пробирок выпадает белый осадок:
В пробирке — нитрид стронция, в пробирке с осадком — сульфат натрия.
2. Докажите, что кристаллы сульфата железа (III) частично окислились и содержат примеси ионов Fe3+.
Качественным реагентом на присутствие трёхвалентного железа является роданид калия. Появляется красное окрашивание.
3. В двух склянках дана вода. В одной из них вода содержит сульфат магния, а в другой — гидрокарбонат кальция. Проделайте опыты, при помощи которых можно устранить постоянную и временную жёсткость воды.
4. Практически осуществите следующие превращения:
Аl→Al2(SO4)3→Аl(ОН)3→Na[Al(OH)4]
5. Отчёт о работе оформите в произвольной форме.
Отчёт представлен выше (1,2,3,4 пункты каждого варианта).
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Практическая работа №4.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Получение кислорода и изучение его свойств.
Цель работы: освоить один из лабораторных способов получения кислорода и собирание его методом вытеснения воздуха; закрепить знания о физических и химических свойствах кислорода.
1. Получение и собирание кислорода.
1) Соберите прибор для получения газов. Проверьте его на герметичность.
2) В пробирку примерно на четверть её объема насыпьте порошок KMnO4. Закройте пробирку пробкой с газоотводной трубкой. Закрепите прибор в штативе в наклонном положении, как показано на риснуке. Подготовьте стакан (или пробирку) для собирания кислорода. Нагрейте сначала всю пробирку, а потом только ту её часть, где находится KMnO4.
3) Убедившись, что стакан или пробирка заполнились кислородом, прекратите нагревание и закройте сосуд с кислородом.
2. Исследование свойств кислорода.
1) Какие физические свойства кислорода можно установить, рассматривая полученный газ?
2) Внесите в сосуд с кислородом тлеющую лучинку. Что вы наблюдаете? О чём это свидетельствует?
3. Сделайте отчет о проделанной работе по плану:
1) Название работы.
2) Цель работы.
3) Использованное оборудование.
4) Название каждой части работы с краткой записью результатов, рисунком прибора, пояснительными надписями и и ответами на поставленные в работе вопросы.
5) Составление уравнения соответствующих химических реакций.
6) Общий вывод.
ОТВЕТЫ
Исследование свойств кислорода
1) Рассматривая полученный кислород, мы видим, что газ прозрачный и не имеет цвета. Если открыть сосуд, то можно убедиться в том, что кислород не имеет запаха.
2) При внесении тлеющий лучинки в сосуд мы видим, что её тление усиливается (угольки становятся ярче). Это свидетельствует о том, что кислород поддерживает горение.
ОТЧЕТ
Название: Получение кислорода и изучение его свойств.
Цель: освоить один из лабораторных способов получения кислорода и собирание его методом вытеснения воздуха. Подтвердить на практике физические и химические свойства кислорода.
Использованное оборудование: пробирка с газоотводной трубкой, спиртовка, штатив с лапкой, химический стакан, вата, лучинка, спички, перманганат калия.
Вывод: мы освоили лабораторный способ получения кислорода путём разложения перманганата калия и собирания кислорода методом вытеснения воздуха. На практике изучили физические и химические свойства кислорода.
💥 Видео
Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Опыты по химии. Признаки химических реакцийСкачать

Занятие №2. Виртуальная лаборатория: признаки химических реакцийСкачать

Признаки химических реакций. Урок 12. Химия 7 класс.Скачать

Как расставлять коэффициенты в уравнениях реакций? #shorts #youtubeshortsСкачать

Реакции присоединения | Химия 10 класс | УмскулСкачать

Лабораторный опыт. "Изучение признаков химических явлений."Скачать

25. Схема реакции и химическое уравнениеСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Расстановка коэффициентов в химических реакциях: как просто это сделатьСкачать

31. Практическая работа. Решение экспериментальных задач.Скачать

Опыты по химии. Типы химических реакцийСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

Практическая работа №1 по теме "Реакции ионного обмена"Скачать