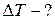ЗАДАЧА 6.1.1 Найти эффективный диаметр молекулы азота, если для азота критическая температура –147,1 0 С; критическое давление 3,5·10 5 Па.
Решение
Постоянная b в уравнении Ван-дер-Ваальса приближенно равна учетверенному собственному объему молекул. Поэтому для одного моля газа имеем
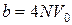
где N – число Авогадро;
V0 – объем одной молекулы, который равен 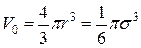
где s —эффективный диаметр молекулы азота.
Подставляя значения V0 в (16), получим, что постоянная b равна 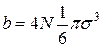
Откуда 
Чтобы определить b, воспользуемся уравнениями, связывающими поправки Ван-дер-Ваальса с критической температурой и давлением
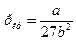
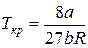
Решая эти уравнения относительно b, получим
Подставим значение b в уравнение для эффективного диаметра молекулы, получим
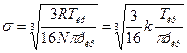
где 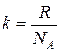
Подставляя численные значения в (17)в системе СИ, найдем
ЗАДАЧА 6.1.2.Моль кислорода расширяется адиабатически в пустоту, в результате чего объём газа увеличивается от 1 л до 10 л. Определить приращение температуры газа.
Дано:V1 = 1 л=10 -3 м; V2 = 10 л= 10 -2 м 3 ; а=0,136 Па·м 6 /моль 2 .
Найти:
Расширяясь в пустоту, газ работы не совершает (А = 0). При адиабатическом процессе 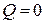
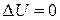
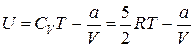
Приравнивая значения этого выражения для начального и конечного состояний газа, получим, что
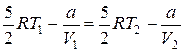
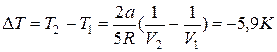
Газ охладился на 5,9 К.
6.2 Задачи к теме «Реальные газы»
458. Вычислить критическую температуру Ткр: 1) кислорода, 2) воды. Поправки Ван-дер-Ваальса:
1) для кислорода а = 0,136 Н×м 4 /моль 2 , в = 3,17×10 -5 м 3 /моль;
2) для воды: а = 0,545 Н×м 4 /моль 2 , в = 3,04×10 -5 м 3 /моль.
459. Найти критический объем Vкр кислорода массой m=0,5 кг. Поправки
Ван-дер-Ваальса: для кислорода а=0,163 Н∙м 4 /моль 2 , в=3,17∙10 -5 м 3 /моль.
460. В баллоне емкостью 4 л находится кислород массой m=0,15 кг при температуре 300К. Определить отношение внутреннего давления р 1 к давлению газа р на стенки сосуда. Поправки Ван-дер-Ваальса:
а=0,136 Н∙м 4 /моль 2 , в=3,04∙10 -5 м 3 /моль.
461. В баллоне емкостью V=8 л находится кислород массой 3 кг при температуре Т=300 К. Найти, какую часть емкости занимает собственный объем молекул газа. Поправки Ван-дер-Ваальса:
а=0,136 Н∙м 4 /моль 2 , в=3,17∙10 -5 м 3 /моль.
462. Вычислить критическое давление Ркр : 1) кислорода; 2) воды. Поправки Ван-дер-Ваальса:
1) для кислорода: а=0,136 Н· м 4 /моль 2 , в=3,17· 10 -5 м 3 /моль;
2) для воды: а=0,545 Н·м 4 /моль 2 , в=3,04·10 -5 м 3 /моль.
463. В сосуде вместимостью V=10 л находится азот массой = 0,156 кг. Определить: 1) внутреннее давление р 1 ’ газа; 2) собственный объем V 1 молекул. Рассматривать как идеальный газ. Поправки Ван-дер-Ваальса: а=0,135 Н∙м 4 /моль 2 , в=3,86∙10 -5 м 3 /моль.
464. Доказать, что теплоемкость Cv газа, подчиняющего уравнению Ван-дер-Ваальса, не зависит от объема, а является функцией только температуры. Найти выражение для внутренней энергии газа Ван-дер-Ваальса, теплоемкость которого не зависит от температуры.
465. Моль азота расширяется в пустоту от начального объема 1 л до конечного 10 л.Найти понижение температуры Т при таком процессе, если постоянная a в уравнении Ван-дер-Ваальса для азота равна
1,36∙10 6 атм∙см 6 / моль 2 .
466. Азот при критической температуре Tкр=147 ° С имеет критический объем Vкр=0,12 л/моль. Считая, что азот подчиняется уравнению Ван-дер-Ваальса, найти понижение температуры 7г азота при расширении в пустоту объема V1=5 л до объема V2 =50 л.
467. Моль кислорода расширяется адиабатический в пустоту, в результате чего объём газа увеличивается от 1 л до 10 л. Определить приращение температуры газа.
468. Объем 1г азота увеличивается от 1 л до 5 л. Рассматривая газ как реальный, найти работу внутренних сил при этом расширении.
469. В баллоне емкостью 8 л находится 0,3 кг кислорода при температуре 27˚С. Определить: какую часть объема сосуда составляет собственный объем молекул; какую часть давления газа на стенки сосуда составляет внутреннее давление, обусловленное силами притяжений молекул.
470. Как изменилось бы давление газа в сосуде, если бы внезапно силы притяжения между молекулами исчезли при неизменной температуре?
471. Какое количество тепла надо подвести к одному молю газа Ван-дер-Ваальса, чтобы при расширении в пустоту от объема V1 до объема V2 его температура не изменилась?
472. Найти эффективный диаметр молекулы азота, если для азота критическая температура -147,1 0 С, критическое давления 33,5∙10 5 Па.
473. Найти постоянные уравнения Ван-дер-Ваальса для азота, если tкр азота равна -146˚С , pкр=33 атм.
474. Найти критическую плотность воды, если критическое давление для воды ркр=195 атм, а критическая температура Tкр=374˚С, предполагая, что вода подчиняется уравнению Ван-дер-Ваальса.
475. Принимая постоянную a Ван-дер-Ваальса для воды равной 5,47∙10 6 атм∙см 6 /моль 2 , найти внутреннее давление воды p.
476. Имеется три непрозрачных цилиндра, закрытых подвижными поршнями. Известно, что в первом цилиндре находится газ при температуре выше критической, во втором – насыщенный пар, а в третьем ненасыщенный пар. Как определить, что находится в каждом из цилиндров?
477. Моль азота охлаждается до -100 ˚С. Определить давление, оказываемое газом на стенки сосуда, если занимаемый газом объем 0,100 л. Сравнить p с pид , которое имел бы азот, если бы сохранил при рассматриваемых условиях свойства идеального газа.
478. Два сосуда с объемами V1 и V2 соединены трубкой с краном. В каждом из них при закрытом кране находится по одному молю одного и того же газа, подчиняющегося уравнению Ван-дер-Ваальса. До открытия крана температура газа в обоих сосудах была одинакова и равна T . Нагреется или охладится газ, если открыть кран? На сколько при этом изменится температура газа? Определить давление газа после открытия крана. Стенки сосуда и соединяющей их трубки считать адиабатическими, а теплоемкость Cv – не зависящей от температуры.
479. Два баллона с объемами V1=V2=V=1 л соединены трубкой с краном. В объеме V1 находится воздух под атмосферным давлением, а объем V2 откачен до предельного вакуума. Считая, что воздух подчиняется уравнению Ван-дер-Ваальса, а стенки баллонов и трубки адиабатические, определить, на сколько изменится температура газа после открытия крана. Начальная температура T=290 K, для воздуха a=1,39·10 6 атм·см 6 /моль 2 .
480. Критическая температура углекислого газа СО2 равна 31˚С, критическое давление 73 атм. Определить критический объем Vкр моля СО2.
481. Поправки для воды в уравнении Ван-дер-Ваальса равны
a=0,566 H×м 4 /моль 2 , b=3,06×10 -5 м 3 /моль. Определить критический объем для 1 кг воды.
482. Найти критические параметры неона, если его постоянные в уравнении Ван-дер-Ваальса a=0,209 H×м 4 /моль 2 , b=1,7×10 -5 м 3 /моль.
483. Азот массой 14 кг занимает объем 0,5 м 3 при температуре 0˚С. Пользуясь уравнением Ван-дер-Ваальса, найти, на сколько нужно изменить температуру газа, чтобы его давление увеличилось вдвое.
484. В сосуде, объем которого 10 л, находится 360 г водяного пара при температуре 470 К. Вычислить давление пара, используя уравнение Ван-дер-Ваальса.
485. Определить эффективный диаметр молекулы газа, для которого критическая температура равна 282,7 К, поправка в уравнении Ван-дер-Ваальса: a=45,3×10 -2 H×м 4 /моль 2 .
486. По уравнению Ван-дер-Ваальса определить давление, под которым находится 1 моль азота в сосуде объемом 2,5 м 3 , если его температура 310 К.
487. Найти постоянные в уравнении Ван-дер-Ваальса для углекислого газа, если критическая температура 304 К, а критическое давление 7370 кПа.
Видео:Урок 194. Уравнение Ван-дер-ВаальсаСкачать

Вычислить постоянные a и b в уравнении Ван-дер-ваальса для азота
- Реферат.Справочник
- Решенные задачи по физике
- Вычислить постоянные a и b в уравнении Ван-дер-ваальса для азота
Условие
Вычислить постоянные a и b в уравнении Ван-дер-ваальса для азота, если известны критические температура Tкр=126 К и давление pкр=3,39 МПа. Дано: Tкр=126 К pкр=3,39 МПа=3,39∙106 Па Найти: a, b-?
Ответ
a=0,136 Н∙м4моль2, b=3,86∙10-5 м3моль.
Решение
Критические температура в давление связаны с постоянные a и b соотношениями pкр=a27b2 Tкр=8a27Rb Выразим отсюда постоянную a: a=27b2pкр a=27RbTкр8 27b2pкр=27RbTкр8 Выразим b: b=RTкр8pкр Подставим числовые значения: b=8,31∙1268∙3,39∙106=3,86∙10-5 м3моль a=27∙3,86∙10-52∙3,39∙106=0,136 Н∙м4моль2 Ответ: a=0,136 Н∙м4моль2, b=3,86∙10-5 м3моль.
Видео:Уравнение Ван дер ВаальсаСкачать

Вычислить постоянные a и b в уравнении Ван-дер-Ваальса для азота, если известны критическая температура Тk = 126 К и критическое
Видео:Уравнение Ван дер Ваальса. Часть 2. Критические параметры. Критическое состояние.Скачать

Ваш ответ
Видео:Реальный газ Уравнение Ван-Дер-ВаальсаСкачать

решение вопроса
Видео:270. Силы Ван-дер-ВаальсаСкачать

Похожие вопросы
- Все категории
- экономические 43,405
- гуманитарные 33,632
- юридические 17,905
- школьный раздел 607,990
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📸 Видео
Уравнение Ван-дер-Ваальса и опыт Джоуля и ТомсонаСкачать

Уравнение Ван-дер-Ваальса (вывод и применение). By Bogatov N.A.Скачать

Уравнение Ван-дер-Ваальса | Газы.Молекулярно-кинетическая теория | Химия (видео 8)Скачать

Урок 146. Основное уравнение МКТ идеального газа - 2Скачать

Уравнение состояния идеального газа. 10 класс.Скачать

Силы Ван-дер-Ваальса (видео 1) | Силы межмолекулярного взаимодействия | ХимияСкачать

Физическая Химия газ Ван дер Ваальса №3 #physicalchemistryСкачать

Реальные газы. Изотермы Эндрюса и Ван-Дер-Ваальса. Метастабильные состоянияСкачать

35. Реальные газыСкачать

Уравнение Ван дер Ваальса. Часть 3. Внутренняя энергия реального газа. Фазовые переходы 1 рода.Скачать

Урок 2.Уравнение Менделеева-Клапейрона. Решение задач. База. ЕГЭСкачать

Селиверстов А. В. - Молекулярная физика - Семинар 26Скачать

Урок 145. Идеальный газ. Основное ур-ние МКТ ид. газа - 1Скачать

Лекция №7 "Газ Ван-дер-Ваальса. Эффект Джоуля-Томсона" (Овчинкин В.А.)Скачать

1 3 Водородная связь Ван дер Ваальсовы силыСкачать