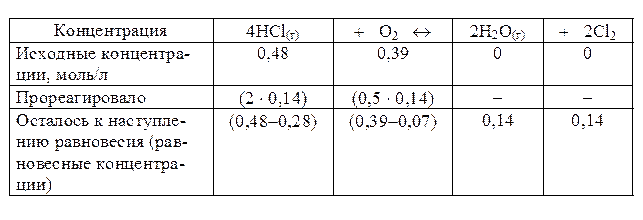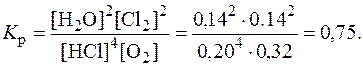Химические реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми. Реакций этого типа очень мало, большинство реакций являются обратимыми. В обратимых реакциях образовавшиеся вещества взаимодействуют между собой, превращаясь в исходные, т. е. такие реакции могут протекать как в прямом, так и в обратном направлении. В уравнениях обратимых реакций вместо знака = используется знак «.
Рассмотрим гомогенную обратимую реакцию
Реакция, направленная слева направо, называется прямой, а противоположная – обратной. Согласно закону действия масс скорость прямой реакции определяется выражением
а скорость обратной реакции – выражением
В начальный момент времени t скорость прямой реакции максимальна, со временем она уменьшается, так как расходуются исходные вещества А и В. Напротив, скорость обратной реакции со временем возрастает, так как накапливаются вещества С и D (рис. 3). Через некоторое время tравн скорости прямой и обратной реакции будут равны друг другу.
Такое состояние называется динамическим химическим равновесием. В состоянии химического равновесия прямая и обратная реакции не прекращаются, однако химический состав системы сохраняется постоянным. Например, за некоторый промежуток времени в системе (5.1) по прямой реакции образуется х моль вещества С. За этот же промежуток времени в обратной реакции расходуется также х моль вещества С, аналогично и для веществ А, В и D данной системы. Следовательно, в состоянии равновесия концентрация каждого вещества остается во времени постоянной и называется равновесной. Равновесные концентрации обозначаются формулами веществ, заключенными в квадратные скобки, например, [A], [B], [C], [D], тогда как неравновесные концентрации обозначают CA, CB, CC, CD.
Рис. 3. Состояние химического равновесия
Подставив в уравнение (5.4) выражения для скорости прямой (5.2) и обратной (5.3) реакций с учетом равновесных концентраций, получим
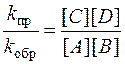
Отношение констант скоростей kпр/kобр при данной температуре также является постоянной величиной, называемой константой равновесия Кр.

Тогда окончательно получаем

Чем больше значение константы равновесия, тем «глубже» протекает прямая реакция до момента установления в системе химического равновесия.
Для реакции общего вида
выражение константы равновесия имеет вид

В случае гетерогенной реакции концентрации твердых веществ в выражение Кр не входят, так как они, как правило, остаются постоянными.
Пример 1. Написать выражение константы равновесия для следующих реакций: а) 2SO2 + O2 « 2SO3; б) 3Fe + 4H2O(г) « Fe3O4 + 4H2.
Решение. Вещества SO2, O2 и SO3 – газы, следовательно, реакция 2SO2 + O2 « 2SO3 – гомогенная:

Реакция 3Fe + 4H2O(г) « Fe3O4 + 4H2 является гетерогенной, концентрации твердых веществ Fe и Fe3O4 в выражение константы равновесия не входят:

Пример 2.В гомогенной системе 4HCl(г) + O2 « 2H2O(г) + 2Cl2 равновесие установилось при концентрации Cl2, равной 0,14 моль/л. Исходные концентрации HCl и O2 составляли соответственно 0,48 и 0,39 моль/л. Вычислить константу равновесия.
Решение. Из уравнения реакции видно, что на образование 0,14 моль Cl2 расходуется 2 × 0,14 = 0,28 моль HCl и 0,5 × 0,14 = 0,07 моль O2. Следовательно, к моменту равновесия осталось (0,48 — 0,28) = 0,20 моль HCl и (0,39 — 0,07) = 0,32 моль O2. Равновесная концентрация H2O равна равновесной концентрации Cl2. Эти расчеты удобно представить в виде таблицы:
Рассчитаем константу равновесия:
Пример 3. Константа равновесия гомогенной системы H2 + I2 « 2HI при некоторой температуре равна 36. Определить, какой процент водорода и йода перейдет в HI, если исходные концентрации этих веществ одинаковы и составляют 0,01 моль/л.
Решение. Пусть к моменту равновесия прореагировало х моль H2. Выразим равновесные концентрации веществ через исходные в виде таблицы:
Подставим значения равновесных концентраций в выражение константы равновесия:
Извлекая из обеих частей уравнения корень, получим
Таким образом, из 0,01 моль водорода и 0,01 моль йода прореагировало по 0,0075 моль, что составляет 75 %.
Значение константы равновесия зависит только от природы участвующих в реакции веществ и температуры. Если в системе присутствует катализатор, то он в равной степени изменяет скорости и прямой, и обратной реакции, ускоряет достижение химического равновесия, но не изменяет значения Кр.
Существует связь между константой равновесия и энергией Гиббса. Чем более отрицательно значение DG°, тем сильнее сдвинуто равновесие в сторону продуктов реакции, т. е. тем больше константа равновесия. При температуре Т связь между Кр и DG выражается уравнением
- ЗАДАЧИ ДЛЯ РЕШЕНИЯ. 1. Напишите выражения для констант равновесия Кр следующих обратимых химических реакций:
- Химическое равновесие. Принцип Ле Шателье
- Понятие химического равновесия
- Признаки химического равновесия
- Принцип Ле Шателье
- Влияние температуры на химическое равновесие
- Влияние давления на химическое равновесие
- Влияние концентрации на химическое равновесие
- Константа химического равновесия
- Примеры решения задач
- Задачи для самостоятельного решения
- 🔥 Видео
Видео:Химическое равновесие. Константа равновесия. 10 класс.Скачать

ЗАДАЧИ ДЛЯ РЕШЕНИЯ. 1. Напишите выражения для констант равновесия Кр следующих обратимых химических реакций:
1. Напишите выражения для констант равновесия Кр следующих обратимых химических реакций:
2. По значению констант равновесия для перечисленных ниже систем определите, в каком случае реакция протекает наиболее и наименее полно:
в) Cd 2+ + S 2- Û CdS Kс= 7*10 28 ;
3. В системе CO (г) +Cl2 (г) Û COCl2 (г) при температуре 300К начальная концентрация CO и Cl2 была равна 0.28 и 0.09 моль/л. Равновесная концентрация СО равна 0.20 моль/л. Найдите константу равновесия.
4. Найдите значение константы равновесия для реакции A + B = C + D, если при некоторой температуре исходные концентрации веществ А и В были равны 0.8 моль/л, а равновесная концентрация вещества С равна 0.6 моль/л.
5. При 444°С константа равновесия реакции H2(г) + I2(г) Û 2HI(г) равна 50. Определите, чему равна константа равновесия реакции диссоциации HI при той же температуре. Будет ли различаться константа равновесия для этой реакции, записанной в различной форме:
6. Некоторое количество двуокиси азота поместили в реактор, в котором при температуре 558К установилось равновесие согласно реакции 2NO2 = 2NO + O2. Равновесные концентрации NO2 и NO составляют соответственно 0.06 и 0.24 моль/л. Найдите константу равновесия, исходную концентрацию и степень диссоциации NO2.
7. Определите исходные концентрации NOCl2 и NO и константу равновесия химической реакции
если при некоторой температуре равновесные концентрации NOCl2, NO и NOCl соответственно равны 0.05 моль/л, 0.55 моль/л и 0.08 моль/л, если начальная концентрация NOCl равна нулю.
8. В состоянии равновесия согласно реакции
концентрация угарного газа была 1 моль/л, а углекислого газа — 2 моль/л. Вычислите исходную концентрацию угарного газа и константу равновесия реакции, если начальная концентрация CO2 равна нулю.
9. Определите константу равновесия Kс реакции при некоторой температуре
если исходные концентрации аммиака и кислорода соответственно равны 2 и 0.5 моль/л, а после установлении равновесия концентрация кислорода уменьшилась вдвое.
определите константу равновесия Kс, равновесную концентрацию аммиака и начальные концентрации (моль/л) реагентов, если при некоторой температуре равновесная концентрация NО была 3.86 моль/л, воды — 2.47 моль/л и кислорода 1.35 моль/л.
определите константу равновесия Kс, равновесную концентрацию фтороводорода и начальные концентрации (моль/л) реагентов, если при некоторой температуре равновесная концентрация NF3 0.73 моль/л, водорода — 1.06 моль/л и азота — 1.36 моль/л.
12. В системе PCl5(г) = PCl3(г) + Cl2(г) равновесие при 500К установилось, когда исходная концентрация PСl5, равная 1 моль/л, уменьшилась до 0.46 моль/л. Найдите значения Kс и Кр этой реакции при указанной температуре.
13. Чему равна при 25°С константа равновесия обратимой реакции, для которой значение DG° в этих условиях равно: а) 5.714 кДж; б) -5.714 кДж?
14. При 923К константа равновесия системы СО +Н2О(г) = СО2 + Н2 равна единице. Начальные концентрации СО2 и Н2 были соответственно равны 0.4 и 0.6 моль/л. Рассчитайте равновесные концентрации всех реагирующих веществ в момент равновесия.
15. Исходные концентрации SO2 и О2 в системе 2SO2 + O2 = 2SO3 при некоторой температуре были соответственно равны 0.06 и 0.03 моль/л. К моменту установления равновесия концентрация SO2 стала равной 0.02 моль/л. Определите равновесные концентрации остальных реагирующих веществ.
16. Константа равновесия реакции FeO(тв) + CO(г) = Fe(тв) + CO2(г) при 1000°С равна 0.5. Исходные концентрации СО и СО2 были соответственно равны 0.07 и 0.02 моль/л. Определите их равновесные концентрации.
17. В реакторе при 494°С смешаны NO и O2. Константа равновесия реакции 2NO + O2 = 2NO2 равна 2.2 л/моль. Равновесные концентрации NO и О2 соответственно равны 0.03 и 0.02 моль/л. Рассчитайте их начальные концентрации.
18. Процесс получения хлора окислением хлористого водорода протекает по схеме
При смешении 1 моль хлороводорода с 0.48 моль кислорода образуется 0.402 моль хлора. Вычислить Кр, если в системе стандартном давлении и температуре 659К.
19. В реакторе при некоторой температуре смешаны 4 моля оксида серы (IV) и 2 моля кислорода при давлении 3.039×10 5 Па. После установления равновесия в смеси осталось 20% взятого SO2. Определите равновесные концентрации всех реагирующих веществ, давление, при котором установилось равновесие, и константу Кр реакции
20. В реактор объемом 11.42 л введены 2.43 моля SO2 и 2.17 моль О2. При некоторой температуре в системе установилось равновесие согласно уравнению реакции 2SO2 + O2 = 2SO3, при этом количество оксида серы (IV) уменьшилось на 1.85 моль. Рассчитайте константу равновесия.
21. Пользуясь таблицами стандартных термодинамических величин, рассчитайте константы равновесия следующих реакций при 298 К:
22. Для реакции PCl5(г) = PCl3(г) + Сl2(г) при 250°С Кр= =1.8×10 5 Па. Определите степень диссоциации PСl5 при этой температуре и общем давлении в системе 1.013×10 5 Па.
23. При температуре 823К и давлении 1.013×10 5 Па степень диссоциации фосгена на окись углерода и хлор равна 77%. Определить Кр и Кс.
24. Рассчитайте общее давление, которое необходимо приложить к смеси 3 частей H2 и 1 части N2 (по объёму), чтобы получить равновесную смесь, содержащую 10% NH3 по объёму, при 400°С. Константа равновесия для реакции N2 + 3H2 = 2NH3 при 400°С Кр =1.6⋅10 −4 (атм).
25. Константа равновесия Крреакции
при 500 К равна 6.09·10 −3 (атм). Рассчитайте общее давление, необходимое для получения метанола с 90%-ным выходом, если CO и H2 взяты в соотношении 1:2.
26. Для реакции I2(тв) + Br2(г) = 2IBr(г) при температуре 25°С константа равновесия Крравна 0.164 (атм). Газообразный бром вводится в сосуд, в котором находится избыток твёрдого йода. Давление 0.164 атм и температура 25°С поддерживаются постоянными. Определите парциальные давления IBr и Br2 при равновесии, считая, что давлением пара твёрдого йода можно пренебречь.
27. Во сколько раз различаются численные значения констант равновесия Кр и Кс при 300 К для следующих реакций:
28. По известным значениям констант равновесия газовых реакций при 1000 К:
Вычислите константу равновесия при той же температуре реакции:
29. Реакция образования аммиака из простых веществ может быть записана различными способами следующим образом:
Будут ли численно различаться константы равновесия (Т=const), записанные для этих трех реакций, и почему?
30. При постоянной температуре определены константы равновесия гомогенных реакций:
Рассчитайте Kс при той же температуре для реакции:
31. При температуре 1396 К и давлении 1 атм степень диссоциации водяного пара на водород и кислород равна 0.567·10 −4 , а степень диссоциации двуокиси углерода на окись углерода и кислород при тех же условиях – 1.551·10 −4 . Определите на основании этих данных состав водяного газа, образовавшегося при указанной температуре из равных объёмов окиси углерода и водяного пара по уравнению реакции
Контрольные вопросы к семинару по теме
“Термодинамика электрохимических процессов”
1. Дайте общее определение электрического потенциала.
2. В чем отличие в протекании реакции в электрохимическом элементе и обычном химическом сосуде?
3. Что означает термин “условный электродный потенциал”?
4. Какая реакция (окисления или восстановления) протекает на положительном электроде гальванического элемента?
5. Расскажите о правилах схематической записи электрохимического элемента.
6. Что вы можете сказать о химическом поведении электрохимической системы М z + + ze = M в паре со стандартным водородным электродом, если ее стандартный электродный потенциал меньше нуля?
7. Как определить направление самопроизвольного протекания окислительно-восстановительной реакции, пользуясь величинами стандартных электродных потенциалов?
8. Может ли электрод, стандартный электродный потенциал которого отрицателен, быть положительным электродом в гальванической ячейке?
9. Запишите выражение для вычисления электродного потенциала.
10.Можно ли по величине ЭДС гальванической ячейки вычислить изменение энергии Гиббса, протекающей в ней реакции?
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

Химическое равновесие. Принцип Ле Шателье
Материалы портала onx.distant.ru
Понятие химического равновесия
Признаки химического равновесия
Принцип Ле Шателье
Влияние температуры на химическое равновесие
Влияние давления на химическое равновесие
Влияние концентрации на химическое равновесие
Константа химического равновесия
Примеры решения задач
Задачи для самостоятельного решения
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 1ч. 10 класс.Скачать

Понятие химического равновесия
Равновесным считается состояние системы, которое остается неизменным, причем это состояние не обусловлено действием каких-либо внешних сил. Состояние системы реагирующих веществ, при котором скорость прямой реакции становится равной скорости обратной реакции, называется химическим равновесием. Такое равновесие называется еще подвижным или динамическим равновесием.
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

Признаки химического равновесия
- Состояние системы остается неизменным во времени при сохранении внешних условий.
- Равновесие является динамическим, то есть обусловлено протеканием прямой и обратной реакции с одинаковыми скоростями.
- Любое внешнее воздействие вызывает изменение в равновесии системы; если внешнее воздействие снимается, то система снова возвращается в исходное состояние.
- К состоянию равновесия можно подойти с двух сторон – как со стороны исходных веществ, так и со стороны продуктов реакции.
- В состоянии равновесия энергия Гиббса достигает своего минимального значения.
Видео:Химическое равновесие. Константа равновесия. Обратимость реакций.Скачать

Принцип Ле Шателье
Влияние изменения внешних условий на положение равновесия определяется принципом Ле Шателье (принципом подвижного равновесия):
Если на систему, находящуюся в состоянии равновесия, производить какое–либо внешнее воздействие, то в системе усилится то из направлений процесса, которое ослабляет эффект этого воздействия, и положение равновесия сместится в том же направлении.
Принцип Ле Шателье применим не только к химическим процессам, но и к физическим, таким как кипение, кристаллизация, растворение и т. д.
Рассмотрим влияние различных факторов на химическое равновесие на примере реакции окисления NO:
Видео:Задача химическое равновесие. РАВНОВЕСНЫЕ КОНЦЕНТРАЦИИ и Кр.Скачать

Влияние температуры на химическое равновесие
При повышении температуры равновесие сдвигается в сторону эндотермической реакции, при понижении температуры – в сторону экзотермической реакции.
Степень смещения равновесия определяется абсолютной величиной теплового эффекта: чем больше по абсолютной величине энтальпия реакции ΔH, тем значительнее влияние температуры на состояние равновесия.
В рассматриваемой реакции синтеза оксида азота (IV) повышение температуры сместит равновесие в сторону исходных веществ.
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Влияние давления на химическое равновесие
Сжатие смещает равновесие в направлении процесса, который сопровождается уменьшением объема газообразных веществ, а понижение давления сдвигает равновесие в противоположную сторону.
В рассматриваемом примере в левой части уравнения находится три объема, а в правой – два. Так как увеличение давления благоприятствует процессу, протекающему с уменьшением объема, то при повышении давления равновесие сместится вправо, т.е. в сторону продукта реакции – NO2. Уменьшение давления сместит равновесие в обратную сторону. Следует обратить внимание на то, что, если в уравнении обратимой реакции число молекул газообразных веществ в правой и левой частях равны, то изменение давления не оказывает влияния на положение равновесия.
Видео:Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 3ч. 10 классСкачать

Влияние концентрации на химическое равновесие
Для рассматриваемой реакции введение в равновесную систему дополнительных количеств NO или O2 вызывает смещение равновесия в том направлении, при котором концентрация этих веществ уменьшается, следовательно, происходит сдвиг равновесия в сторону образования NO2. Увеличение концентрации NO2 смещает равновесие в сторону исходных веществ.
Катализатор одинаково ускоряет как прямую, так и обратную реакции и поэтому не влияет на смещение химического равновесия.
При введении в равновесную систему (при Р = const) инертного газа концентрации реагентов (парциальные давления) уменьшаются. Поскольку рассматриваемый процесс окисления NO идет с уменьшением объема, то при добавлении инертного газа равновесие сместится в сторону исходных веществ.
Видео:Химическое равновесие. Закон действующих масс.Скачать

Константа химического равновесия
Для химической реакции:
константа химической реакции Кс есть отношение:
В этом уравнении в квадратных скобках – концентрации реагирующих веществ, которые устанавливаются при химическом равновесии, т.е. равновесные концентрации веществ.
Константа химического равновесия связана с изменением энергии Гиббса уравнением:
ΔGT о = – RTlnK (2)
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Примеры решения задач
Задача 1. При некоторой температуре равновесные концентрации в системе 2CO (г) + O2 (г)→2CO2 (г) составляли: [CO] = 0,2 моль/л, [O2] = 0,32 моль/л, [CO2] = 0,16 моль/л. Определите константу равновесия при этой температуре и исходные концентрации CO и O2, если исходная смесь не содержала СО2.
Решение.
Вещество
Во второй строке под Спрореагир понимается концентрация прореагировавших исходных веществ и концентрация образующегося CO2, причем, Сисходн= Спрореагир + Сравн.
Задача 2. Используя справочные данные, рассчитайте константу равновесия процесса
Решение.
ΔG298 о = 2·(- 16,71) кДж = -33,42·10 3 Дж.
lnK = 33,42·10 3 /(8,314× 298) = 13,489. K = 7,21× 10 5 .
Задача 3. Определите равновесную концентрацию HI в системе
если при некоторой температуре константа равновесия равна 4, а исходные концентрации H2 , I2 и HI равны, соответственно, 1, 2 и 0 моль/л.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л H2.
| Вещество | H2 | I2 | HI |
| сисходн., моль/л | 1 | 2 | 0 |
| спрореагир., моль/л | x | x | 2x |
| cравн., моль/л | 1-x | 2-x | 2x |
Тогда, К = (2х) 2 /((1-х)(2-х))
Решая это уравнение, получаем x = 0,67.
Значит, равновесная концентрация HI равна 2× 0,67 = 1,34 моль/л.
Задача 4. Используя справочные данные, определите температуру, при которой константа равновесия процесса: H2(г) + HCOH(г) →CH3OH(г) становится равной 1. Принять, что ΔН о Т » ΔН о 298, а ΔS о T » ΔS о 298.
Решение.
Если К = 1, то ΔG о T = — RTlnK = 0;
ΔН о 298 = -202 – (- 115,9) = -86,1 кДж = — 86,1× 10 3 Дж;
ΔS о 298 = 239,7 – 218,7 – 130,52 = -109,52 Дж/К;
0 = — 86100 — Т·(-109,52)
Задача 5. Для реакции SO2(Г) + Cl2(Г) →SO2Cl2(Г) при некоторой температуре константа равновесия равна 4. Определите равновесную концентрацию SO2Cl2, если исходные концентрации SO2, Cl2 и SO2Cl2 равны 2, 2 и 1 моль/л соответственно.
Решение. Пусть к некоторому моменту времени прореагировало x моль/л SO2.
| Вещество | SO2 | Cl2 | SO2Cl2 |
| cисходн., моль/л | 2 | 2 | 1 |
| cпрореагир., моль/л | x | x | х |
| cравн., моль/л | 2-x | 2-x | x + 1 |
Решая это уравнение, находим: x1 = 3 и x2 = 1,25. Но x1 = 3 не удовлетворяет условию задачи.
Следовательно, [SO2Cl2] = 1,25 + 1 = 2,25 моль/л.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ кислот оснований и солей | Как писать УРАВНЕНИЯ ДИССОЦИАЦИЙСкачать

Задачи для самостоятельного решения
1. В какой из приведенных реакций повышение давления сместит равновесие вправо? Ответ обоснуйте.
Так как увеличение давления благоприятствует процессу, протекающему с уменьшением количества
газообразных веществ, то равновесие сместится вправо в реакции 3.
2. При некоторой температуре равновесные концентрации в системе:
составляли: [HBr] = 0,3 моль/л, [H2] = 0,6 моль/л, [Br2] = 0,6 моль/л. Определите константу равновесия и исходную концентрацию HBr.
К = 4; исходная концентрация HBr составляет 1,5 моль/л.
3. Для реакции H2(г) + S(г) →H2S(г) при некоторой температуре константа равновесия равна 2. Определите равновесные концентрации H2 и S, если исходные концентрации H2, S и H2S равны, соответственно, 2, 3 и 0 моль/л.
[H2] = 0,5 моль/л; [S] = 1,5 моль/л.
4. Используя справочные данные, вычислите температуру, при которой константа равновесия процесса
становится равной 1. Примите, что ΔН о Т≈ΔН о 298, а ΔS о T≈ΔS о 298
5. Используя справочные данные, рассчитайте константу равновесия процесса:
6. Для реакции 2С3Н8(г) → н-С5Н12(г)+СН4(г) при температуре 1000 К константа равновесия равна 4. Определите равновесную концентрацию н-пентана, если исходная концентрация пропана равна 5 моль/л.
7. При температуре 500 К константа равновесия процесса:
равна 3,4·10 -5 . Вычислите Δ G о 500.
8. При температуре 800 К константа равновесия процесса н-С6Н14(г)+ 2С3Н6(г)+Н2(г) равна 8,71. Определите ΔG о f,800(С3Н6(г)), если ΔG о f,800(н-С6Н14(г)) = 305,77 кДж/моль.
9. Для реакции СО(г) + Cl2(г) →СO2Cl2(г) при некоторой температуре равновесная концентрация СO2Cl2(г) равна 1,2 моль/л. Определите константу равновесия данного процесса, если исходные концентрации СО(г) и Cl2(г) равны соответственно 2,0 и 1,8 моль/л.
10. При некоторой температуре равновесные концентрации в системе 2SО2(г) + О2(г) →2SO3(г) составляли: [SО2 ]=0,10 моль/л, [О2]=0,16 моль/л, [SО3]=0,08 моль/л. Вычислите константу равновесия и исходные концентрации SО2 и О2.
К=4,0; исходная концентрация SО2 составляет 0,18 моль/л;
исходная концентрация О2 составляет 0,20 моль/л.
🔥 Видео
Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 4ч. 10 класс.Скачать

Решение задач на тему: "Нахождение константы равновесия и равновесных концентраций". 2ч. 10 класс.Скачать

Порядок реакции и энергия активацииСкачать

Скорость химических реакций. 9 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

Задания на константу равновесия по учебнику ЕреминаСкачать
Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

ch0502 Закон действующих масс для химического равновесияСкачать

Задача на Константу равновесия (Кр) с дискриминантом. Химия. Олимпиада + ВУЗСкачать