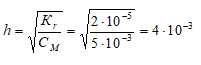AlBr3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора бромида алюминия
- Напишите возможные уравнения гидролиза следующих солей бромида алюминия сульфата кальция
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- 🎦 Видео
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
AlBr3 + HOH ⇄ AlOHBr2 + HBr
Полное ионное уравнение
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
Сокращенное (краткое) ионное уравнение
Al 3+ + HOH ⇄ AlOH 2+ + H +
Видео:Гидролиз солей. 9 класс.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
AlOHBr2 + HOH ⇄ Al(OH)2Br + HBr
Полное ионное уравнение
AlOH 2+ + 2Br — + HOH ⇄ Al(OH)2 + + Br — + H + + Br —
Сокращенное (краткое) ионное уравнение
AlOH 2+ + HOH ⇄ Al(OH)2 + + H +
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Третья стадия (ступень) гидролиза
Молекулярное уравнение
Al(OH)2Br + HOH ⇄ Al(OH)3 + HBr
Полное ионное уравнение
Al(OH)2 + + Br — + HOH ⇄ Al(OH)3 + H + + Br —
Сокращенное (краткое) ионное уравнение
Al(OH)2 + + HOH ⇄ Al(OH)3 + H +
Видео:СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать

Среда и pH раствора бромида алюминия
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Напишите возможные уравнения гидролиза следующих солей бромида алюминия сульфата кальция
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Что называется гидролизом? Объясните этимологию термина. Гидролиз (от греч. hydor ― вода и lysis ― разложение, распад) ― реакции обменного взаимодействия веществ с водой, приводящие к их разложению.
Задание 2
Какие типы гидролиза различают? Обратимый и необратимый гидролиз.
Гидролиз каких солей является необратимым? Солей, образованных слабыми летучими кислотами и слабыми нерастворимыми основаниями.
Почему? Потому, что продукты гидролиза уходят из зоны реакции в виде осадка или газа.
Как, используя таблицу растворимости, определить соль, подвергающуюся такому типу гидролиза? Такие соли обозначаются прочерком «#» в таблице растворимости.
Задание 3
Какие соли подвергаются гидролизу: KCl, K2S , ZnCl2, Pb(NO3)2, Ca3(PO4)2, LiNO2, Cs2SiO3, AlBr 3 , Na2SO4? Запишите уравнения гидролиза в ионном и молекулярном виде. Укажите среду растворов, окраску лакмуса и универсального индикатора в них.
K2S
Cоль диссоциирует в растворе K2S ⇄ 2K + + S 2- , где
S 2- ― анион слабой кислоты и гидролизирует по схеме (вторая стадия практически не происходит):
S 2- + H2O ⇄ HS — + OH —
S 2- + 2K + + H2O ⇄ HS — + 2K + + OH —
K2S + H2O ⇄ KHS + KOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
ZnCl2
Cоль диссоциирует в растворе ZnCl2 ⇄ Zn 2+ + 2Cl — , где
Zn 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Zn 2+ + HOH ⇄ ZnOH + + H +
Zn 2+ + 2Cl — + HOH ⇄ ZnOH + + Cl — + H + + Cl —
ZnCl2 + HOH ⇄ ZnOHCl + HCl Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Pb(NO3)2
Cоль диссоциирует в растворе Pb(NO3)2 ⇄ Pb 2+ + 2NO3 — , где
Pb 2+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Pb 2+ + HOH ⇄ PbOH + + H +
Pb 2+ + 2NO3 — + HOH ⇄ PbOH + + NO3 — + H + + NO3 —
Pb(NO3)2 + HOH ⇄ PbOHNO3 + HNO3 Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Ca3(PO4)2
Cоль диссоциирует в растворе Ca3(PO4)2 ⇄ 3Ca 2 + + 2PO4 3- , где
PO4 3- ― анион слабой кислоты и гидролизуется по схеме (вторая стадия практически не происходит) :
PO4 3 — + HOH ⇄ HPO4 2- + OH —
3Ca 2+ + 2PO4 3 — + 2HOH ⇄ 2Ca 2+ + 2HPO4 2- + Ca 2+ + 2OH —
Ca3(PO4)2 + 2HOH ⇄ 2CaHPO4 + Ca(OH)2 Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
LiNO2
Cоль диссоциирует в растворе LiNO2 ⇄ Li + + NO2 — , где
NO2 — ― анион слабой кислоты и гидролизуется по схеме:
NO2 — + HOH ⇄ HNO2 + OH —
Li + + NO2 — + HOH ⇄ HNO2 + Li + + OH —
LiNO2 + HOH ⇄ HNO2 + LiOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Cs2SiO3
Cоль диссоциирует в растворе Cs2SiO3 ⇄ 2Cs + + SiO3 2 — , где
SiO3 2- ― анион слабой кислоты и гидролизуется по схеме (вторая стадия практически не происходит) :
SiO3 2- + HOH ⇄ HSiO3 — + OH —
2Cs + + SiO3 2- + HOH ⇄ Cs + + HSiO3 — + Cs + + OH —
Cs2SiO3 + HOH ⇄ CsHSiO3 + CsOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
AlBr3
Cоль диссоциирует в растворе AlBr3 ⇄ Al 3+ + 3Br — , где
Al 3+ ― катион слабого основания и гидролизирует по схеме (вторая стадия практически не происходит):
Al 3+ + HOH ⇄ AlOH 2+ + H +
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
AlBr3 + HOH ⇄ AlOHBr2 + HBr Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Задание 4
Запишите уравнение гидролиза ацетата алюминия и сульфита хрома (III). Какому гидролизу подвергаются эти соли?
Ацетата алюминия и сульфита хрома (III) подвергаются необратимому гидролизу:
(CH3COO)3Al + 3H2O ⟶ 3CH3COOH + Al(OH)3↓
Cr2(SO3)3 + 3H2O ⟶ 2Cr(OH)3↓ + 3SO2↑
Задание 5
Даны растворы трёх солей. Как при помощи индикатора распознать их? Для солей, подвергающихся гидролизу, запишите уравнения соответствующих реакций.
а) нитрат цинка, сульфат натрия, силикат калия;
Нитрат цинка ― соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону:
Zn 2+ + HOH ⇄ ZnOH + + H +
Zn 2+ + 2NO3 — + HOH ⇄ ZnOH + + NO3 — + H + + NO3 —
Zn(NO3)2 + HOH ⇄ ZnOHNO3 + HNO3 Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
Сульфат натрия ― соль, образованная сильным основанием и сильной кислотой, не подвергается гидролизу, раствор имеет нейтральную среду, поэтому лакмус не изменит свою окраску.
Силикат калия ― соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону:
SiO3 2- + HOH ⇄ HSiO3 — + OH —
2K + + SiO3 2- + HOH ⇄ K + + HSiO3 — + K + + OH —
K2SiO3 + HOH ⇄ KHSiO3 + KOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
б) хлорид лития, сульфид натрия, бромид алюминия;
Хлорид лития ― соль, образованная сильным основанием и сильной кислотой, не подвергается гидролизу, раствор имеет нейтральную среду, поэтому лакмус не изменит свою окраску.
Сульфид натрия ― соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону:
S 2- + HOH ⇄ HS — + OH —
2Na + + S 2- + HOH ⇄ Na + + HS — + Na + + OH —
Na2S + HOH ⇄ NaHS + NaOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Бромид алюминия ― соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону:
Al 3+ + HOH ⇄ AlOH 2+ + H +
Al 3+ + 3Br — + HOH ⇄ AlOH 2+ + 2Br — + H + + Br —
AlBr3 + HOH ⇄ AlOHBr2 + HBr Гидролиз по катиону, среда кислотная, лакмус окрасится в красный цвет.
в) нитрит натрия, цианид калия, иодид бария.
Нирит натрия ― соль, образованная сильным основанием и слабой кислотой, подвергается гидролизу по аниону:
NO 2- + HOH ⇄ HNO2 + OH —
Na + + NO 2- + HOH ⇄ HNO2 + Na + + OH —
NaNO2 + HOH ⇄ HNO2 + NaOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Цианид калия ― соль, образованная слабым основанием и сильной кислотой, подвергается гидролизу по катиону:
CN — + HOH ⇄ HCN + OH —
K + + CN — + HOH ⇄ HCN + K + + OH —
KCN + HOH ⇄ HCN + KOH Гидролиз по аниону, среда щелочная, лакмус окрасится в синий цвет.
Иодид бария ― соль, образованная сильным основанием и сильной кислотой, не подвергается гидролизу, раствор имеет нейтральную среду, поэтому лакмус не изменит свою окраску.
Задание 6
Запишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
карбид алюминия ⟶ метан ⟶ ацетилен ⟶ ацетальдегид ⟶ этановая кислота ⟶ этилацетат ⟶ этиловый спирт. Какие из превращений являются реакциями гидролиза?
Al4C3 + 12H2O ⟶ 4Al(OH)3 ↓ + 3CH4↑ — реакция гидролиза.
2CH4 t ⟶ C2H2 + 3H2 ↑
2C2H2 + O2 ⟶ 2CH3 —C HO
2CH3 —C HO + O2 ⟶ 2CH3 —C OOH
CH3 —C OOH + C2H5 —O H t, H₂SO₄(конц.) ⟶ CH3 —C OO — C2H5 + H2O
CH3 —C OO — C2H5 + H2O ⟶ CH3 —C OOH + C2H5 —O H — реакция гидролиза.
Задание 7
Испытайте в домашних условиях растворы пищевой и технической соды (NaHCO3 и Na2CO3) индикаторной бумагой. В каком растворе среда будет более щелочной? В растворе технической соды среда будет более щелочной, т.к. СО3 2- гидролизуется по аниону, а анион Н СО3 — практически не гидролизуется.
Cоль Na2CO3 диссоциирует в растворе Na2CO3 ⇄ 2Na + + CO3 2- , где
CO3 2- ― анион слабой кислоты и гидролизуется по схеме:
I стадия: CO3 2- + HOH ⇄ HCO3 — + OH —
II стадия: HCO3 — + HOH ⇄ H2CO3 + OH — (практически не происходит)
2Na + + CO3 2- + 2HOH ⇄ 2Na + + 2OH — + H2CO3
Na2CO3 + 2HOH ⇄ 2NaOH + H2CO3
Задание 8
Испытайте растворы мыла и стирального порошка индикаторной бумагой. Раствор мыла имеет щелочную среду.
Объясните, почему стиральные порошки предпочтительнее мыла? Стиральные порошки пенятся в воде любой жесткости и не разрушают структуру ткани, в то время, как мыла имеют плохую моющую способность в жесткой воде.
Почему не рекомендуется стирка шерстяных изделий порошками, предназначенными для стирки хлопчатобумажных тканей? Такие порошки имеют сильнощелочную среду, в присутствии которой белки гидролизуются и шерстяные изделия будут разрушаться.
Видео:Электролиз. 10 класс.Скачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
🎦 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

11 класс. Гидролиз солей.Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Гидролиз солей. 1 часть. 11 класс.Скачать

СОЛИ ХИМИЯ 8 КЛАСС: Химические Свойства Солей и Получение // Реакция Солей с Кислотами и МеталламиСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Гидролиз бинарных соединений. 11 класс.Скачать
ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать