Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
- § 25. Получение аммиака и изучение его свойств
- 1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
- 2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
- 3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
- Реакция взаимодействия хлорида аммония и гидроксида калия
- Реакция взаимодействия хлорида аммония и гидроксида калия
- Реакция взаимодействия сульфида галлия (III) и водорода
- Реакция термического разложения карбида кремния
- Реакция взаимодействия меди, серной кислоты и кислорода
- Выбрать язык
- Разделы
- ТОП 5 записей
- Популярные записи
- Элементы, реакции, вещества
- Предупреждение.
- Аммиак, нашатырь и нашатырный спирт — в быту их путают
- Запах один, а вещества разные
- Происхождение аммиака
- Происхождение нашатыря
- Происхождение нашатырного спирта
- Области применения
- Применение аммиака
- Использование аммиачного спирта
- Влияние на человека
- Первая помощь при отравлении
- 💥 Видео
Видео:Химическое равновесие. Задание №22 | Химия ЕГЭ 2022 | УмскулСкачать

§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
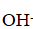
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
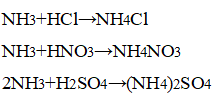
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
Видео:Химия | Схемы ОВР для перманганат и дихромат ионовСкачать

Реакция взаимодействия хлорида аммония и гидроксида калия
Видео:Обратимость и необратимость химических реакций. Химическое равновесие. 1 часть. 9 класс.Скачать

Реакция взаимодействия хлорида аммония и гидроксида калия
Уравнение реакции взаимодействия хлорида аммония и гидроксида калия:
Реакция взаимодействия хлорида аммония и гидроксида калия.
В результате реакции образуются хлорид калия, аммиак и вода.
Для проведения реакции используются концентрированные растворы хлорида аммония и гидроксида калия.
Реакция протекает при условии: при кипении.
Формула поиска по сайту: NH4Cl + KOH → KCl + NH3 + H2O.
Реакция взаимодействия сульфида галлия (III) и водорода
Реакция термического разложения карбида кремния
Реакция взаимодействия меди, серной кислоты и кислорода
Выбрать язык
Разделы
ТОП 5 записей
Популярные записи
Элементы, реакции, вещества
Предупреждение.
Все химические реакции и вся информация на сайте предназначены для использования исключительно в учебных целях — только для решения письменных, учебных задач. Мы не несем ответственность за проведение вами химических реакций.
Химические реакции и информация на сайте
не предназначены для проведения химических и лабораторных опытов и работ.
Видео:Смещение равновесия в растворе аммиака при нагреванииСкачать

Аммиак, нашатырь и нашатырный спирт — в быту их путают

На самом деле это разные вещества, которые отличаются друг от друга своим происхождением, агрегатным состоянием и химическими формулами. Роднит эти три разных вещества только резкий аммиачный запах.
Видео:Признак химических реакций - выпадение или растворение осадкаСкачать

Запах один, а вещества разные
Для того чтобы раз и навсегда разубедиться в том, что нашатырный спирт и аммиак — это одно и тоже, достаточно обратиться к истории их происхождения и посмотреть на их химические формулы.
Аммиак — нитрид водорода, газ с молярной массой 17 г/моль, химическая формула — NH3.
Нашатырный или аммиачный спирт — жидкость с химической формулой NH4OH.
Нашатырь — соль с химической формулой — NH4Cl.
Происхождение аммиака

По второй легенде, в северной Африке в районе оазиса Аммона находилось пересечение караванных путей. Там проходило огромное количество животных, дорога была усеяна их калом и обильно полита мочой, которые испарялись и выделяли газ, который называли «аммиак».
Что касается научного открытия газа с названием «аммиак», то оно датируется 1785 годом. Химическую формулу газа, NH3, определил французский ученый К. Л. Бертолле и назвал его «аммиак».
Но еще в 1774 году английский ученый Д. Пристли получил идентичный газ, которому дал название «щелочной воздух», но химического состава вывести не смог.
Аммиак (ammonia на латыни) — бесцветный газ со специфическим запахом, легче воздуха, химически активный, сжижается при температуре -33 С; хорошо растворяется в воде, имеет щелочную реакцию; взаимодействует с соляной кислотой и образует соль аммония: NH3 + HCl = NH4Cl, которая при нагревании разлагается: NH4Cl = NH3 + HCl.
Получают аммиак двумя способами — промышленным и лабораторным. При лабораторном способе аммиак получается при нагревании щелочей и соли аммония:
- NH4Cl + KOH = NH3 ↑ + KCl + H2O;
- NH4 + + OH — = NH 3 ↑ + H2O.
В промышленных условиях аммиак сначала производится в газообразном виде, а затем его сжижают и доводят до 25%-го водного раствора, который называется аммиачная вода.

Промышленный способ синтеза аммиака был изобретен в 1909 году немецким химиком Фрицем Габером. В 1918 году за свое открытие в химии он получил Нобелевскую премию. Первый завод по производству аммиака был запущен в 1913 году в Германии, а в 1928 году производство аммиака было уже налажено в России.
Происхождение нашатыря
Нашатырь (Hammoniaci P. Sal) — это соль, химическая формула NH4Cl (хлорид аммония).
Нашатырь имеет вулканическое происхождение; встречается в горячих источниках, испарениях грунтовых вод, в залежах гуано и самородной серы; образуется при горении угольных пластов или скоплений мусора. Имеет вид натёков, землистых налётов, корочек или массивных скелетных кристаллических скоплений, гроздей и дендритов.
Чистый нашатырь бесцветный или белый, со стеклянным блеском. В зависимости от имеющихся в нем примесей, цвет может быть всех оттенков жёлтого, бурый, серый, разных оттенков красного, коричневый.
При нагревании из нашатыря выделяется аммиак, он хорошо растворяется в воде. Раствор на вкус жгучий едко — солёный, запах резкий аммиачный.
Нашатырь был известен людям с очень давних времен и использовался в ритуальных обрядах, при производстве и окраске тканей, а также алхимиками для пайки металлов и сплавления золота.
В Средние века научились получать искусственный нашатырь из рогов и копыт крупного рогатого скота, который называли «духом оленьего рога».
Происхождение нашатырного спирта

Это 10-процентный раствор аммиачной воды с химической формулой NH4OH; бесцветная прозрачная однородная смесь, способная испаряться; со специфическим запахом аммиака, который при замерзании сохраняется.
Упоминание о его использовании восточными алхимиками датируется еще VIII веком, а европейскими алхимиками 13 веком. До наших дней дошли их записи об используемых ими рецептурах.
В наши дни получают промышленным и простым бытовым способом:
- промышленным способом синтез проводят из газообразного состояния водорода, азота и воздуха с использованием определенных катализаторов, а затем получают водно-спиртовой раствор, который имеет резкий аммиачный запах;
- простой бытовой способ основан на разведении 25%-ой аммиачной воды до 10%-ого раствора.
Видео:Задание 10 ЕГЭ по химии: взаимосвязь неорганических веществСкачать

Области применения
Область применения аммиака и аммиачного спирта широка, он используется практически во всех сферах жизнедеятельности человека, начиная от технологических процессов и заканчивая медициной и бытовыми нуждами.
Применение аммиака
Аммиак широко применяется в качестве хладагента в различном бытовом и промышленном оборудовании.
Он является одним из важнейших продуктов, используемых в химической промышленности. В частности, его используют в производстве:
- нашатырного спирта;
- добавок в строительные материалы для использования в морозных условиях;
- полимеров, соды и азотной кислоты;
- удобрений;
- взрывчатых веществ.
Использование аммиачного спирта
Аммиачный спирт применяется в медицине и в быту.
Применение в медицине показано в следующих случаях:
для возбуждения дыхания при обморочных состояниях: для этого подносят к носу пострадавшего флакон с нашатырным спиртом; флакон надо держать в 5 см от носа, чтобы избежать ожога;
- для стимуляции рвоты при различных видах отравления: 10 капель на стакан воды и дать выпить;
- наружно для местного охлаждения при болях от невралгии или миозитов;
- наружно при зуде от укусов насекомых: сделать раствор из спирта с водой в пропорции 1 часть спирта на 10 частей воды и протереть зудящее место;
- наружно для обработки рук хирурга в качестве антисептика;
- внутрь при отравлении алкоголем: на 1 стакан воды 5 капель спирта. Это позволяет быстро очнуться, собраться с мыслями и адекватно отвечать на вопросы;
- в качестве антисептика для стерилизации игл при отсутствии автоклава или разовых игл;
- для удаления бородавок: неразбавленным спиртом смочить ватный тампон и прижить к бородавке на 5−6 секунд, не дотрагиваясь до здоровой кожи, чтобы избежать ожога;
- в стоматологии в определенной концентрации при обработке полости рта;
- и в других случаях.
Применение в быту заключается в обезжиривании и чистки различной домашней утвари.
Раствором спирта из расчета 2 ч. л. на 2 стакана воды и 1 ст. л. любого средства для мытья посуды можно отлично почистить столовое серебро, серебряные и золотые ювелирные украшения (изделия с жемчугом нашатырным спиртом чистить нельзя, он станет серым и мутным). Для этого надо поместить в раствор столовое серебро или ювелирные изделия, подержать от 1 до 2 часов, затем прополоскать в воде и насухо вытереть.
Он хорошо выводит пятна крови, мочи и пота с шерсти, шелка и лайкры. В качестве пятновыводителя используется 50% раствор. В концентрированном виде может удалить следы от карандаша на одежде.
С ковров, мебельной обивки и автомобильных чехлов можно удалить пятка раствором из 1 ст. л. чистого аммиака и 2 л горячей воды. Для этого надо прочистить загрязнение и дать просохнуть. Если будет необходимость, то можно повторно прочистить.
Оконные стекла, зеркала и фаянс тоже можно почистить раствором из 1 ст. л. чистого аммиака и 3 ст. воды. Поверхность будет чистая и хорошо блестеть.
Аммиачной водой 1 ст. л. в смеси с 4 л воды можно отчистить каменные налеты в ванне и умывальнике. Для этого надо их прочистить раствором, а потом промыть горячей водой.
Спирт может использоваться в садоводстве для борьбы с луковой мухой и тлей, а также в качестве удобрения, для огородных и комнатных растений в условиях кислой почвы.
Видео:Растворение нитрата аммония. Химический опытСкачать

Влияние на человека

При намерении использовать аммиак приобретать его надо исключительно в аптеках и внимательно знакомиться с прилагаемыми правилами пользования «Раствор аммиака. Инструкция по применению».
Превышение дозировок может вызвать отравление и серьезные проблемы со здоровьем, а также химические ожоги. Помещения, где он применяется, должны хорошо проветриваться.
Кроме ядовитости, пары аммиака взрывоопасные. Это происходит при смешении их с воздухом в определенной пропорции, поэтому при работе необходимо соблюдать особые правила техники безопасности при работе со взрывчатыми веществами.
Первыми симптомами отравления могут быть:
- появление красных пятен на лице и теле;
- кашель, слезотечение, слюнотечение и чих;
- учащенное дыхание;
- общая возбужденность.
Дальнейшими признаками развития отравления являются:
- появление острой боли за грудиной;
- судороги;
- отек гортани;
- спазм голосовых связок;
- мышечная слабость;
- нарушение кровообращения;
- полуобморочное состояние, вплоть до потери сознания.
При приеме внутрь аммиачной воды в превышающих дозах может возникнуть:
- понос с ложными болезненными позывами;ожог пищевода, желудка и начальных отделов кишечника;
- кашель, слезотечение, слюнотечение и чих;
- остановка дыхания рефлекторного характера;
- рвота с запахом аммиака;
- прием аммиачного спирта в количестве от 10 до 15 гр. грозит летальным исходом.
Если у человека имеется индивидуальная непереносимость к запаху аммиака, то даже незначительное его попадание через дыхательные пути или вовнутрь может сразу привести к самым неблагоприятным последствиям.
Если у человека на теле имеется нарушение кожных покровов в виде мокнущих язв, экзем или дерматитов, то применение примочек может привести к еще более обширной аллергической реакции и ожогам кожных покровов.
Первая помощь при отравлении
В случаях возникновения первых признаков отравления этими веществами необходимо срочно начать оказывать пострадавшему первую помощь.
К первой помощи можно отнести следующие меры:
вывести (в случае обморока — вынести) на свежий воздух;
- промыть водой горло и нос и напоить водой с добавлением лимонной кислоты;
- пораженные открытые участки тела обильно промыть проточной водой и накрыть повязкой для недопущения попадания на ранки инфекций;
- при попадании в пищеварительный тракт аммиака или его спирта высокой концентрации надо сделать промывание желудка, после чего напоить яичными белками, растительным маслом и молоком, после чего очистить кишечник;
- при попадании в глаза брызг аммиака их срочно надо промыть проточной водой, а кожу вокруг глаз смазать растительным маслом, при необходимости накрыть глаза повязкой.
В случае более тяжелых форм отравления необходимо срочно вызывать скорую помощь.
Аммиачный спирт обязателен в наборах медикаментов для первой помощи в аптечках и в нужный момент должен быть под рукой.
Сколько может стоить в аптеках? Ответ — совсем недорого. Приобретайте, пользуйтесь, но будьте предельно осторожны.
💥 Видео
Решение задач на ОВР-титрованиеСкачать

Решение задач по теме "Растворы" | Химия ЕГЭ, ЦТСкачать

Окисление этилового спирта оксидом меди(II)Скачать

Одноатомные спирты. Строение и физические свойства | Органическая химия ЕГЭ, ЦТСкачать

Задача на расчет молярной концентрации (См) по схемам ОВР + титрование.Скачать

Кислотно- основное титрование. Ацидиметрия и алкалиметрия. Индикаторы. 1 курс. ТФП.Скачать

Кондуктометрическое титрование (NaOH + HCl → NaCl + H₂O)Скачать

Спирты. Ч.3-2. Номенклатура одноатомных спиртов. Практика.Скачать

Предельные одноатомные спирты строение, номенклатура | Химия 10 класс #23 | ИнфоурокСкачать

Химические свойства неорганических веществ (задание 8)Скачать

Олег Ильев. Что такое теорема Гёделя о неполноте с точки зрения физика?Скачать

Решение задач на индуктивный и мезомерный эффекты в молекулах. Часть 1.Скачать


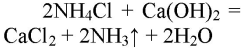
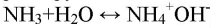
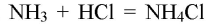
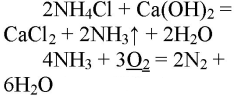
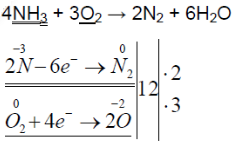
 для возбуждения дыхания при обморочных состояниях: для этого подносят к носу пострадавшего флакон с нашатырным спиртом; флакон надо держать в 5 см от носа, чтобы избежать ожога;
для возбуждения дыхания при обморочных состояниях: для этого подносят к носу пострадавшего флакон с нашатырным спиртом; флакон надо держать в 5 см от носа, чтобы избежать ожога;
 вывести (в случае обморока — вынести) на свежий воздух;
вывести (в случае обморока — вынести) на свежий воздух;