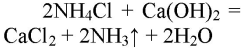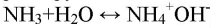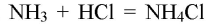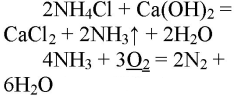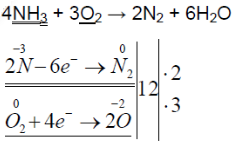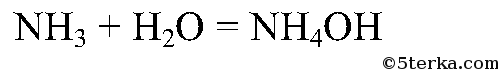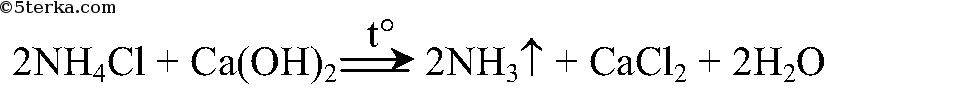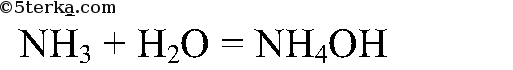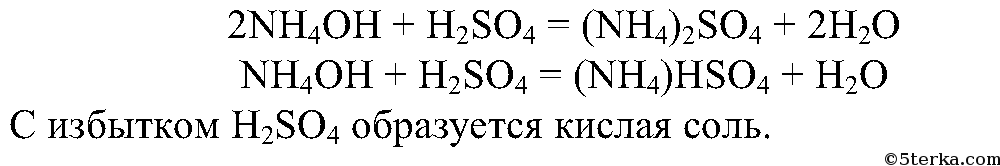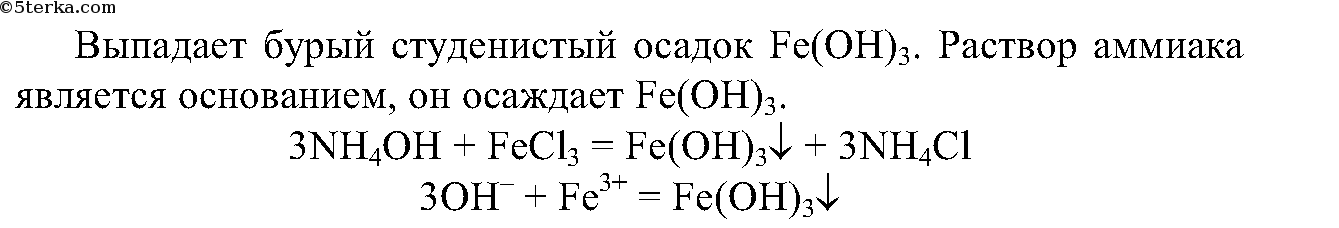Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
Видеолекции для
профессионалов
- Свидетельства для портфолио
- Вечный доступ за 120 рублей
- 311 видеолекции для каждого
Контрольная работа по теме: «Азот и фосфор» 9класс
Определите тип химической связи в каждом из предложенных соединений. Расставьте над каждым элементом, входящим в состав соединения степень окисления. Назовите каждое соединение.
Напишите возможные с точки зрения обратимости уравнения реакции:
Нитрат цинка и серная кислота 3)азотная кислота и хлорид серебра
Карбонат калия и азотная кислота 4) нитрат натрия и сульфид бария
Во всех возможных реакциях напишите молекулярное, полное ионное и сокращённое ионное уравнения.
Рассчитайте массовую долю азота в фосфате аммония.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции:
Укажите окислитель и восстановитель.
Используя сокращенное ионное уравнения составьте молекулярное и полное ионное уравнение:
Закончите уравнение реакций, расставьте коэффициенты, назовите полученные продукты реакции.
Контрольная работа по теме: «Азот и фосфор» 9класс
Определите тип химической связи в каждом из предложенных соединений. Расставьте над каждым элементом, входящим в состав соединения степень окисления. Назовите каждое соединение.
Напишите возможные с точки зрения обратимости уравнения реакции:
Хлорид аммония и вода 3)гидроксид кальция и нитрат аммония
Нашатырный спирт и гидроксид калия 4) аммиак и ортофосфорная кислота
Во всех возможных реакциях напишите молекулярное, полное ионное и сокращённое ионное уравнения.
Рассчитайте массовую долю фосфора в фосфате аммония.
Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции:
Укажите окислитель и восстановитель.
Используя сокращенное ионное уравнения составьте молекулярное и полное ионное уравнение:
Закончите уравнение реакций, расставьте коэффициенты, назовите полученные продукты реакции.
HNO 3 ( разб ) + Ca
«Как закрыть гештальт: практики и упражнения»
Свидетельство и скидка на обучение каждому участнику
Курс повышения квалификации
- Дистанционное обучение как современный формат преподавания
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Химия: теория и методика преподавания в образовательной организации
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
- § 25. Получение аммиака и изучение его свойств
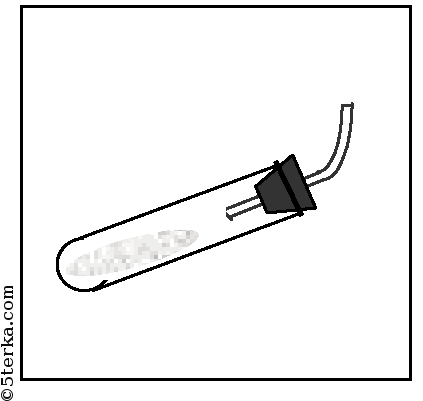
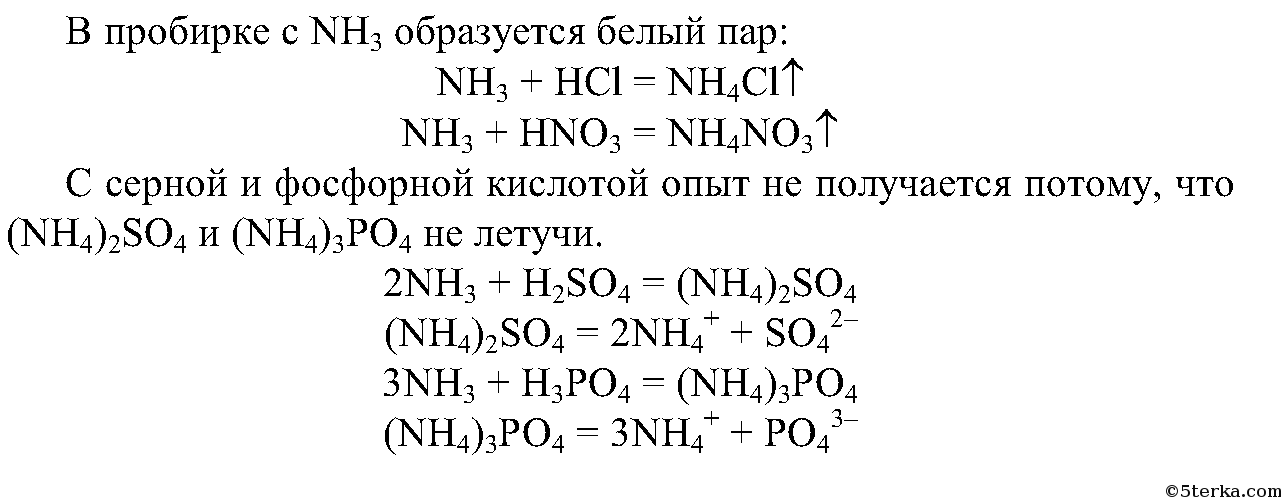
- 1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
- 2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
- 3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
- Напишите возможные с точки зрения обратимости уравнения реакции хлорид аммония и вода гидроксид
- Практическое занятие № 3. Получение аммиака и изучение его свойств. Ознакомление со свойствами водного раствора аммиака
- 🎬 Видео
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 852 человека из 77 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 46 человек из 20 регионов
Курс профессиональной переподготовки
Химия: теория и методика преподавания в образовательной организации
- Сейчас обучается 382 человека из 65 регионов
- Для всех учеников 1-11 классов
и дошкольников - Интересные задания
по 16 предметам
«Учись, играя: эффективное обучение иностранным языкам дошкольников»
Свидетельство и скидка на обучение
каждому участнику
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Дистанционные курсы для педагогов
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 853 883 материала в базе
Материал подходит для УМК
«Химия», Рудзитис Г.Е., Фельдман Ф.Г.
Ищем педагогов в команду «Инфоурок»
Другие материалы
- 08.05.2019
- 4067
- 43
- 07.05.2019
- 805
- 68
- 05.05.2019
- 526
- 4
- 04.05.2019
- 1377
- 20
- 02.05.2019
- 394
- 0
- 02.05.2019
- 3312
- 19
- 30.04.2019
- 749
- 0
- 29.04.2019
- 1156
- 9
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 08.05.2019 29981
- DOCX 17.4 кбайт
- 541 скачивание
- Рейтинг: 5 из 5
- Оцените материал:
Настоящий материал опубликован пользователем Рычагина Наталья Владимировна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 4 года и 7 месяцев
- Подписчики: 0
- Всего просмотров: 79465
- Всего материалов: 5
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
Вузы смогут разрешить студентам сдать выпускную работу на цифровом носителе
Время чтения: 1 минута
Минпросвещения предлагает изменить форму для проведения ВОШ
Время чтения: 1 минута
25% школ выбрали компьютерный формат проведения ВПР
Время чтения: 1 минута
ФИПИ опубликовал открытые варианты заданий ЕГЭ 2022 года
Время чтения: 1 минута
Онлайн-тренинг «Как закрыть гештальт: практики и упражнения»
Время чтения: 3 минуты
Тысячи учителей в Австралии вышли на забастовку
Время чтения: 2 минуты
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Вопросы к параграфу 25 — ГДЗ по Химии 9 класс Учебник Рудзитис, Фельдман
Авторы: Рудзитис Г.Е., Фельдман Ф.Г.
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

§ 25. Получение аммиака и изучение его свойств
1. Получение аммиака и растворение его в воде. 1) В фарфоровой ступке хорошо перемешайте приблизительно равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2 (опыт удаётся лучше, если известь слегка влажная). Приготовленную смесь насыпьте в пробирку на 1/3 её объёма. Закройте пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз (рис. 22). Нагрейте смесь в пробирке. 2) Как только почувствуете острый запах (нюхать осторожно!), пробирку с газом, не переворачивая, закройте пробкой, погрузите её в сосуд с водой и откройте пробку. 3) После заполнения пробирки водой закройте её отверстие пробкой и выньте пробирку из воды. Половину полученного раствора перелейте в другую пробирку. В одну пробирку поместите красную лакмусовую бумагу. В другую пробирку добавьте несколько капель раствора фенолфталеина, а затем немного разбавленной соляной кислоты. О каких свойствах водного раствора аммиака свидетельствует его действие на индикаторы? Как это можно объяснить с позиций теории электролитической диcсоциации? Что происходит при действии кислоты на водный раствор аммиака? Составьте уравнение соответствующей химической реакции.
1) В фарфоровой ступке перемешали равные объемы кристаллического хлорида аммония МН4Сl и порошка гидроксида кальция Са(ОН)2.
Приготовленную смесь насыпали в пробирку на 1/3 её объёма. Закрыли пробирку пробкой с газоотводной трубкой, конец которой опущен в другую сухую пробирку, закрепленную в штативе открытым концом вниз. Нагрели смесь в пробирке.
Как только почувствовали запах, закрыли пробирку и пробкой и погрузили в сосуд с водой. Открыли пробирку. Полученный раствор разделили на две части: в одну помещают лакмус, в другую — несколько капель фенолфталеина и разбавленную кислоту.
При реакции хлорида аммония с гидроксидом кальция выделяется бесцветный газ с запахом нашатырного спирта
Газ хорошо растворяется в воде и немного в с ней взаимодействует:
Лакмусовая бумажка в этом растворе окрашивается в синий цвет. Фенолфталеин окрашивает раствор в малиновый цвет, при добавлении соляной кислоты в раствор фенолфталеин обесцветится:
Получили аммиак. При его растворении образовывается водный раствор аммиака, обладающий основными свойствами (окрашивает индикаторы в цвет щелочной среды).
С позиции теории электролитической диссоциации аммиак — это основание (в растворе находятся
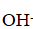
ионы).
Аммиак и соляная кислота образуют аммиачную соль. имеющую кислую среду (хлорид аммония — соль, образованная слабым основанием и сильной кислотой).
2. Горение аммиака в кислороде. Снова слегка нагрейте пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку введите в стеклянный цилиндр с кислородом и при помощи лучинки подожгите газ (рис. 23). Какие вещества образуются в процессе горения аммиака? Напишите уравнение соответствующей реакции. Подчеркните в уравнении одной чертой окислитель, а двумя — восстановитель.
Нагрели пробирку со смесью хлорида аммония и гидроксида кальция. Газоотводную трубку ввели в стеклянный цилиндр с кислородом и при помощи лучинки подожгли газ.
В результате реакции хлорида аммония и гидроксида кальция выделяется бесцветный газ с запахом нашатырного спирта:
При горящей лучинке аммиак горит жёлто-зелёным пламенем:
При горении аммиака образуются вода и азот. аммиак горит в чистом кислороде, но не в воздухе. при горении аммиак окисляется до азота, проявляет восстановительные свойства.
3. Взаимодействие аммиака с кислотами. В приборе для получения газов замените пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрейте. Газоотводную трубку последовательно введите в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки должен находиться на расстоянии 5—6 мм от поверхности кислоты. Как объяснить появление белого дыма? Напишите уравнения соответствующих реакций. Почему конец газоотводной трубки нельзя погружать в кислоту, а можно лишь приближать к ней?
В приборе для получения газов заменили пробирку с использованной смесью хлорида аммония и гидроксида кальция на пробирку со свежей порцией смеси. Пробирку слегка нагрели. Газоотводную трубку последовательно ввели в пробирки, в которых налито по 1 мл концентрированных азотной, соляной и серной кислот. Конец газоотводной трубки вывели на расстояние 5—6 мм от поверхности кислоты.
Наблюдается появление белого дыма, характерного для соли аммония:
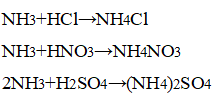
Конец газоотводной трубки можно только приближать к кислоте, а не погружать в неё, чтобы кислоту не засосало в смесь.
При взаимодействии аммиака с концентрированными кислотами образуются соли аммония.
Видео:Получение АММИАКА NH3. Реакция ХЛОРИДА АММОНИЯ и ГИДРОКСИДА НАТРИЯ. Опыты по химии дома.ЭкспериментыСкачать

Напишите возможные с точки зрения обратимости уравнения реакции хлорид аммония и вода гидроксид
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1 Составьте схему образования химической связи в молекуле аммиака.
Упражнение 2 Охарактеризуйте физические и химические свойства аммиака. Свяжите их с областями применения этого соединения.
Физические свойства аммиака.
Аммиак ― бесцветный газ с резким характерным запахом, легче воздуха, хорошо растворяется в воде.
Водный раствор аммиака используется в медицине и в быту под названием аммиачная вода, а 10%-ный раствор аммиака в воде более известен под названием нашатырный спирт. Аммиак используется в качестве хладагента в промышленных холодильных установках, т.к. легко сжижается при повышении давления, а испарение сопровождается поглощением теплоты, в результате чего и происходит охлаждение.
Химические свойства аммиака.
1. Водный раствор аммиака изменяет окраску индикатора, т.к. гидрат аммиака – слабый электролит, он незначительно диссоциирует на катион аммония и гидроксид-анион:
NH3•H2O ⇄ NH4 + + OH —
2. Горит в избытке кислорода, при этом образуется азот и водяные пары:
4HN3 + 3O2 = 2N2 + 6H2O
3. Восстанавливает металлы с их оксидов:
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Схема окислительно-восстановительной реакции.
N -3 H3 + Cu +2 O → N2 0 + Cu 0 + H2O
2N -3 -6ē → N2 0 |6|6|1 ― процесс окисления
Cu +2 +2ē → 2Cu 0 |2| |3 ― процесс восстановления
В приведённой реакции аммиак (за счёт атомов азота в степени окисления -3) — восстановитель.
4. Водный раствор аммиака реагирует с кислотами, образуя соли аммония:
NH3 + HCl = NH4Cl
2NH3 + H2SO4 = (NH4)2SO4
Аммиак ― исходное вещество для солей аммония, которые используют в качестве удобрений (фосфаты, хлорид, нитрат аммония), как компоненты взрывчатых веществ (нитрат аммония или аммиачная селитра), в пищевой промышленности (гидрокарбонат, карбонат, хлорид аммония), при выделке кож и (сульфат аммония).
Упражнение 3 Почему аммиак в окислительно-восстановительных реакциях проявляет свойства восстановителя? В аммиаке атом азота обладает минимальной степенью окисления (-3), поэтому он проявляет только восстановительные свойства.
Упражнение 4 В чём состоит донорно-акцепторный механизм образования ковалентной связи? Подтвердите свои рассуждения рассмотрением строения катиона аммония.
Донорно-акцепторный механизм образования ковалентной связи состоит в том, что связь формируется за счёт неподелённой пары электронов атома-донора и свободной орбитали атома-акцептора.
Например, образование катиона аммония происходит в результате возникновения ковалентной связи между атомом азота, имеющим свободную электронную пару (она называется неподелённой), и катионом водорода, который переходит к аммиаку от молекул кислоты. Первый атом называется донором, а второй ― акцептором. 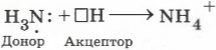
Какой ещё механизм образования ковалентной связи вам известен? Обменный механизм образования ковалентной связи. Например, образование молекулы хлороводорода.
Упражнение 5 Запишите сокращённое ионное уравнение качественной реакции на катион аммония.
NH4 + + OH — = NH3↑ + H2O
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1 Напишите уравнения реакций получения нитрида натрия и его взаимодействия с водой.
6Na + N2 = 2Na3N
Na3N + 3H2O = 3NaOH + NH3↑
Какая из этих реакций является окислительно-восстановительной?
Реакция получения нитрида натрия, т.к. в ходе химического превращения происходит изменение степени окисления атомов элементов натрия и азота:
6Na + N2 = 2Na3N
Схема окислительно-восстановительной реакции.
Na 0 + N2 0 ⟶ Na3 +1 N -3
Восстановитель Na 0 — 1ē ⟶ Na +1 |1|6|6 ― процесс окисления
Окислитель N2 0 + 6ē ⟶ 2N -3 |6| |1 ― процесс восстановления
Проводим вертикальную черту и пишем за ней число электронов, которые отдали и присоединили атомы натрия и азота. Находим наименьшее общее кратное для чисел 1 и 6 . Это число 6, которое записываем за второй вертикальной чертой посередине, и поделив его поочередно на 1 и 6, записываем результат за третьей чертой в строках, касающихся элементов натрия и азота. Множители 6 и 1 являются искомыми коэффициентами. Поскольку эти элементы изменили степень окисления полностью (в правой части схемы этот элемент ни в одном веществе не проявляет такую же степень окисления, как в исходном веществе) и разными являются индексы этих элементов в формуле исходного вещества и продукта реакции, поэтому ставим коэффициент 6 перед формулой натрия Na и коэффициент 1 (который обычно не пишем) перед формулой азота N2. Подбираем коэффициенты для остальных соединений.
Упражнение 2 С какими из перечисленных веществ реагирует аммиак: водород, азотная кислота, кислород, гидроксид натрия, вода, хлорид калия, оксид меди (II), железо, сульфат аммония? Запишите уравнения соответствующих реакций.
NH3 + HNO3 = NH4NO3
4NH3 + 3O2 = 2N2 + 6H2O
NH3 + H2O ⇄ NH4OH
2NH3 + 3CuO = N2 + 3Cu + 3H2O
Упражнение 3 В двух пробирках без подписи находятся растворы хлорида аммония и хлорида натрия. Какими способами можно распознать эти вещества? Распознать хлорид аммония можно с помощью щелочи NaOH. В пробирке с раствором хлорида аммония выделяющийся аммиак обнаруживают по запаху или посинению влажной красной лакмусовой бумаги. В пробирке с хлоридом натрия никаких изменений не наблюдаем.
Ответ подтвердите уравнениями соответствующих реакций.
NH4Cl + NaOH = NaCl + H2O + NH3↑
NH4 + + Cl — + Na + + OH — = Na + + Cl — + H2O + NH3↑
NH4 + + OH — = H2O + NH3↑
Упражнение 4 В 150 мл воды растворили 67,2 л аммиака (н.у.). Рассчитайте массовую долю аммиака в полученном растворе.
Дано: V(H2O)=150 мл, V(NH3)=67,2 л
Найти: ω(NH3)-?
Решение
1. Вычисляем количество вещества аммиака объёмом 67,2 л по формуле: ʋ =V:VM, где VM=22,4 л/моль при н.у.
ʋ(NH3 )=V( NH3 ):VM=67,2 л : 22,4 л/моль=3 моль
2. Вычисляем массу аммиака в количестве вещества 3 моль по формуле: ʋ=m/M, где M=Mr г/моль.
M ( NH3 )=17 г/моль
m(NH3)= ʋ(NH3) • M(NH3)=3 моль • 17 г/моль=51 г
3. Рассчитываем массу воды:
m(H2O)=V(H2O)•ρ(H2O)=150 мл • 1 г/мл=150 г. Поскольку ρ(Н2О)=1 г/мл, то для воды объём численно равен массе, поэтому данное действие не является обязательным.
4. Рассчитываем массу раствора:
m(раствора)=m(H2O)+m(NH3)=150 г + 51 г = 201 г
5. Вычисляем массовую долю аммиака в полученном растворе:
ω( NH3 )= m ( NH3 ):m(раствора)•100%=51 г : 201 г • 100%=25,4%
Ответ: 25,4%
ВЫРАЗИТЕ МНЕНИЕ
Упражнение 1 Постройте круговые диаграммы, отражающие массовые доли химических элементов в следующих солях: нитрат калия, нитрат аммония, нитрат кальция, сульфат аммония.
Mr(KNO3)=101, Mr(NH4NO3)=80, Mr(Ca(NO3)2)=164, Mr((NH4)2SO4)=132
ω1(N)=Ar(N):Mr(KNO3)=14:101=0,139, или 13,9%
ω2(N)=2•Ar(N):Mr(NH4NO3)=2•14:80=0,35, или 35%
ω3(N)=2•Ar(N):Mr(Ca(NO3)2)=2•14:164=0,171, или 17,1%
ω 4(N)=2•Ar(N):Mr((NH4)2SO4)=2•14:132=0,212, или 21,2%
ω 3(N) ω1(N) ω4(N) ω2(N)
Какую из этих солей вы бы рекомендовали использовать в качестве азотного удобрения? Л учше всего использовать нитрат аммония, т.к. в нем наибольшее содержание азота (35%).
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Практическое занятие № 3. Получение аммиака и изучение его свойств. Ознакомление со свойствами водного раствора аммиака
Задания. 1. Получите аммиак по реакции гидроксида кальция с хлоридом аммония.
2. Изучите некоторые физические свойства аммиака (цвет, запах, относительную плотность, растворимость в воде).
3. Изучите взаимодействие аммиака с водой, азотной и соляной кислотами.
4. Проделайте реакции:а) между раствором аммиака в воде и серной кислотой;б) между гидроксидом аммония и раствором хлорида железа (III).
Соблюдайте правила техники безопасности при проведении опытов!
Оборудование. Детали прибора для получения аммиака, лабораторный штатив, штатив с пробирками, фарфоровая ступка с пестиком, ложечка или шпатель, стеклянные палочки (2 шт.), пробка с держателем, нагревательный прибор.
Вещества. Кристаллические гидроксид кальция и хлорид аммония; концентрированная соляная, концентрированная азотная и 20% -я серная кислоты; вода (в стакане), раствор фенолфталеина, раствор хлорида железа (III).
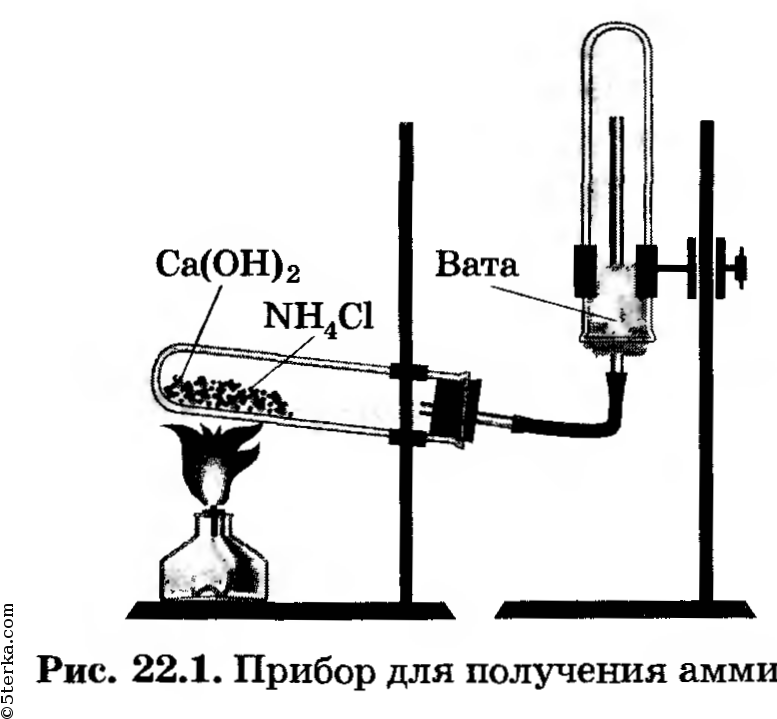
Получение аммиака. Соберите прибор для получения аммиака (рис. 22.1), испытайте на герметичность. За
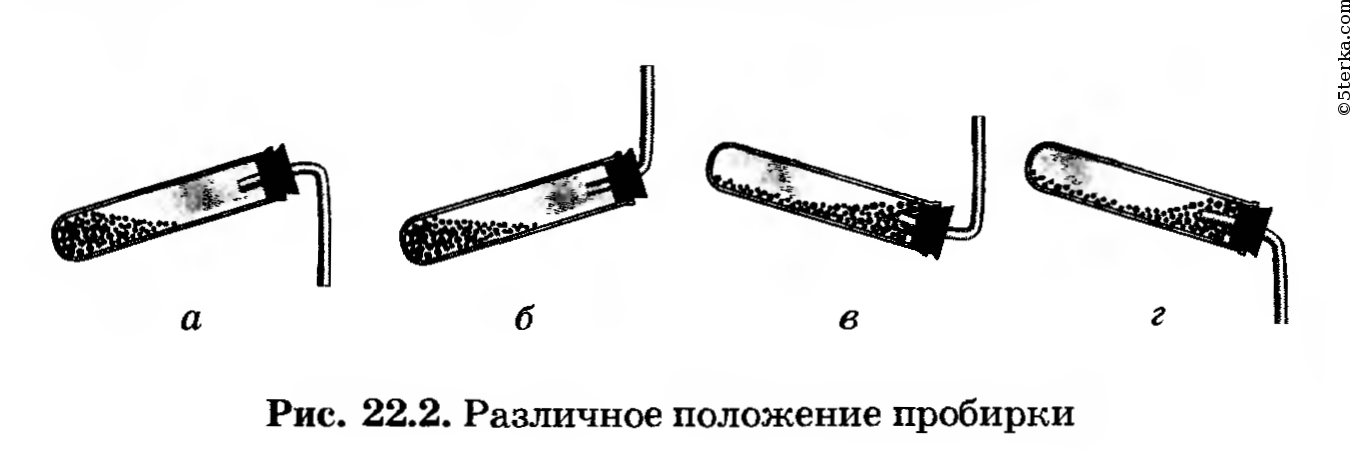
крепите его в штативе так, чтобы удобно было нагревать пробирку. Решите, какое положение пробирки (рис. 22.2, а, б, в или г) является правильным.
Приготовьте три сухих (почему?) пробирки, которые предстоит наполнить аммиаком. Закройте их пробками.
В ступку насыпьте по одной ложечке хлорида аммония и гидроксида кальция, перемешайте их, разотрите пестиком. Затем перенесите порцию смеси в пробирку прибора, заполнив ее не более чем на 1/3.
Начните нагревать содержимое пробирки, при этом сначала обогрейте пламенем горелки всю пробирку, затем пламя направьте так, чтобы нагревалась поверхность смеси.
Наполните три пробирки аммиаком, заткните их пробками с держателями; прекратите нагревание и, не разбирая прибора, перенесите его в вытяжной шкаф.
Изучение свойств аммиака.
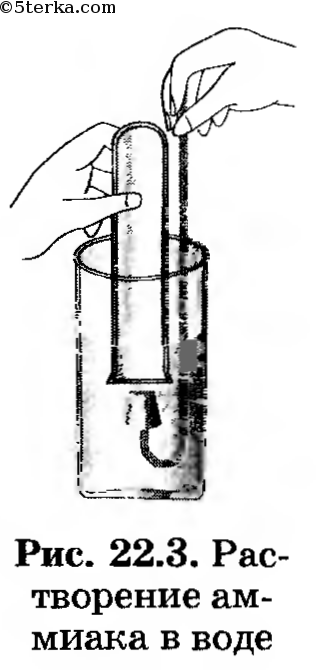
1. Исследуйте растворимость, взаимодействие аммиака с водой. Для этого опустите пробирку с аммиаком в стакан с водой и под водой откройте ее, как это показано на рисунке 22.3.
Что вы наблюдаете?
Не вынимая пробирку, закройте ее также под водой пробкой с держателем, после чего поставьте в штатив. К полученному раствору добавьте 2—3 капли раствора фенолфталеина.
Составьте уравнение реакции взаимодействия аммиака с водой.
2. Смочите стеклянную палочку концентрированной соляной кислотой, другую — концентрированной азотной кислотой. Внесите их поочередно в пробирки с аммиаком. Что вы наблюдаете?
Составьте уравнения происходящих реакций.
Почему опыт не получится при использовании серной и фосфорной кислот?
3. Разлейте полученный водный раствор аммиака в воде в две пробирки. В одну пробирку добавьте несколько капель раствора фенолфталеина и осторожно прилейте серную кислоту до исчезновения окраски индикатора. Что вы наблюдаете?
Составьте уравнения реакций образования сульфата и гидросульфата аммония.
4. В другую пробирку с раствором аммиака добавьте раствор хлорида железа (III). Что вы наблюдаете?
Запишите ионные уравнения реакций.
Правильное положение пробирки под б). Во-первых, NH3 легче, чем воздух, он будет подниматься вверх, поэтому газоотводная трубка должна также быть направлена вверх. Во-вторых, мы будем нагревать вещество в пробирке, поэтому оно не должно соприкасаться с пробиркой, которая от огня может расплавиться.
Пробирки должны быть сухими, т.к. аммиак реагирует с водой и в результате образуется гидроксид аммония.
Реакция получения аммиака:
Изучение свойств аммиака:
Аммиак хорошо растворяется в воде:
Раствор обесцвечивается, поскольку серная кислота нейтрализует аммиак, т.е. среда становится нейтральной. В нейтральной и кислой среде фенолфталеин бесцветный.
задача №3
к главе «Практические занятия».
🎬 Видео
Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

хлорид аммония с гидроксидомСкачать

Практическая работа №6. Получение аммиака и опыты с ним. 9 класс.Скачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Термическое разложение хлорида аммония NH4ClСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

ВСЕ неорганические реакции | ЕГЭ по Химии | Катя СтрогановаСкачать

NH3 + HCl = NH4Cl | Получение хлорида аммонияСкачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Химическое равновесие, Задание 22 ЕГЭ по химии | ЕГЭ по химии 2024Скачать

Химия 9 класс — Как определять Степень Окисления?Скачать

Реакция хлорида аммония с реактивом НесслераСкачать

Образование хлорида аммонияСкачать

Аммиак, химические свойства аммиака. NH3 + HCl → NH4Cl и FeCl3 + 3NH3 + 3H2O → Fe(OH)3 + 3NH4ClСкачать