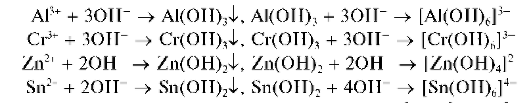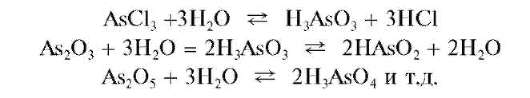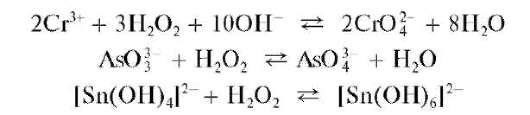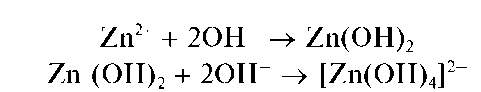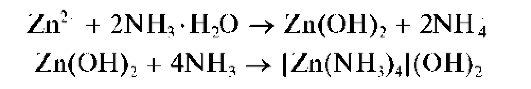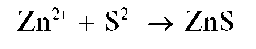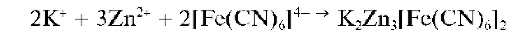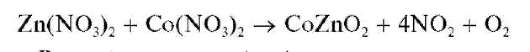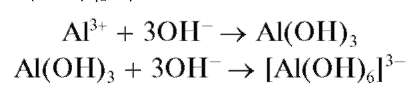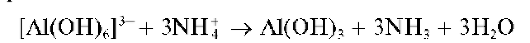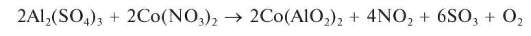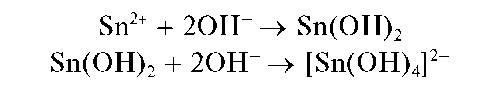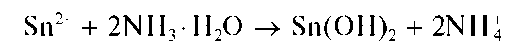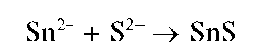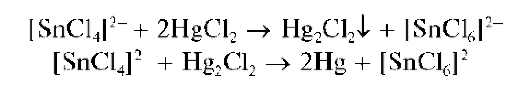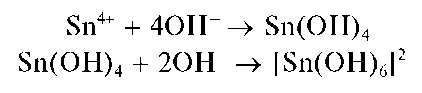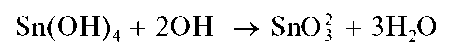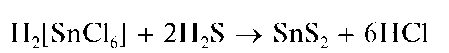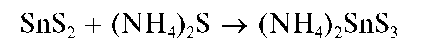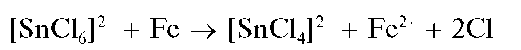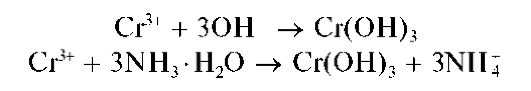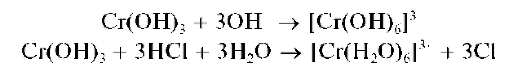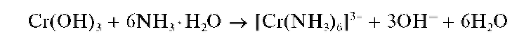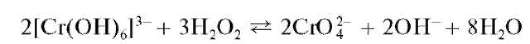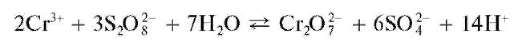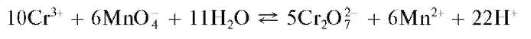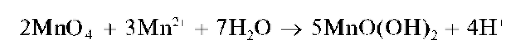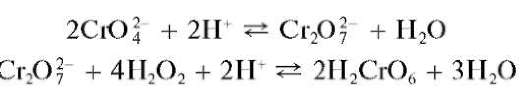Предварительные испытания. 1.Открытие катионов алюминия Al 3+ . Катионы алюминия открывают капельным методом с ализарином. Проведению этой реакции мешают катионы Zn 2+ , Cr 3+ и другие. Поэтому капельную реакцию с ализарином проводят на фильтровальной бумаге, пропитанной раствором K4[Fe(CN)6]. Катионы, которые мешают реакции, связываются при этом в соответствующие малорастворимые гаксацианоферраты (II) и образуют на бумаге темное пятно. Катионы Al 3+ перемещаются с водным раствором к периферии пятна, где при последующей реакции с ализарином в парах аммиака образуют комплекс розового цвета (бумага окрашивается в розово-красный цвет).
Для проведения реакции 2-3 капли анализируемого раствора наносят в центр листа фильтровальной бумаги, пропитанной раствором K4[Fe(CN)6]. Лист выдерживают в парах аммиака. Мешающие катионы дают темное пятно смеси гексацианоферратов (II), а катионы алюминия образуют Al(OH)3. На влажное пятно наносят 1-2 капли раствора ализарина и снова выдерживают бумагу над парами аммиака. Образуется розовый комплекс алюминия с ализарином. Пятно смачивают раствором уксусной кислоты и дают возможность растворителю самопроизвольно (за счет действия капиллярных сил) переместиться от центра пятна к периферии. Вместе с растворителем перемещаются катионы Al 3+ , образующие комплекс с ализарином, окрашивающий периферийный участок бумаги в розово-красный цвет на фиолетовом фоне (цвет ализарина). При высушивании бумаги фиолетовый фон ализарина исчезает, а розово-красная окраска комплекса остается, поскольку последний устойчив в уксуснокислой среде.
2.Открытие катионов Cr 3+ .Катионы Cr 3+ предварительно открывают, окисляя их пероксидом водорода до хромат-ионов CrO4 2 — в присутствии щелочи. Если при прибавлении к пробе анализируемого раствора нескольких капель пероксида водорода и щелочи раствор окрашивается в желтый цвет, то это указывает на присутствие катионов Cr 3+ , которые окислились до хромат-ионов, придающих раствору желтую окраску.
Для дополнительного подтверждения наличия ионов хрома (III) проводят реакцию образования надхромовой кислоты Н3CrO8. Для этого к отдельной порции раствора прибавляют смесь NaOH + H2O2. Смесь нагревают на водяной бане, охлаждают до комнатной температуры, добавляют еще пероксид водорода и органический растворитель, не смешивающийся с водой. Тщательно перемешивают полученную смесь и добавляют к ней серную кислоту. Если верхний органический слой окрашивается в интенсивный синий цвет, то это указывает на присутствие надхромовой кислоты в органической фазе.
3.Открытие катионов Zn 2+ . Катионы цинка открывают реакцией с сульфидом аммония или натрия: (NH4)2S или Na2S по выпадению белого осадка сульфида цинка ZnS. Для этого к анализируемому раствору прибавляют по каплям раствор NaOH до сильно щелочной реакции. К образовавшемуся раствору добавляют СН3СООН до кислой реакции; после этого – несколько капель Na2S. В присутствии Zn 2+ выпадает белый осадок сульфида цинка.
Катион Zn 2+ можно обнаружить также по белому осадку при действии раствора K4[Fe(CN)6].
Систематический ход анализа. Анализируемый раствор обрабатывают избытком группового реагента – раствором NaOH в присутствии Н2О2 при нагревании. Катион Cr 3+ переходит в анион CrO4 2 — . Выпавшие осадки гидроксидов растворяются в избытке группового реагента. Получают щелочной раствор, содержащий анионы [Zn(OH)4] 2 — , [Al(OH)6] 3 — , CrO4 2 — .
Затем катионы алюминия отделяют в виде осадка Al(OH)3 действием кристаллического хлорида аммония. Осадок отделяют, в растворе остаются ионы [Zn(OH)4] 2 — (или [Zn(NH3)4] 2+ ), CrO4 2 — .
Осадок Al(OH)3 растворяют в соляной кислоте и открывают катионы алюминия реакцией с ализарином.
В растворе, полученном после отделения гидроксида алюминия, открывают катионы Zn 2+ и хрома (VI) дробным методом, используя реакции, описанные в предварительных испытаниях.
Систематический ход анализа смеси катионов III аналитической группы представлен в табл. 5.2.
Схема хода систематического анализа смеси катионов
Видео:Качественные реакции на катионы и анионы. Практическая часть. 9 класс.Скачать

—>Аналитические группы катионов —>
IV аналитическая группа: Zn 2+ ,Al 3+ ,Sn 2+ ,Sn 4+ ,As 3+ ,As 5+ ,Cr 3+
При действии группового реагента (водного раствора гидроксида натрия NaOH или калия KOH в присутствии пероксида водорода H2O2) катионы четвертой аналитической группы осаждаются из водного раствора в виде амфотерных гидроксидов, растворимых в избытке щелочи с образованием гидроксокомплексов, например:
В присутствии пероксида водорода катионы Cr 3+ ,As 3+ иSn 2+ окисляются соответственно до хромат-ионов CrO4 2- , арсенат-ионов AsO4 3 — и гексагидроксостаннат(IV)-ионов [Sn(OH)6] 2- .
Осадки гидроксидов катионов четвертой аналитической группы не растворяются в водном аммиаке, за исключением гидроксида цинка Zn(OH)2, который растворяется в водном растворе аммиака с образованием аммиачного комплекса [Zn(NH3)4] 2+ .
Даже если исходное вещество и содержало формально мышьяк в виде катионов, например, AsCl3,As2O3,As2O5 и т. д., то в водной среде оно гидролизуется с дальнейшим образованием анионной формы мышьяка(III) или мышьяка(V):
В соответствии с изложенным при проведении анализа по кислотно-основному методу обычно используют аналитические реакции на арсенитили арсенат-анионы, а не на катионы мышьяка(Ш) или мы-шьяка(V).
Действие группового реагента
При действии группового реагента (избыток 2 моль/л раствора гид-роксида натрия NaOH в присутствии пероксида водорода H2O2)нарас-твор, содержащий смесь катионов четвертой группы, наряду с образованием гидроксокомплексов происходит одновременное окисление пероксидом водорода хрома(Ш), мышьяка(Ш), олова(11) до высших степеней окисления с образованием соответственно анионов CrO 4 2 — , AsO 4 2- ,[Sn(OH)6] 2- :
Методика. В четыре пробирки помещают по нескольку капель растворов солей алюминия(III), хрома(III), цинка, олова(II). В каждую пробирку осторожно, по каплям добавляют раствор гидроксида натрия, наблюдая за образованием аморфных осадков Al(OH)3,Zn(OH)2, Sn(OH)2 белого цвета, Cr(OH)3 — серо-зеленого или сине-фиолетового цвета. При последующем добавлении избытка гидроксида натрия осадки растворяются, давая при растворении гидроксидов алюминия, цинка, олова(II) бесцветные растворы, а при растворении гидр-оксида хрома(III) — зеленый раствор (цвет гидроксокомплексов хрома(III)).
При добавлении к зеленому раствору соли хрома нескольких капель раствора пероксида водорода и нагревании на водяной бане в течение 5-7 минут окраска переходит в желтую (цвет хромат-иона). Аналогичный эффект получают и при добавлении избытка гидроксида натрия к раствору соли хрома(III), в который заранее был добавлен пероксид водорода.
Изучают также действие раствора аммиака на соли алюминия, цинка, хрома(III) и олова(II) при недостатке и избытке реагента.
Аналитические реакции катиона цинка Zn 2+
Реакция с щелочами. Катионы Zn 2+ образуют с гидроксидами щелочных металлов белый осадок гидроксида цинка Zn(OH)2, растворяющийся в избытке щелочи с образованием бесцветного гидроксокомплекса [Zn(OH)4] 2- :
Методика. В пробирку вносят 5-6 капель раствора хлорида цинка ZnCl2, прибавляют 1-2 капли раствора NaOH. Выпадает белый осадок гидроксида цинка. Продолжают прибавлять по каплям раствор NaOH при перемешивании содержимого пробирки. Осадок растворяется.
Реакция с раствором аммиака. Как и щелочи, аммиак вначале образует с катионами Zn 2+ белый осадок гидроксида цинка, который при дальнейшем прибавлении раствора аммиака растворяется с образованием бесцветного аммиачного комплекса цинка [Zn(NH3)4] 2+ :
Методика аналогична предыдущей.
Реакция с сульфид-ионами (фармакопейная). Катионы Zn 2+ образуют с сульфид-ионами S 2- в нейтральной, слабокислой или слабощелочной среде (2
Осадок не растворяется в уксусной кислоте, но растворяется в растворах HO и других минеральных кислот. Реакцию часто проводят в уксуснокислой среде, так как в этих условиях открытию Zn 2+ не мешают остальные катионы четвертой аналитической группы, за исключением олова(II).
Методика. К 2-3 каплям раствора ZnCl2 прибавляют 1-2 капли свежеприготовленного раствора сульфида аммония (NH4)2S. Выпадает белый осадок сульфида цинка.
Реакция с гексацианоферратом(II) калия (фармакопейная). Катионы Zn 2+ образуют (быстрее — при нагревании) с K4[Fe(CN)6] в нейтральной или слабокислой среде белый осадок смешанного гексацианоферрата(II) калия и цинка K2Zn3[Fe(CN)6]2:
Осадок нерастворим в разбавленной HO; растворяется в щелочах, поэтому реакцию нельзя проводить в щелочной среде. Мешают все катионы, образующие малорастворимые ферроцианиды. Катионы Al 3+ и Cr 3+ не мешают.
Предельная концентрация при обнаружении катионов цинка составляет
Методика. В пробирке к 5-10 каплям раствора ZnCl2 прибавляют 5-6 капель раствора K4[Fe(CN)6]. Смесь нагревают до кипения. Выпадает белый осадок гексацианоферрата(П) калия и цинка.
Реакция с дитизоном (дифенилтиокарбазоном). При смешивании хлороформного раствора дитизона (экстракционный реагент) с водным щелочным раствором, содержащим катионы Zn 2+ , образуется дитизонатный комплекс цинка красного цвета, экстрагирующийся из водной фазы в органическую. Хлороформный слой принимает более интенсивную красную окраску, чем водный.
Протекание реакции предположительно можно описать следующей схемой. В растворах дитизона устанавливается таутомерное равновесие между тионной и тиольной формами:
Тиольная форма представляет собой слабую двухосновную кислоту, способную отщеплять ионы водорода, в первую очередь — от группы SH, и образовывать комплексы с ионами металлов-комплексообразо-вателей. Если отщепляется только один протон, то в результате реакции с катионами цинка возникает внутрикомплексное соединение, содержащее два дитизонатных аниона:
Наличие щелочи способствует смещению равновесия вправо вследствие связывания выделяющихся ионов водорода в молекулы воды.
Реакция высокочувствительна: предел обнаружения — 0,025 мкг. Позволяет открывать катионы цинка при очень низких концентрациях. Мешают катионы, также образующие дитизонатные комплексы (Cd 2+ ,Pb 2+ , Sn(II) и др.).
Методика. В пробирку вносят 5-10 капель раствора ZnCl2,прибав-ляют постепенно несколько капель раствора NaOH до растворения выпавшего белого осадка гидроксида цинка и
5 капель хлороформного раствора дитизона. Пробирку встряхивают несколько раз. После расслоения смеси хлороформный слой окрашивается в красный цвет.
Реакция образования «зелени Ринмана». При нагревании смеси нитрата цинка Zn(NO3)2 и нитрата кобальта Co(NO3)2протекает реакция образования смешанного оксида кобальта и цинка CoZnO2 зеленого цвета — так называемой «зелени Ринмана»:
Методика. В пробирке или в фарфоровом тигле смешивают
5 капель раствора Co(NO3)2.Смесь нагревают до кипения и кипятят около минуты. Горячим раствором смачивают полоску фильтровальной бумаги, высушивают ее и озоляют в фарфоровом тигле на газовой горелке. Образуется зола зеленого цвета.
Другие реакции катионов цинка. Катионы Zn 2+ при реакциях в растворах образуют осадки разного состава: с тетрароданомеркуратом(II) аммония (NH4)2[Hg(SCN)4] — белый тетрароданомеркурат(II) цинка Zn[Hg(SCN)4]; с хлоридом кобальта CoCl2 и (NH4)2[Hg(SCN)4]-голубой, белый Zn3(PO4)2 (растворяется в кислотах и в аммиаке), а в присутствии аммиака — менее растворимый белый NH4ZnPO4 (растворяется в кислотах, щелочах, аммиаке); c карбонатом натрия или калия — белый осадок основной соли переменного состава; с K2CrO4 — желтый ZnCrO4(растворяется в кислотах и щелочах). Катионы цинка образуют также осадки комплексных соединений с различными органическими реагентами.
Аналитические реакции катиона алюминия Al 3+
Реакция с щелочами. Катионы Al 3+ при реакциях с щелочами в растворах дают белый осадок гидроксида алюминия Al(OH)3, который растворяется в избытке щелочи с образованием гидроксокомплекса [Al(OH)6] 3- (иногда гидроксокомплексам алюминия в растворе приписывают состав [Al(OH)4] — ):
Наиболее полное осаждение гидроксида алюминия происходит при pH = 5-6. Осадок Al(OH)3 растворяется в кислотах, но не растворяется в аммиаке.
При добавлении солей аммония к щелочному раствору (особенно при нагревании), полученному после растворения гидроксида алюминия, гидроксокомплексы алюминия разрушаются и снова выпадает осадок гидроксида алюминия:
Методика. В пробирку вносят 3-5 капель раствора хлорида алюминия AlCl3 и прибавляют по каплям раствор NaOH. Выпадает белый осадок гидроксида алюминия. Продолжают прибавление по каплям раствора NaOH. Осадок растворяется.
К раствору прибавляют несколько кристаллов хлорида аммония и нагревают смесь. Снова выпадает осадок гидроксида алюминия.
Реакция с аммиаком. Катионы Al 3+ образуют с аммиаком, как и с щелочами, белый аморфный осадок гидроксида алюминия.
В избытке раствора аммиака осадок не растворяется, в отличие от действия щелочей. Методика — аналогична предыдущей.
Реакция с нитратом кобальта — образование «тенаровой сини» (фармакопейная). При прокаливании соли алюминия, смоченной разбавленным раствором нитрата кобальта Co(NO3)2, образуется смешанный оксид алюминия и кобальта (алюминат кобальта) Co(AlO2)2 синего цвета — так называемая «тенаровая синь»:
Методика. Полоску фильтровальной бумаги смачивают вначале 1-2 каплями раствора сульфата алюминия Al2(SO4)3, а затем 1-2 каплями разбавленного раствора нитрата кобальта. Бумагу высушивают, помещают в фарфоровый тигель и озоляют на газовой горелке. Получают золу синего цвета — «тенаровую синь».
Реакция с ализарином. Ализарин — 1,2-диоксиантрахинон, а также некоторые его производные при реакциях с катионами Al 3+ в аммиачной среде образуют малорастворимые комплексные соединения ярко-красного цвета, называемые «алюминиевыми лаками». С ализарином реакция протекает по схеме:
Комплекс устойчив в уксуснокислой среде. Реакция высокочувствительна: предел обнаружения — 0,5 мкг. Мешают катионы, также образующие комплексы с ализарином (Zn 2+ ,Sn(II),Cr 3+ ,Mn 2+ ,Fe 3+ идр.).
Реакцию можно выполнять капельным методом на фильтровальной бумаге.
Методика. На лист фильтровальной бумаги наносят 1-2 капли раствора соли алюминия. Бумагу держат 1-2 мин в парах аммиака над склянкой с концентрированным раствором аммиака. Пары аммиака, соприкасаясь с влажным пятном, образуют на бумаге гидроксид алюминия.
На пятно наносят каплю раствора ализарина и снова держат бумагу в парах аммиака. Пятно вначале окрашивается в фиолетовый цвет (цвет фона ализарина). Бумагу подсушивают, наносят на нее 1-2 капли раствора уксусной кислоты и снова высушивают. Пятно становится розово-красным.
Если в растворе одновременно с катионами алюминия присутствуют другие катионы, также дающие с ализарином комплексы, то капельную реакцию с ализарином проводят на фильтровальной бумаге, пропитанной раствором ферроцианида калия K4[Fe(CN)6]. При нанесении капли раствора на такую бумагу образуются малорастворимые ферроцианиды мешающих катионов, дающие темное пятно, а катионы Al 3+ , не дающие осадка ферроцианида, при прибавлении капли воды переносятся растворителем на периферию пятна, где после обработки парами аммиака и раствором ализарина образуют ализариновый комплекс алюминия. При высушивании бумаги фиолетовый фон ализарина исчезает, а красная окраска алюминиевого лака — остается.
Реакция с алюминоном. Катион Al 3 + при взаимодействии с алюминоном — аммонийной солью ауринтрикарбоновой ислоты (обозначим ее для краткости NH4L) образует в уксуснокислой или аммиачной среде комплекс красного цвета (по-видимому, состава Al(OH)2L). Точно строение комплекса в растворе неизвестно.
Реакция высокочувствительна. Мешают катионы Ca 2+ ,Cr 3+ ,Fe 3+ , также образующие окрашенные комплексы с алюминоном.
Методика. В пробирку вносят 3-4 капли раствора соли алюминия, 2-3 капли раствора уксусной кислоты и 3-5 капель 0,01 % раствора алюминона. Смесь нагревают на водяной бане, прибавляют несколько капель раствора аммиака до щелочной реакции (по лакмусовой бумаге) и 2-3 капли раствора карбоната аммония. Выпадает красный хлопьевидный осадок.
Другие реакции катиона алюминия. Катионы Al 3+ образуют также осадки при реакциях в растворах: с Na2HPO4 — белый AlPO .j^ CH3COONa — белый CH3COOAl(OH)2, с оксихинолином (краткое условное обозначение HОx) — желто-зеленый [Al(Ox)3]и с другими неорганическими и органическими реагентами.
Аналитические реакции катиона олова(II)
Реакция с щелочами. Соединения олова(II) при взаимодействии с щелочами выделяют из растворов белый осадок гидроксида олова(II) Sn(OH)2, растворимый в избытке реагента с образованием гидроксо-комплекса [Sn(OH)4] 2- :
Осадок Sn(OH)2 растворяется в кислотах.
Методика. В пробирку вносят несколько капель раствора соли олова(II) (обычно — солянокислого) и прибавляют по каплям раствор NaOH: вначале до выпадения белого осадка Sn(OH)2, а затем — до его растворения.
Реакция с аммиаком. При прибавлении раствора аммиака к раствору, содержащему олово(II), выделяется белый осадок гидроксида олова Sn(OH)2, который не растворяется в избытке аммиака:
Методика проведения реакции аналогична предыдущей.
Реакция с сульфид-ионами. При взаимодействии олова(II) с сульфид-ионами S 2- из раствора выпадает темно-коричневый осадок сульфида олова(II) SnS:
Осадок не растворяется в щелочах, в избытке раствора сульфида натрия.
Методика. К нескольким каплям раствора соли олова(II) прибавляют несколько капель раствора сульфида натрия Na2S (или же сульфида аммония (NH4)2S либо сероводородной воды). Выпадает бурый осадок сульфида олова(II) SnS.
Реакция с солями висмута(III). Олово(II) является хорошим восстановителем. Так, при взаимодействии с висмутом(III) в щелочной среде оно восстанавливает висмут(III) до металлического висмута, само окисляется до олова(IV):
Металлический висмут, выделяясь в тонкодисперсном состоянии, образует осадок черного цвета.
Методика. В пробирку вносят 3- 5 капель раствора соли олова(II) и прибавляют по каплям раствор NaOH. Вначале выпадает белый осадок Sn(OH)2, который при дальнейшем прибавлении NaOH растворяется. К полученному щелочному раствору прибавляют 1-2 капли раствора нитрата висмута(III). При перемешивании смеси выпадает черный осадок металлического висмута.
Реакция с хлоридом ртути(II). Олово(II) восстанавливает соединения ртути(II) до металлической ртути, выделяющейся, как и металлический висмут, в виде черного осадка. Реакция протекает в две стадии. Вначале ртуть(II) восстанавливается до ртути(II), а затем — до металлической ртути:
Методика. В пробирку вносят 3-5 капель солянокислого раствора хлорида олова(II) и прибавляют 2-3 капли раствора хлорида ртути(II) — сулемы HgCl2 Выпадает белый осадок каломели Hg2Cl2,который постепенно чернеет за счет выделяющейся металлической ртути.
Другие реакции олова(II). Соединения олова(II) при взаимодействии с молибдатом аммония образуют так называемую «молибденовую синь» (раствор окрашивается в синий цвет); с Na2HPO4 дают белый осадок Sn3(PO4)2 (растворяется в кислотах и щелочах); при реакции с FeCl3 восстанавливают железо(III) до железа(II), причем в присутствии гексацианоферрата(III) калия K3[Fe(CN)6] раствор сразу же окрашивается в синий цвет вследствие образования турнбулевой сини. Известны и другие реакции олова(II) с неорганическими и органическими реагентами.
Аналитические реакции олова(IV)
Олово(IV) обычно открывают, предварительно восстановив его металлическим железом, магнием, алюминием и т.д. до олова(II). Затем проводят реакции, характерные для олова(II), как описано в предыдущем разделе.
Реакция олова(IV) с щелочами. При медленном (по каплям) прибавлении раствора щелочи к раствору, содержащему олово(IV), вначале выпадает белый осадок Sn(OH)4, который называют а-оловянной кислотой — состав осадка можно также представить формулой H2SnO3 H2O. Свежеосажденный осадок растворяется в избытке раствора щелочи с образованием гидроксокомплексов олова(IV) состава [Sn(OH)6] 2- . Реакцию можно описать условной схемой:
Иногда (особенно — в «старых» руководствах) последнюю реакцию представляют также в виде
с образованием станнат-ионов SnO2 2- . Обе схемы эквивалентны, поскольку гидроксокомплексу соответствует также формула SnO2 2- 3H2O.
При стоянии раствора с осадком а-оловянной кислоты последняя постепенно «стареет» и превращается в р-оловянную кислоту H2SnO3, трудно растворимую в щелочах и в хлороводородной кислоте.
Методика. В пробирку вносят 3- 4 капли раствора соли олова(IV) и по каплям прибавляют раствор NaOH. Вначале выпадает белый осадок, который растворяется при добавлении избытка раствора щелочи.
Реакция с сульфид-ионами. Пропускание сероводорода H2S через кислые растворы, содержащие олово(IV), или прибавление к ним сероводородной воды приводят к выпадению желтого осадка сульфида олова(IV) SnS2:
Осадок сульфида олова(IV), в отличие от сульфида олова(II),растворяется в избытке сульфида аммония (NH4)2S или сульфида натрия Na2S с образованием тиосолей:
Поэтому при прибавлении растворов сульфидов аммония или натрия к кислым растворам солей олова(IV) осадок сульфида олова(IV) не выпадает.
Методика. В пробирку вносят 3-4 капли солянокислого раствора соли олова(IV) и прибавляют по каплям сероводородную воду. Выпадает желтый осадок сульфида олова(IV).
При добавлении к смеси раствора сульфида натрия или аммония осадок растворяется.
Реакция восстановления олова(IV) до олова(II). Для восстановления олова(IV) до олова(II) можно применять различные восстановители.
При восстановлении олова(IV) металлическим железом в солянокислой среде реакция протекает по схеме:
Олово(II), полученное после восстановления олова(IV), открывают реакциями с солями висмута(III), c хлоридом ртути(II) и др.
Методика. В пробирку вносят 8-10 капель раствора соли олова(IV), 2-3 капли концентрированной HCl, прибавляют немного железных опилок или железных стружек и нагревают смесь до кипения. Через 3-5 мин отфильтровывают оставшееся металлическое железо и в фильтрате открывают олово(ГГ), как описано выше в предыдущем разделе.
Другие реакции олова(IV). C рядом органических реагентов оло-во(IV) образует окрашенные или малорастворимые комплексы. Так, с купфероном C6H5N(NO)ONH4 в кислой среде олово(IV) дает малорастворимый осадок купфероната олова(IV), состав которого, по-видимому, отвечает формуле [Sn(C6H5N(NO)O)4].
С хлоридами рубидия и цезия олово(IV) образует малорастворимые комплексные соли состава Rb2[SnCl6] и Cs2[SnCl6]. Реакцию проводят как микрокристаллоскопическую.
Аналитические реакции мышьяка(III) и мышьяка(V)
Мышьяк(III) и мышьяк(V) обычно открывают в виде арсенит-ионов AsO3 2- (AsO2 — ) и арсенат-ионов AsO3 2- соответственно, т.е. в форме анионов, а не в форме катионов. Поэтому реакции этих анионов описаны далее в разделе, посвященном рассмотрению аналитических реакций анионов.
Аналитические реакции катиона хрома(III) Cr 3+
Реакции с щелочами и с аммиаком. Катионы Cr 3+ с растворами щелочей или аммиака образуют осадок гидроксида хрома(III) Cr(OH)3 серо-зеленого или сине-фиолетового цвета:
Осадок Cr(OH)3, обладающий амфотерными свойствами, растворяется как в щелочах, так и в кислотах:
В растворе аммиака гидроксид хрома(III) растворяется лишь частично с образованием фиолетового комплекса [Cr(NH3)6] 3+ :
Методика. В две пробирки вносят по нескольку капель соли хрома(III). В пробирки прибавляют по каплям: в первую — раствор NaOH, во вторую — раствор аммиака до выпадения серо-зеленого (или сине-фиолетового) осадка. При прибавлении в первую пробирку (по каплям) раствора NaOH и перемешивании осадок растворяется с образованием раствора зеленого цвета. Добавление (по каплям) во вторую пробирку раствора аммиака приводит лишь к частичному растворению осадка. Раствор над осадком становится фиолетовым.
Реакции окисления катионов хрома(III) до хромат-ионов и дихромат-ионов. Катионы Cr 3+ при взаимодействии с окислителями (пероксидом водорода, перманганатом калия и др.) окисляются до хромат-анионов CrO4 2 — или до дихромат-анионов Cr2O 7 2 — , окрашивающих раствор в желтый (окраска хромат-ионов) или желто-оранжевый (окраска дихромат-ионов) цвет.
а) Окисление пероксидом водорода. Окисление пероксидом водорода H2O2 проводят обычно в щелочной среде при нагревании:
Методика. В пробирку вносят 2-3 капли раствора соли хрома(III), прибавляют 4-5 капель 2 моль/л раствора NaOH, 2-3 капли 3 % раствора H2O2 и нагревают до изменения зеленой окраски раствора (цвет аквакомплексов [Cr(H2O)6] 3+ ) на желтую (цвет хромат-ионов CrO4 2- ). Раствор сохраняют для проведения реакции получения надхромовой кислоты (см. ниже).
б) Окисление персульфатом аммония. Катион Cr 3+ в кислой среде окисляется персульфат-ионом S2O3 2- до дихромат-иона Cr2O7 2- окрашивающего раствор в желто-оранжевый цвет:
Реакция ускоряется в присутствии следов солей серебра(I), действующих как катализатор.
Методика. В пробирку вносят последовательно 5-6 капель раствора персульфата аммония (NH4)2S2O8,1каплю1 моль/лраствора серной кислоты H2SO4, каплю раствора азотнокислого серебра AgNO3 и 2-3 капли раствора сульфата или нитрата хрома(III) (но не хлорида, так как хлорид-ионы также окисляются!). Раствор принимает желто-оранжевую окраску (цвет дихромат-ионов Cr2O 7 2 — ).
в) Окисление перманганатом калия. Перманганат калия KMnO4 в сернокислой среде при нагревании окисляет катион Cr 3+ до дихромат-иона, что можно описать схемой:
Раствор окрашивается в желто-оранжевый цвет. При прибавлении избытка раствора перманганата калия окисляется катион марганца(II) Mn 2+ и выделяется бурый осадок MnO(OH)2:
Увеличение кислотности среды препятствует образованию осадка MnO(OH )2.
Методика. В пробирку вносят 3-4 капли раствора сульфата или нитрата (но не хлорида!) хрома(III), 3-4 капли раствора серной кислоты, смесь нагревают и прибавляют к ней по каплям раствор KMnO4 до приобретения раствором желто-оранжевой окраски. При дальнейшем прибавлении раствора KMnO4 выпадает бурый осадок MnO(OH)2.
Реакция образования надхромовой кислоты. Окисление катионов Cr 3+ до хромат или дихромат-ионов подтверждают, помимо идентификации окраски раствора, реакцией образования надхромовой кислоты H 2 CrO 6.
При действии пероксида водорода H2O2 на раствор, содержащий хромат-ион (образовавшийся, например, при окислении катионов Cr 3+ пероксидом водорода, как описано выше), в сернокислой среде образуется надхромовая кислота H2CrO6 синего цвета:
i
В водных растворах надхромовая кислота неустойчива и разлагается до соединений хрома(III), окрашивающих раствор в зеленый цвет. Однако в растворах органических растворителей она сравнительно устойчива. Поэтому ее обычно экстрагируют из водного раствора органическим экстрагентом (диэтиловым эфиром, изоамиловым спиртом и др.), который окрашивается в интенсивно синий цвет.
Реакция специфична для соединений хрома и высокочувствительна: предел обнаружения — 2,5 мкг.
Методика. Желтый раствор, полученный при окислении хрома(III) пероксидом водорода (см. выше), нагревают до кипения, охлаждают под струей холодной воды, прибавляют 5 капель пероксида водорода,
0,5 мл смеси амилового спирта и диэтилового эфира, тщательно перемешивают и прибавляют по каплям раствор H2SO4 (1 моль/л). Верхний органический слой окрашивается в интенсивно синий цвет.
Другие реакции катионов хрома(III). Катион Cr 3+ с гидрофосфатом натрия Na2HPO4 образует осадок фосфата хрома CrPO4 зеленого цвета, растворимый в кислотах и щелочах; c арсенитами и арсенатами дает малорастворимые осадки арсенита CrAsO3 и арсената CrAsO4 соответственно.
Видео:Качественные реакции на катионы 1 аналитической группыСкачать

Анализ смеси катионов четвертой аналитической группы Al3+, Cr3+Zn2+As3+ As5+Sn2+Sn4+
Видео:Качественные реакции на катионы. 9 класс.Скачать

Ваш ответ
Видео:Аналитическая химия Первая группа катионовСкачать

решение вопроса
Видео:Качественные реакции на анионы. 9 класс.Скачать
Похожие вопросы
- Все категории
- экономические 43,407
- гуманитарные 33,633
- юридические 17,905
- школьный раздел 608,009
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
📸 Видео
Качественный анализ на анионыСкачать

Катионы 1 аналитической группыСкачать

Химия. 9 класс. Качественные реакции на катионы Fe2+, Fe3+, CU2+, взаимодействие со щелочамиСкачать

Катионы 6 аналитической группыСкачать

Качественные реакции на катионы II аналитической группы. Кузьмич Е.ССкачать
КАТИОНЫ И АНИОНЫСкачать

Катионы 3 аналитической группыСкачать

Качественный анализ на Катионов 2 аналитической группыСкачать

Микрокристаллоскопическая реакция (идентификация катионов калия).Скачать

Химия. 9 класс. Качественные реакции на катионы /07.10.2020/Скачать

Качественные реакции на анионыСкачать

Качественные реакции на катионы меди (Cu2+) и железа (Fe3+;Fe2+)Скачать

Обнаружение ионов в растворе. Качественные реакцииСкачать

Качественная реакция на катион натрияСкачать