Он хорошо растворим в воде, спирте и эфире.
Рис. 1. Строение молекулы этаналя.
Таблица 1. Физические свойства этаналя.
Плотность (0 o С), г/см 3
Температура плавления, o С
Температура кипения, o С
- Получение этаналя
- Химические свойства этаналя
- Применение этаналя
- Примеры решения задач
- Химические свойства бутанола и бутаналя
- а) Реакции бутаналя
- б) Реакции бутанола
- Превращения алллилового спирта
- Алани́н (2-аминопропановая кислота) — алифатическая аминокислота
- Напишите уравнения реакций взаимодействия этаналя с 1 и с 2 молями этанола
- 🔥 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Получение этаналя
Наиболее популярным способом получения этаналя является окисление этанола:
Кроме этого используются и другие реакции:
- пиролиз кальциевый (бариевых) солей карбоновых кислот:
- гидратация ацетилена и его гомологов (реакция Кучерова)
- каталитическое окисление ацетилена
Видео:Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Химические свойства этаналя
Типичные реакции, характерные для этаналя – реакции нуклеофильного присоединения. Все они протекают преимущественно с расщеплением:
- p-связи в карбонильной группе
— присоединение синильной кислоты
— присоединение гидросульфита натрия
- связи С-Н в карбонильной группе
— окисление аммиачным раствором оксида серебра (реакция «серебряного зеркала») – качественная реакция
— окисление гидроксидом меди (II)
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Применение этаналя
Этаналь используется в основном для производства уксусной кислоты и в качестве исходного сырья для синтеза многих органических соединений. Кроме этого этаналь и его производные идут на изготовление некоторых лекарств.
Видео:Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Примеры решения задач
| Задание | Эквимолекулярная смесь ацетилена и этаналя полностью реагирует с 69,6 г Ag2O, растворенного в аммиаке. Определите состав исходной смеси. |
| Решение | Запишем уравнения реакций, указанных в условии задачи: |
Рассчитаем количество вещества оксида серебра (I):
n(Ag2O) = 69,6 / 232 = 2,6 моль.
По уравнению (2) количество вещества этаналя будет равно 0,15 моль. По условию задачи смесь эквимолекулярна, следовательно, ацетилена тоже будет 0,15 моль.
Найдем массы веществ, составляющих смесь:
M(HC≡CH) = 26 г/моль;
m(HC≡CH) = 0,15× 26 = 3,9 г;
| Задание | При каталитическом гидрировании 55 г этаналя образовалась карбоновая кислота. Рассчитайте какая масса кислоты была получена. |
| Решение | Запишем уравнение реакции каталитического окисления этаналя: |
Вычислим количество вещества этаналя (молярная масса равна 44 г/моль):
n(CH3-C(O)H) = 55 / 44 = 1,25 моль.
Согласно уравнению реакции n(CH3-C(O)H) : n(CH3-COOH) = 1:1, т.е.
Тогда масса уксусной кислоты будет равна (молярная масса – 60 г/моль):
6. Взаимодействие этанола с натрием является
А эндотермических реакцией В реакцией присоединения
Б реакцией замещения Г оборотной реакцией
7. Глицерол есть
А ненасыщенным трехатомных спиртом
Б насыщенным одноатомного спиртом
В одним из продуктов гидролиза тристеарин
Г одним из продуктов гидролиза метилетаноату
8. Глицерол отличается от этанола тем, что
А реагирует с натрием В вступает в реакцию полного окисления
Б реагирует с меди (II) гидроксидом Г вступает в реакции этерификации
9. Фенол отличается от метанола тем, что
А легко окисляется на воздухе В не имеет характерного запаха Б не реагирует с щелочными металлами Г является сильной кислотой
10. Метановая кислота отличается от етановои тем, что
А вступает в реакцию «серебряного зеркала»
Б не реагирует с магнием
В не имеет характерного запаха
Г образует белый осадок под действием бромной воды
11. Зпомиж веществ, формулы которых приведены, укажите ту, в которой кислотные свойства выражены сильнее.
А СН3СООН Б НСООН В С6Н5ОН Г Н2СО3
12. Зпомиж веществ, формулы которых приведены, укажите ту, в которой кислотные свойства
выражены слабое.
А СН3СООН Б НСООН В С6Н5ОН Г Н2СО3
13. Метилетаноат изомерный
А пропаналя В пропан1,2диолу
Б пропан2олу Г пропан кислоте
14. Проанализируйте утверждение.
И. Одним из продуктов щелочного гидролиза тристеарин есть мыло.
ИИ. Одним из продуктов щелочного гидролиза тристеарин является глицерин. Определите, есть ли между ними правильные.
А верно лишь И В оба правильные Б верно лишь ИИ Г нет правильных
15. Конечным продуктом гидролиза крахмала является
А фруктоза Б глюкоза В декстрин Г сахароза
16. Проанализируйте утверждение.
И. Жиры по своей природе эфирами.
ИИ. Одним из продуктов гидролиза любого эфира является глицерин. Определите, есть ли между ними правильные.
А верно лишь И Б верно лишь ИИ В оба правильные Г нет правильных
17. Проанализируйте утверждение.
И. Одним из продуктов щелочного гидролиза тристеарин есть маргарин.
ИИ. Одним из продуктов щелочного гидролиза тристеарин является стеариновая кислота. Определите, есть ли между ними правильные.
А верно лишь И Б верно лишь ИИ В оба правильные Г нет правильных
18. Проанализируйте утверждение.
И. Сок спелого яблока от сока незрелого можно отличить, используя аммоний ачний раствор аргентум (И) оксида.
ИИ. Сок спелого яблока от сока незрелого можно отличить, используя водно спиртовой раствор йода.
Определите, есть ли между ними правильные.
А верно лишь И В оба правильные
Б верно лишь ИИ Г нет правильных
19. Молекулярная формула насыщенного одноатомного спирта — это
А С3Н8О2 Б С5Н12 В С2Н4О2 Г С3Н4О
20. Укажите вещество, в молекуле которого нет карбонильной группы.
А метановая кислота Б формальдегид В етанова кислота Г этаналь
21. Укажите вещество, которое восстанавливает серебро аммиачные раствора аргентум (И) оксида.
А сахароза Б этанол В крахмал Г этаналь
22. Сколько из среды приведенных веществ — метановая кислота, водород, магний, меди (II)
гидроксид — реагирует с этаналя?
А1Б2В3Г4
23. Водородные связи не образуются между молекулами
А воды Б этанола В глицерина Г этаналя
24. моносахаридов является
А глюкоза Б сахароза В крахмал Г целлюлоза
25. Для скольких веществ из среды приведенных — крахмал, сахароза, глюкоза, целлюлоза — возможная реакция гидролиза?
А1Б2В3Г4
26. Для скольких веществ из среды приведенных — триолеин, тристеарин, етилетаноат, фи
нол — возможная реакция гидролиза?
А1Б2В3Г4
27. Для скольких веществ из среды приведенных — этаналь, триолеин, тристеарин, пропа
наль — возможная реакция гидрирования?
А1Б2В3Г4
28. Для скольких веществ из среды приведенных — фенол, триолеин, тристеарин, этанол —
возможна реакция со щелочью?
А1Б2В3Г4
29. Для скольких веществ из среды приведенных — фенол, триолеин, тристеарин, сахароза — возможна реакция с бромной водой?
А1 Б2 В3 Г4
30. Сколько веществ из среды приведенных — фенол, крахмал, глицерин, целлюлоза — под
действием водноспиртового раствора йода приобретают синего цвета? А1 Б2 В3 Г4
Как из этанола получить этаналь?! (напишите наблюдение и реакцию)
- Попроси больше объяснений
- Следить
- Отметить нарушение
Видео:Количество вещества. Моль. Число Авогадро. 8 класс.Скачать

Химические свойства бутанола и бутаналя
Задача 59.
Напишите реакции (где это возможно) для каждого из двух соединений — бутаналя и бутанола со следующими реагентами: хромовая смесь, реактив Фелинга, спиртом, реактивом Гриньяра.
Решение:
а) Реакции бутаналя
1. Альдегиды легко окисляются до соответствующих карбоновых кислот под действием разнообразных окислителей. Поэтому бутаналь легко окислится хромовой смесью до бутановой кислоты:
2. Реактив Фелинга — это раствор сульфата меди CuSО4 и тартрата калия-натрия KNa(C4H406) в 10%-м водном растворе гидроксида натрия NaOH. При действии реактивом Фелинга на пропаналь образуется бутановая кислота и выпадет красный осадок Cu2O — реакция «медного зеркала»:
3. При присоединении первой молекулы спирта образуются полуацетали. Реакция катализируется кислотами или основаниями:
Присоединение второй молекулы спирта приводит к образованию ацеталей. Образование ацеталей катализируется только в кислой среде:
Ацетали устойчивы в нейтральной и щелочной среде, поэтому могут быть использованы для временной защиты альдегидных групп. Ацетали широко распространены в природе.
Эта реакция «медного зеркала» служит качественной реакцией на обнаружение альдегидов, при наличии альдегида в растворе выпадает красный осадок.
4. Реактив Гриньяра (R-Mg-Х, здесь R – алкильный или арильный радикал; Х – это галоген.) получается при реакции металлического магния с соответствующими органическими галогенидами. Одно из наиболее важных использований реактивов Гриньяра — реакция с альдегидами и кетонами, приводящая к спиртам. Из пропаналя и метилмагнийбромида получаются вторичные спирт пентанол-2:
б) Реакции бутанола
1. Первичные спирты
Дихромат — сильный оксилитель и окислит спирт в соответствующий альдегид, т. е при окислении таким образом батанола образуется бутаналь:
Первичные и вторичные спирты легко окисляются хромовым ангидридом или бихроматом в водном растворе серной кислоты.
При проведении реакции в кислой среде образуется зеленый осадок Cr2(SO4)3, что может служить реакцией обнаружения спирта:
Образовавшийся при окислении спирта альдегид окисляется до карбоновой кислоты. Общая схема реакции окисления спирта:
2. Реактив Фелинга не вступает в реакцию с первичными спиртами
3. Спирты могут вступать в реакцию межмолекулярной дегидратации, так при при нагревании пропанола с этанолом в присутствии серной кислоты образуется этилбутират:
Этот способ неприемлем для получение несимметричных эфиров из двух спиртов, так как при этом образуется смесь трех возможных продуктов ROR, R’OR, R’OR’, в данном случае —
4. Реактивы Гриньяра с высокой скоростью и необратимо реагируют со всеми группами (OH-), что находит применение для количественного определения подвижного водорода в органических соединениях по объему выделившегося метана (метод Чугаева–Церевитинова):
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Превращения алллилового спирта
Задача 60.
Осуществить следующие превращения и назвать соединения:
аллиловый спирт + Cl2 → A + 2NaOH(водный) → B + CH3-COOH(H + , t°) → C + 2CH3COOH(H + , t°) → Д
Решение:
1. Аллиловый спирт при реакции с хлором образует дихлорпропиловый спирт:
2. При омылении дихлорпропилового спирта получают глицерин:
3. Реакция глицерина с кислотами
При действии на глицерин разбавленным раствором уксусной кислотой в присутствии серной кислоты и при нагревании образуется моноацетат глицерина:
4. При реакции моноацетата глицерина с уксусной кислотой образуется триацетат глицерина:
А — 2,3-дихлорпропанол-1 — CH2Cl-CHCl-CH2OH;
B — 1,2,3-пропантриол (глицерин) — CH2OH-CHOH-CH2OH;
C — (2,3-дигидроксипропил)ацетат — CH2OH-CHOH-CH2O-CO-CH3;
D — (пропан-1,2,3-триил)триацетат (триацетин) — CH2(OCOCH3)-CH(OCOCH3)-CH2O-COCH3.
Алани́н (2-аминопропановая кислота) — алифатическая аминокислота
Задача 61.
К 80 г раствора аланина добавили 5,04г гидрокарбоната натрия, при этом выделилось 896 мл (н.у.) газа. Определите массовые доли веществ в образовавшемся растворе.
Решение:
m(p-pa) = 80 г;
V(CO2) = 896 мл = 0,896 л;
m(Na2CO3) = 5,04 г;
М(NС3H6О2Na) = 101,09 г/моль;
М(Na2CO3) = 105,9888 г/моль.
Уравнение реакции имеет вид:
Из уравнения реакций вытекает, что при взаимодействии 1 моль Na2CO3 и 2 моль аланина выделяется 1 моль СО2 и 2моль соли, т.е. n(CO2) = n(Na2CO3) = 2n(NС3H6О2Na).
1. Рассчитаем количества веществ, получим:
2. Рассчитаем массу соли, получим:
3. Рассчитаем массу оставшейся соли Na2CO3, получим:
4. Определение массовых долей веществ в образовавшемся растворе, получим:
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Напишите уравнения реакций взаимодействия этаналя с 1 и с 2 молями этанола
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
Какие вещества называют многоатомными спиртами?
Многоатомными спиртами называются органические вещества, молекулы которых содержат две или более гидроксильные группы.
Напишите по две формулы и названия простейших представителей для двухатомных и трёхатомных спиртов.
Двухатомные спирты:
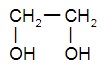 | 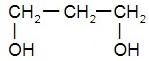 |
Трёхатомные спирты:
| глицерол, или пропантриол-1,2,3 | |
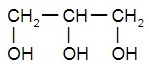 |  |
Задание 2
Какие свойства глицерина лежат в основе его применения? Гигроскопичность, сладкий вкус.
Гигроскопичность глицерина используют при изготовлении кремов для обуви; в кожевенном производстве и текстильной промышленности ― как смягчение кожи и придания эластичности тканям и пряжи; в парфюмерии и фармации ― как смягчающее средство или основу мазей, добавок к мылу, зубной пасте ( чтобы предотвратить их высыхание ) . В пищевой промышленности глицерол используют как добавку к газированным напиткам и в кондитерских изделиях .
Задание 4
Какой объём водорода (н.у.) выделится при взаимодействии 1,38 г натрия с избытком этиленгликоля?
Дано: m(Na)=1,38 г
Найти: V(H2)—?
Решение
1. Количество вещества натрия массой 1,36 г рассчитываем по формуле: n=m/M, где M ― молярная масса.
M(Na)=23 г/моль
n(Na)=m(Na)/M(Na)=1,36 г : 23 г/моль=0,06 моль
2. Составим химическое уравнение:
C2H4(OH)2 + 2Na ⟶ C2H4(ONa)2 + H2↑
По уравнению реакции n(Na):n(H2)=2:1, количество вещества водорода в 2 раза меньше количества вещества натрия, поэтому
n( H2 )=n( C2H5OH ):2=0,06 моль:2=0,03 моль
3. Вычисляем объём водорода в количестве вещества 0,03 моль по формуле: V= n • VM, где VM ― молярный объём .
n( H2 )=n( H2 ) • VM=0,03 моль • 22,4 л/моль=0,672 л, или 672 мл.
Ответ: 672 мл
Задание 5
В двух пробирках находятся растворы этилового спирта и глицерина. Как их различить?
Качественной реакцией на глицерин (многоатомный спирт) является реакция взаимодействия со свежеполученным гидроксидом меди (II), в результате которой в пробирке с раствором глицерина осадок гидроксида меди (II) растворится и раствор окрасится в ярко-синий цвет. В пробирке с этиловым спиртом (одноатомный спирт) никаких изменений не произойдет.
Задание 6
К наступлению холодов в клеточной жидкости насекомых и некоторых земноводных резко увеличивается содержание глицерина. Объясните этот природный факт. Глицерин в клеточной жидкости выполняет роль природного антифриза, так как водный раствор глицерина замерзает (кристаллизируется) при гораздо более низкой температуре, чем вода (0°C) и предотвращает таким образом к наступлению холодов гибель этих насекомых.
Задание 8
Температура кристаллизации этиленгликоля ―13°C, температура кристаллизации воды 0°C. Попробуйте спрогнозировать температуру кристаллизации 50%-ного водного раствора этиленгликоля.
Можно было бы предположить, что температура кристаллизации 50%-ного водного раствора этиленгликоля равна среднему арифметическому значению температур: (―13°C + 0°C):2=―6,5°C.
Сравните ваш прогноз с истинным значением, найденным в Интернете.
Истинное значение температуры кристаллизации ―36°C.
Проанализируйте результат, сделайте выводы.
Смесь этиленгликоля и воды кристаллизуется при гораздо более низкой температуре, чем каждое из чистых веществ. Температура замерзания зависит от концентрации компонентов смеси.
🔥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Химия ЕГЭ 2022 / Задание 32Скачать

Молярная масса. 8 класс.Скачать

Расчетный интенсив. Все 27 и 28 задачи ЕГЭ по химии за 1 урок | Екатерина СтрогановаСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Все задания №32 из сборника ЕГЭ 2023 (часть 2) | Химия ЕГЭ для 10 класса | УмскулСкачать

Химия. 8 класс. Решение задач по уравнениям химических реакций /25.11.2020/Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Химия ПростоСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Химия ЕГЭ 2022 / Полный разбор варианта / Вариант 5Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 2 ч. 9 класс.Скачать

ЕГЭ химия ДЕМО 2022 ФИПИСкачать


