Видео:8 класс. Составление уравнений химических реакций.Скачать

Ваш ответ
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

решение вопроса
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,407
- гуманитарные 33,633
- юридические 17,905
- школьный раздел 608,009
- разное 16,855
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Please wait.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

We are checking your browser. gomolog.ru
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
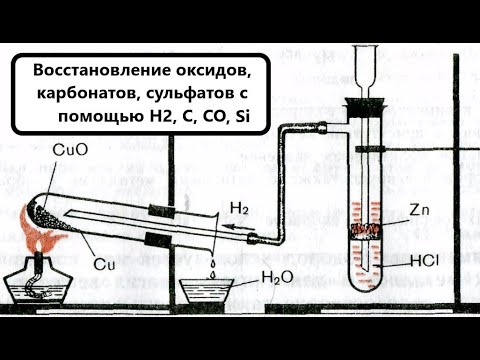
Видео:Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 7006a90ab931fa4c • Your IP : 178.45.155.83 • Performance & security by Cloudflare
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Восстановление оксидов железа монооксидом углерода
Реакции восстановления оксидов железа:
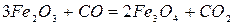
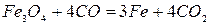
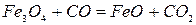
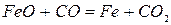
Реакция 1. Окись железа соединение непрочное (см. упругость диссоциации). Реакция идет слева направо при любом содержании в газовой фазе СО и СО2 до полного израсходования одного из реагентов (возможна даже термическая диссоциация).
Реакции 2 и 3. Окисел Fe3O4 более прочный. Для его восстановления необходим избыток окиси углерода в газовой фазе. В противном случае углекислота окисляет FeO до Fe3O4. Для протекания реакций отношение СО2:СО не должно быть больше определенных значений.
Реакция 4. FeO является самым прочным оксидом железа. Для протекания прямой реакции необходим еще больший избыток СО и меньшее отношение СО2:СО в газовой фазе.
Отсюда следует, что для каждого окисла при данной температуре существует такое соотношение восстановителя и его окисла (СО и СО2) в газовой фазе, при котором газовая фаза является нейтральной по отношению к окислу железа и продукту его восстановления, а восстановительно-окислительная реакция находится в подвижном равновесии.
Так как объем газообразных продуктов реакции равен объему газа, вступающему в реакцию, состав равновесной газовой фазы не зависит от давления и меняется только с изменением температуры. Равновесные соотношения СО2:СО в газовой фазе установлены расчетами в соответствии с законами химической термодинамики и подтверждены экспериментально.
Равновесные составы газовой фазы с окислами железа и железом при разных температурах могут быть представлены следующей диаграммой (рис. 2.1‑3).
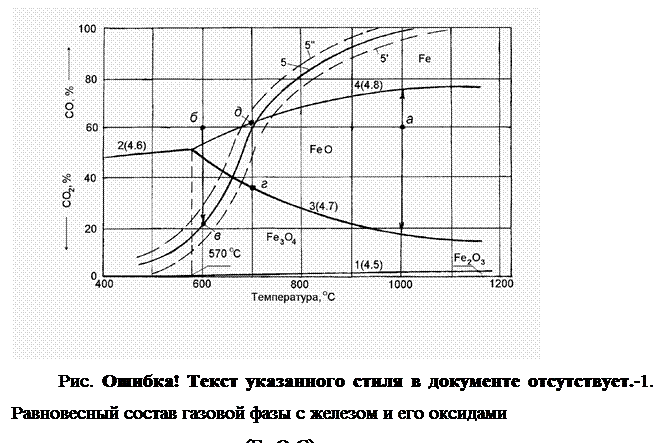
Равновесный состав газовой фазы реакции (1), необратимо протекающей при незначительном содержании СО, практически соответствует при любой температуре 100% СО2 в газовой фазе. Поэтому линия равновесия этой реакции как бы совпадает с осью абсцисс.
Равновесный состав газовой фазы реакции (2) с изменением температуры меняется по кривой 2. Равновесные составы газовой фазы реакций (3) и (4) изменяются соответственно по кривым 3 и 4. Причем кривая 3 нисходящая, а кривая 4 — восходящая. Это объясняется эндотермичностью реакции (3) (реакция протекает с затратами тепла, тепловой эффект реакции “-“) и экзотермичность реакции (4) (реакция протекает с выделением тепла, тепловой эффект реакции “+“). Повышение температуры в соответствии с принципом Ле Шателье смещает равновесие эндотермической реакции в сторону поглощения тепла, вызывает увеличение содержания СО2 и снижение содержания СО в газовой фазе (кривая 3 — нисходящая). Равновесие экзотермической реакции с повышением температуры сдвигается, наоборот, в сторону выделения тепла, увеличения содержания СО и уменьшения содержания СО2 в равновесной газовой фазе (кривая 4 -восходящая).
Таким образом, каждая точка на кривой характеризует равновесие одной из реакций восстановления.
Равновесные кривые делят диаграмму на три области устойчивых состояний: Fe3O4, FeO и Fe. При температурах ниже 570 О С область FeO исчезает, происходит восстановление Fe непосредственно из Fe3O4.
Любая точка вне кривых 2-4 характеризует нейтральный состав газовой смеси при данной температуре по отношению к тому веществу (окислу или железу), которое устойчиво в области расположения точки. Оно не будет ни восстанавливаться, ни окисляться.
Для других веществ состав газа неравновесный, поэтому реакции пойдут в направлении образования того вещества, которое определяет название данной области.
Например, если в газ, содержащий 40% СО2 и 60% СО, при температуре 900 О С поместить Fe, FeO и Fe3O4, то без изменения останется только FeO. Fe3O4 будет восстанавливаться до FeO, а Fe — окисляться до FeO, до тех пор пока не закончатся реагенты или состав газовой фазы не станет равновесным для данной реакции.
Анализ кривых равновесия реакций позволяет сделать следующие выводы:
— Для восстановления гематита достаточно невысокое содержание газа восстановителя;
— Восстановление FeO возможно лишь при высокой концентрации CO в газовой фазе. Причем с повышением температуры величина необходимого избытка восстановителя увеличивается;
— Газ, который не может быть использован для восстановления FeO, используется для восстановления Fe3O4 до FeO.
Восстановительные процессы в доменной печи не достигают рассмотренных равновесных состояний. Это обусловлено:
1. непродолжительным временем пребывания газа в печи
2. протеканием реакции взаимодействия углерода кокса и диоксида углерода кокса.
Реакция распада монооксида углерода газификации углерода кокса, получившая название «реакция Белла – Будуара» в честь ее исследователей, описывается уравнением:
5) 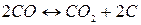
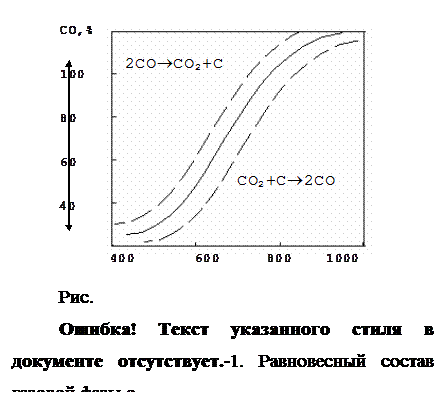
Кривая разделяет поле диаграммы на 2 области. В левой области реакция идет в сторону образования СО2 и сажистого С, в правой – в сторону образования СО. Реакция протекает с изменением объема газовой фазы. Поэтому с повышением давления равновесие реакции сдвигается в сторону увеличения содержания в газе углекислоты. Кривая смещается вправо, вниз.
Прямая реакция – реакция распада углерода протекает при низких температурах. Скорость реакция незначительна и для достижения равновесия необходимо длительное время. Реакция практически не оказывает влияния на состав газовой фазы и восстановительные процессы, протекающие в области низких температур.
Обратная реакция – реакция газификации углерода протекает при высоких температурах, отличается высокой скоростью и быстрым достижением равновесия. С ростом температур скорость этой реакции возрастает. Интенсивное развитие реакция получает при температурах 1000¼1100 О С. Реакция оказывает значительное влияние на состав газовой фазы и восстановительные процессы, протекающие в нижней части шахты печи при высоких температурах.
Совмещение диаграмм, описывающих термодинамические условия равновесия в системах Fе–О–С и С–СО–СО2 позволяет сделать следующие выводы:
— Состав газа левой области препятствует течению восстановительного процесса, состав правой области — способствует.
— Из-за низких скоростей протекания реакции в левой области диаграммы, она не оказывает значительного влияния на восстановительный процесс. Все количество двуокиси углерода, которое образуется в результате рассмотренных реакций, при умеренных температурах (до 700…1000 О С) ни с чем не взаимодействует и уносится газами из печи.
— Реакция оказывает существенное влияние на восстановительный процесс в правой области диаграммы. При температурах 900-1200 О С весь, образующийся в результате восстановления железа, углекислый газ полностью расходуется по этой реакции.
В низкотемпературной зоне за время опускания материала восстановление Fe2O3, Fe3O4 и части FeO успевает завершиться. В высокотемпературной зоне в нормально работающей печи восстанавливается лишь часть FeO.
На основании сказанного можно просуммировать реакции 4 и 5, то есть реакции, протекающие в области высоких температур.
Результирующая реакция имеет вид:

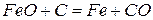
🎦 Видео
Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ЖЕЛЕЗО и его соединения для ЕГЭ ПОЛНОСТЬЮ | Самые завальные реакции | ЕГЭ по химии 2023Скачать

Окислительно-восстановительные реакции в неорганической химии 9-11 класс.Скачать

Соединения железаСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Железо | ХимияСкачать

Типы химических реакций. 1 часть. 8 класс.Скачать

Процесс получения Fe2O3. Оксид железа |||.Скачать

ВСЕ РЕАКЦИИ С ХРОМОМ И ЕГО СОЕДИНЕНИЯМИ| ЕГЭ ХИМИЯ 2024 | НООСкачать
