Химия | 5 — 9 классы
Напишите уравнение реакций восстановления углем меди из оксида меди ( 1 ) и из оксида меди ( 2 ).
Обозначьте степени окисления элементов и укажите окислитель и восстановитель.
1)2Cu2O + C = 4Cu + CO2
Cu2O — окислитель, С — восстановитель.
Сu( + 1), O( — 2), C(0), Cu(0), C( + 4), O( — 2)
2)2CuO + C = 2Cu + CO2
CuO — окислитель, С — восстановитель.
Сu( + 2), O( — 2), C(0), Cu(0), C( + 4), O( — 2).
- Составьте уравнение реакции восстановления меди из ее оксида монооксидом углерода?
- Напишите уравнение реакций восстановления углём меди : а) из оксида меди(I) б) из оксида меди (II)?
- Составте уравнение реакций взаимодействия меди с кислородом ; железа с хлоромю Обозначте степени окисления атомов, укажите переход электронов, а также окислитель и восстановитель?
- Напишите уравнения реакций восстановления углём меди из оксида меди(1) и из оксида меди(2)?
- При восстановлении меди(II) оксидом водорода образуется 0, 25 моля меди?
- Хлор реагирует с железом с образованием хлорида железа (III) а с медью — с образованием хлорида меди(II) Напишите уравнения реакций, укажите окислитель и восстановитель?
- Реакция восстановления оксидом углерода (II) меди из оксида меди (II) ?
- При пропускании аммиака через трубку с накалённым оксидом меди(II) образуется медь?
- Напишите уравнение реакции восстановления меди из оксида : а) углем, б) оксидом углерода(2)?
- Напишите уравнения реакций, позволяющих осуществить превращения ( укажите типы реакций) : медь — хлорид меди (II) — гидроксид меди (II) — сульфат меди (II) — медь — оксид меди (II) — нитрат меди (II)?
- Оксид меди (II)
- Оксид меди (II)
- Способы получения оксида меди (II)
- Химические свойства оксида меди (II)
- ГДЗ химия 11 класс Радецкий, дидактический материал, тема 5, раб 1, вариант 2, 1 задание. Напишите уравнения реакций
- 💥 Видео
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Составьте уравнение реакции восстановления меди из ее оксида монооксидом углерода?
Составьте уравнение реакции восстановления меди из ее оксида монооксидом углерода.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Напишите уравнение реакций восстановления углём меди : а) из оксида меди(I) б) из оксида меди (II)?
Напишите уравнение реакций восстановления углём меди : а) из оксида меди(I) б) из оксида меди (II).
Обозначте степени окисления атомов, укажите переход электронов, а также окислитель и восстановитель.
Видео:ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

Составте уравнение реакций взаимодействия меди с кислородом ; железа с хлоромю Обозначте степени окисления атомов, укажите переход электронов, а также окислитель и восстановитель?
Составте уравнение реакций взаимодействия меди с кислородом ; железа с хлоромю Обозначте степени окисления атомов, укажите переход электронов, а также окислитель и восстановитель.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Напишите уравнения реакций восстановления углём меди из оксида меди(1) и из оксида меди(2)?
Напишите уравнения реакций восстановления углём меди из оксида меди(1) и из оксида меди(2).
Обозначьте степени окисления элементов и укажите окислитель и восстановитель.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

При восстановлении меди(II) оксидом водорода образуется 0, 25 моля меди?
При восстановлении меди(II) оксидом водорода образуется 0, 25 моля меди.
Запишите уравнение этой реакции, вставьте коэффициенты, определите вещества, являющиеся окислителями и восстановителями.
) водорода участвовал в реакции.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Хлор реагирует с железом с образованием хлорида железа (III) а с медью — с образованием хлорида меди(II) Напишите уравнения реакций, укажите окислитель и восстановитель?
Хлор реагирует с железом с образованием хлорида железа (III) а с медью — с образованием хлорида меди(II) Напишите уравнения реакций, укажите окислитель и восстановитель.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Реакция восстановления оксидом углерода (II) меди из оксида меди (II) ?
Реакция восстановления оксидом углерода (II) меди из оксида меди (II) ;
Видео:Восстановление металлов из оксидов водородом, углеродом, угарным газом, кремнием. BaSO4 + H2 / + CСкачать
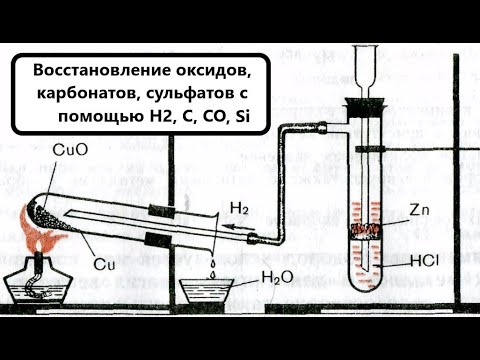
При пропускании аммиака через трубку с накалённым оксидом меди(II) образуется медь?
При пропускании аммиака через трубку с накалённым оксидом меди(II) образуется медь.
Напищите ур — ие этой реакции , укажите окислитель и восстановитель.
Покажите переход электронов.
Видео:Химия. 9 класс (Урок№17 - Углерод. Аллотропные модификации углерода.Химические свойства. Адсорбция.)Скачать

Напишите уравнение реакции восстановления меди из оксида : а) углем, б) оксидом углерода(2)?
Напишите уравнение реакции восстановления меди из оксида : а) углем, б) оксидом углерода(2).
Видео:Окислительно-восстановительные реакции в ЕГЭ по химииСкачать

Напишите уравнения реакций, позволяющих осуществить превращения ( укажите типы реакций) : медь — хлорид меди (II) — гидроксид меди (II) — сульфат меди (II) — медь — оксид меди (II) — нитрат меди (II)?
Напишите уравнения реакций, позволяющих осуществить превращения ( укажите типы реакций) : медь — хлорид меди (II) — гидроксид меди (II) — сульфат меди (II) — медь — оксид меди (II) — нитрат меди (II).
На этой странице находится вопрос Напишите уравнение реакций восстановления углем меди из оксида меди ( 1 ) и из оксида меди ( 2 )?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 5 — 9 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку.
Могу лишь написать их образование и среду, может чем — то поможет : 1. BaSO4 образован сильным основанием Ва(ОН)2 и сильной кислотой H2SO4, среда нейтральная, гидролизу не подвергается. 2. MgCO3 образован слабым основанием Mg(OH)2 и слабой кислотой..
Реакция электролиза хлорида калия : 2KCl = 2K + Cl2⬆️ Масса примесей : m(прим. ) = 150г * 0, 1 = 15 г Масса чистого хлорида калия : m (KCl) = 150г — 15г = 135г Масса калия : m(K) = (40 г / моль * 2 * 135г) : (75, 5 г / моль * 2) = 68, 79г.
Мед — ? 25×100 = 2500 2500÷6. 25 = 400 руд.
У них у всех не металлическое а все остальное есть в табл. Менделеева.
Ответ : Li, K, C, N, P, S, Cl.
CH₄ + Cl₂ → CH₃Cl + HCl 2CH₃Cl + 2Na → CH₃ — CH₃ + 2NaCl CH₃ — CH₃ + Br₂ → CH₃ — CH₂Br + HBr 2CH₃ — CH₂Br + 2Na → CH₃ — CH₂ — CH₂ — CH₃ + 2NaBr.
Схема реакции : CxHy — — — > xCO2 + y / 2 H2O n (CO2) = 132 / 44 = 3 моль CxHy — 1 моль CO2 — 3 моль x = 3 1 дм3 — 1, 961 г. N (CxHy) = 1дм3 / 22, 4 дм3 / моль = 0, 0446 моль M (CxHy) = 1, 961 г / 0, 0446 моль = 44 г / моль С3Hy = 12 * 3 + y = 44 г ..
А) кристаллизация ; б) конденсация ; в) испарение ; г) конденсация.
NaOH + NaCl = ничего не даст. NaOH + HCl = NaCl + H2O ( прозрачный раствор) NaOH + фенолфталеин = за счет содержания в растворе анионовOH⁻ фенолфталеин окрасит щелочь в малиновый цвет, так как среда раствора щелочная. NaCl + HCl = Эта реакция не ид..
Порядковий номер елемента збігається з кількістю електронів, які містяться в його атомі. За періодичній таблиці шукаємо пелемент з порядковим номером 26. Це — Ферум.
Видео:ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Оксид меди (II)
Оксид меди (II)
Оксид меди (II) CuO – твердое кристаллическое вещество черного цвета.
Способы получения оксида меди (II)
Оксид меди (II) можно получить различными методами :
1. Термическим разложением гидроксида меди (II) при 200°С :
2. В лаборатории оксид меди (II) получают окислением меди при нагревании на воздухе при 400–500°С:
2Cu + O2 → 2CuO
3. В лаборатории оксид меди (II) также получают прокаливанием солей (CuOH)2CO3, Cu(NO3)2:
Химические свойства оксида меди (II)
Оксид меди (II) – основный оксид (при этом у него есть слабо выраженные амфотерные свойства) . При этом он является довольно сильным окислителем.
1. При взаимодействии оксида меди (II) с сильными и растворимыми кислотами образуются соли.
Например , оксид меди (II) взаимодействует с соляной кислотой:
СuO + 2HBr = CuBr2 + H2O
CuO + 2HCl = CuCl2 + H2O
2. Оксид меди (II) вступает в реакцию с кислотными оксидами.
Например , оксид меди (II) взаимодействует с оксидом серы (VI) с образованием сульфата меди (II):
3. Оксид меди (II) не взаимодействует с водой.
4. В окислительно-восстановительных реакциях соединения меди (II) проявляют окислительные свойства:
Например , оксид меди (II) окисляет аммиак :
3CuO + 2NH3 → 3Cu + N2 + 3H2O
Оксид меди (II) можно восстановить углеродом, водородом или угарным газом при нагревании:
СuO + C → Cu + CO
Более активные металлы вытесняют медь из оксида.
Например , алюминий восстанавливает оксид меди (II):
3CuO + 2Al = 3Cu + Al2O3
Видео:Составление уравнений окислительно-восстановительных реакций методом электронного балансаСкачать

ГДЗ химия 11 класс Радецкий, дидактический материал, тема 5, раб 1, вариант 2, 1 задание. Напишите уравнения реакций
Напишите уравнения реакций: а) получения железа из оксида железа(Ш) алюминотермическим способом; б) получения меди из оксида меди(II) путём восстановления углём; в) получения вольфрама из его высшего оксида путём восстановления водородом. Реакцию в разберите как окислительновосстановительную: обозначьте степени окисления атомов и расставьте коэффициенты, определив их методом электронного баланса.
💥 Видео
9 класс. Оксиды углерода.Скачать

Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Все качественные реакции органических соединений за 45 минут | Химия 10 класс | УмскулСкачать

8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

ВСЯ ХИМИЯ ЭЛЕМЕНТОВ С НУЛЯ | Химия ЕГЭ 2023 | УмскулСкачать

Химия 9 класс — Как определять Степень Окисления?Скачать

ВАЛЕНТНОСТЬ. Графические формулы веществ | Химия | TutorOnlineСкачать










