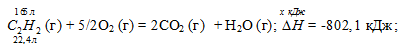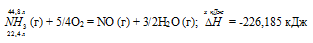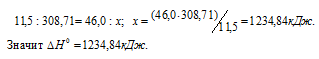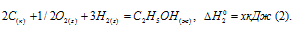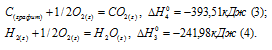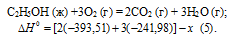- Теплота образования веществ
- Теплота образования
- Тепловой эффект реакции
- Термохимическое уравнение реакции
- Напишите термохимические уравнения реакций, тепловой эффект которых является теплотой образования всех реагентов заданной химической реакции.
- Рbv28231 Методика решения задач по физической химии (1) (стр. 3 )
- 📺 Видео
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Теплота образования веществ
Задание 88.
Тепловой эффект какой реакции равен теплоте образования метана? Вычислите теплоту образования метана, исходя из следующих термохимических уравнений:
а) Н2 (г) + 1/2О2 (г) = Н2О (ж); 
б) С (к) + О2 (г) = СО2 (г); 
в) СН4 (г) + 2О2 (г) = 2Н2О (ж) + СО2 (г); 
Ответ: -74,88 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование метана из водорода и углерода можно представить так:
С (графит) + 2Н2 (г) = СН4 (г); 
Исходя из данных уравнений по условию задачи, учитывая, что водород сгорает до воды, углерод — до углекислого газа, метан – до углекислого газа и воды и, на основании закона Гесса, с термохимическими уравнениями можно оперировать также как и с алгебраическими. Для получения искомого результата нужно уравнение горения водорода (а) умножить на 2, а затем, сумму уравнений горения водорода (а) и углерода (б) вычесть из уравнения горения метана (в):
СН4 (г) + 2О2 (г) — 2 Н2 (г) + О2 (г) — С (к) + О2 (г) =
= 2Н2О (ж) + СО2 — 2Н2О — СО2;

СН4 (г) = С (к) + 2Н2 (к); 
Так как теплота образования равна теплоте разложения с обратным знаком, то

Ответ: -74,88 кДж.
Задание 89.
Тепловой эффект какой реакции равен теплоте образования гидроксида кальция? Вычислите теплоту образования гидроксида кальция, исходя из следующих термохимических уравнений:
Са (к) + 1/2О (г) = СаО (к); 
Н2 (г) + 1/2О2 (г) = Н2О (ж); 
СаО (к) + Н2О (ж) = Са(ОН)2 (к); 
Ответ: —986,50 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование гидроксида кальция из простых веществ можно представить так:
Са (к) + О2 (г) + Н2 (г) = Са(ОН)2 (к); 
Исходя из уравнений, которые даны по условию задачи и, учитывая, что водород сгорает до воды, а кальций, реагируя с кислородом, образует СаО, то на основании закона Гесса с термохимическими уравнениями можно оперировать также как с алгебраическими. Для получения искомого результата нужно все три уравнения сложить между собой:
СаО (к) + Н2О (ж) + Са (к) + 1/2О (г) + Н2 (г) + 1/2О2 (г = (ОН)2 (к) + СаО (к) + Н2О (ж); 
Так как стандартные теплоты образования простых веществ условно принята равными нулю, то теплота образования гидроксида кальция будет равна тепловому эффекту реакции образования его из простых веществ (кальция, водорода и кислорода):


Ответ: -986,50 кДж.
Задание 90.
Тепловой эффект реакции сгорания жидкого бензина с образованием паров воды и диоксида углерода равен -3135,58 кДж. Составьте термохимическое уравнение этой реакции и вычислите теплоту образования С6Н6 (ж). Ответ: +49,03 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Термохимическое уравнение реакции имеет вид:
С6Н6 (ж) + 7/2O2 = 6CO2 (г) + 3Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:









Ответ: +49,03 кДж.
Видео:Тепловой эффект реакции. ЗадачиСкачать

Теплота образования
Задание 91.
Вычислите, сколько теплоты выделится при сгорании 165 л (н.у.) ацетилена С2Н2, если продуктами сгорания являются диоксид углерода и пары воды? Ответ: 924,88 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Уравнение реакции имеет вид:
С2Н2 (г) + 5/2O2 (г) = 2CO2 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 165 л ацетилена по этой реакции, определим из пропорции:
22,4 : -802,1 = 165 : х; х = 165 (-802,1)/22,4 = -5908,35 кДж; Q = 5908,35 кДж.
Ответ: 5908,35 кДж.
Задание 92.
При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 л NO в пересчете на нормальные условия? Ответ: 452,37 кДж.
Решение:
Уравнение реакции имеет вид:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при сгорании 44,8 л аммиака, вычислим из пропорции:
22,4 : -226,185 = 44,8 : х; х = 44,8 (-226,185)/22,4 = -452,37 кДж; Q = 452,37 кДж.
Ответ: 452,37 кДж
Тепловой эффект реакции
Задание 93.
Реакция горения метилового спирта выражается термохимическим уравнением:
СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); 
Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж.
Решение:
(СН3ОН (ж)) = (СН3ОН (г)); 
+37,4 кДж = -201,17 — 

Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса:





Ответ: -726,62 кДж.
Термохимическое уравнение реакции
Задание 94.
При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН(ж). Ответ: —277,67 кДж.
Решение:
Мольная масса С2Н5ОН равна 46,0г/моль.
Находим тепловой эффект реакции горения этилового спирта из пропорции:
Следовательно, термохимическое уравнение реакции будет иметь вид:
С2Н5ОН (ж) +3О2 (г) = 2СО2 (г) + 3Н2О (г); 
Обозначим искомую величину через х, запишем термохимическое уравнение образования С2Н5ОН из простых веществ:
Запишем также термохимические уравнения образования СО2(г) и Н2О(ж):
Из уравнений (2), (3) и (4) можно получить уравнение (5). Для этого умножим уравнение (4) на три, уравнение (2) — на два, а затем из суммы уравнений (3) и (4) вычтем уравнение (2), получим:
Сравнивая уравнения (1) и (5), находим:
Ответ: 
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Напишите термохимические уравнения реакций, тепловой эффект которых является теплотой образования всех реагентов заданной химической реакции.
Образцы выполнения с/р2
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА. РАВНОВЕСИЕ. КИНЕТИКА.
ЗАДАЧА 1. Теплота сгорания топлива.
| Объем топлива, л | Состав топливной смеси, % | |||
| СН4 | С2Н6 | С3Н8 | С4Н10 | С6Н6 |
| — | — | — |
Имеем газовую топливную смесь: 50%СН4 + 50%С4Н10.
Суммарный объем V=1000 л=1м 3 .
Напишите химические уравнения реакций горения газовых составляющих заданной топливной смеси.
Реакция горения метана:
Реакция горения бутана:
Энтальпия Δ r Н 0 298 этих химических реакций является теплотой сгорания газового топлива ΔН 0 сг.
2. Рассчитайте, сколько теплоты можно получить при сжигании заданного объема топливной смеси заданного состава (объемные %), условия считать нормальными.
С использованием закона Гесса рассчитаем теплоту сгорания газового топлива ΔН 0 сг при стандартном состоянии и 298 К, используя табличные данные (см. приложение, табл. ) теплоты образования всех веществ, участвующих в реакции горения (Δf Н 0 298):
= — 393,62 + 2 . (-285,84) – (-74,78) — 0 = -802,28 кДж/моль.
= 4 . (- 393,62) + 5 . (-285,84) – (-126,15) — 0 = -2877,53 кДж/моль.
Удельная теплота сгорания QТ газового топлива:
где 22,4 л/моль – молярный объем газа при н.у.
QT, СН4= — ( -802,28 . 1000 / 22,4) =35816 кДж/м 3 .
QT, С4Н10= — ( -2877,53 . 1000 / 22,4) =128461 кДж/м 3 .
Суммарное количество теплоты, полученное при сгорании данной топливной смеси с учетом объемов газов:
=35816 . (1 . 0,5)+128461 . (1 . 0,5) =82138,5 кДж.
3. Из заданной топливной смеси выберите наиболее энергоэффективное топливо. Рассчитайте удельную теплоту сгорания этого топлива QT, кДж/м 3 . Рассчитайте минимальный объем этого топлива для получения 100 МДж теплоты.
Наиболее энергоэффективное топливо в данной топливной смеси – бутан, удельная теплота сгорания QT, С4Н10 = 128461 кДж/м 3 .
Для получения 100 МДж теплоты необходимо сжечь:
VС4Н10 = Q/ QT, С4Н10 =100000/128461=0,778 м 3 = 778 л.
ЗАДАЧА 2. Химическая термодинамика.
| Химическая реакция (п.1) | ргаз . 10 -5 , Па (п.2) | Сисх, моль/л (п.3) | |||
| А | В | D | М | А | В |
| СO2 (г) + C(к) « 2CО(г) | — | 0,02 | — | 0,5 | — |
Напишите термохимические уравнения реакций, тепловой эффект которых является теплотой образования всех реагентов заданной химической реакции.
Для химической реакции
Вещество C(к) – простое, устойчивое при 298 К и давлении 100 кПа, энтальпия его образования DH 0 f,298, = 0.
Термохимические уравнения реакций, тепловой эффект которых является теплотой образования реагентов заданной химической реакции СO2 (г) и CО(г) :
2. Рассчитайте величины энтальпии Dr H 0 298 , энтропии Dr S 0 298 заданной химической реакции (п.1. табл. к задачам 1, 2) при стандартном состоянии (с.с.) всех реагентов и температуре 298 К. Сделайте вывод о тепловом эффекте реакции.
По табличным данным (см. табл. ) запишем термодинамические функции состояния реагентов заданной химической реакции при стандартном состоянии и 298 К
| вещество | DH 0 f,298, кДж/моль | DG 0 f,298 , кДж/моль | S 0 f,298 , Дж/моль . К | ср, Дж/моль . К | Температурный интервал, К |
| С(графит) | 5,74 | 8,54 | 298-2300 | ||
| СО2 (г) | -393,51 | -394,38 | 213,68 | 37,41 | 298-2500 |
| СО (г) | -110,5 | -137,14 | 197,54 | 29,14 | 298-2500 |
С использованием закона Гесса рассчитаем энтальпию ΔrН 0 298, энтропию ∆rS 0 298и энергию Гиббса Δr G 0 298 химической реакции при стандартном состоянии и 298 К:
= 2(-110,5) – 0 – (-393,5) = 172,5 кДж.
Δr Н 0 298 >0 — реакция эндотермическая, идет с поглощением теплоты.
= 175,66 Дж/К.
∆rS 0 298>0 – система стала более неупорядоченной вследствие образования дополнительного количества газа.
3. Рассчитайте величину энергии Гиббса DrG 0 298 заданной химической реакции (п.1. табл. к задачам 1, 2) при стандартном состоянии (с.с.) всех реагентов и температуре 298 К. Определите, в каком направлении будет самопроизвольно протекать данная реакция при стандартном состоянии всех реагентов и температуре 298 К.
= 2(-137,14) – 0 – (-394,38) = 120,15 кДж.
ΔrG 0 298 >0 – самопроизвольное протекание реакции в прямом направлении при стандартном состоянии и 298 К невозможно. Реакция протекает в обратном направлении.
4. Определите область температур, при которых возможно самопроизвольное протекание прямой реакции при стандартном состоянии всех реагентов без учета зависимости Dr H 0 и Dr S 0 от температуры. Постройте график зависимости энергии Гиббса реакции от температуры DrG 0 = f (Т ).
Возможность самопроизвольного протекания реакции при стандартном состоянии определяется неравенством ∆r G 0 T 0 T = ∆r H 0 298 + 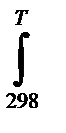
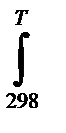
298 982 2300Т
С учетом температурных интервалов существования реагентов температурная область самопроизвольного протекания реакции при стандартном состоянии 982 0 Т + RTln 
Рассчитаем Δr G298 при 298 К и давлениях газов: рСО = 2 . 10 3 Па,
Относительные парциальные давления газов:

ΔrG298 >0 – самопроизвольное протекание реакции в прямом направлении при заданных парциальных давлениях газов и 298 К невозможно. Реакция протекает в обратном направлении.
6. Определите, как нужно (теоретически) изменить парциальное давление любого из исходных газов (рА или рВ) для изменения направления протекания процесса по сравнению со стандартным состоянием при 298 К и стандартном парциальном давлении всех других компонентов химической реакции.
При стандартном состоянии и 298 К возможно самопроизвольное протекание реакции в обратном направлении, т.к. ΔrG 0 298 >0.
Для изменения направления протекания процесса по сравнению состандартным состояниемпри 298 К можно изменить парциальное давление СО2 , (состояние всех других компонентов стандартное). Условием самопроизвольного протекания реакции в прямом направлении является ΔrG298 0 Т + RTln 

Таким образом, для изменения направления протекания процесса по сравнению состандартным состояниемпри 298 К и давлении рСО = 10 5 Па нужно увеличить парциальное давление СО2 в 10 5 раз, т.е. парциальное давление СО2 должно быть: рСО2 > 10 25 Па.
При таком давлении СО2 заданная химическая реакция может самопроизвольно протекать в прямом направлении при 298 К.
Видео:Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Рbv28231 Методика решения задач по физической химии (1) (стр. 3 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
Ответ. Энергия связи С–Н в метане
составляет 414,325 кДж/моль.
Задача 5. (Региональный (III) этап 2002 г., 10-й класс.)
Теплота образования химического соединения – это тепловой эффект химической реакции образования 1 моль этого вещества из простых веществ, взятых в наиболее устойчивом состоянии при давлении 1,01•105 Па и температуре 25 °С.
1. Исходя из этого определения, напишите термохимические уравнения реакций, тепловой эффект которых будет равен теплоте образования газообразного аммиака [Qобр (NH3 (г.))], углекислого газа [Qобр (CO2 (г.))], жидкой воды [Qобр (H2O (ж.))] и мочевины [Qобр (NH2–CO–NH2 (тв.))].
2. На основании этих уравнений выведите формулу расчета Qx реакции (Х):
NH3 (г.) + CO2 (г.) —> (NH2)2CO (тв.) + H2O (ж.) + Qx, (Х)
через теплоты образования участвующих в реакции веществ.
3. Следствием из какого закона является выведенная вами формула?
4. Рассчитайте тепловой эффект реакции (Х), исходя из данных таблицы:
5. Какое количество теплоты выделится при образовании мочевины (уравнение Х), если исходные объемы аммиака и углекислого газа (н. у.) равны соответственно 8,96 и 17,38 л? Выход в реакции считать за 100%.
1. Запишем термохимические уравнения, тепловые эффекты которых равны соответствующим теплотам образования:
1,5H2 (г.) + 0,5N2 (г.) = NH3 (г.) + Qобр (NH3 (г.)), (1)
С (гр.) + О2 (г.) = СО2 (г.) + Qобр (CO2 (г.)), (2)
N2 (г.) + 2H2 (г.) + С (гр.) + 0,5O2 (г.) = (NH2)2CO (тв.) + Qобр (NH2–CO–NH2 (тв.)), (3)
H2 (г.) + 0,5O2 (г.) = H2O (ж.) + Qобр (H2O (ж.)). (4)
2. Термохимическое уравнение, тепловой эффект которого надо определить:
2NH3 (г.) + CO2 (г.) = (NH2)2CO (тв.) + H2O (ж.) + Qx. (Х)
Уравнение (Х) получим, сложив уравнения (3) и (4) и вычтя из этой суммы уравнение (2) и удвоенное уравнение (1):
Qx = Qобр (NH2–CO–NH2 (тв.) + Qобр (H2O (ж.)) – Qобр (CO2 (г.)) – 2Qобр (NH3 (г.)).
3. Это следствие из закона Гесса (определение теплового эффекта реакции через теплоты образования участвующих в реакции веществ).
4. Qx = 333,2 + 285,8 – 393,5 – 2•46,2 = 133,1 кДж.
5. 

Очевидно, что CO2 дан в избытке, следовательно, расчет надо проводить исходя из количества аммиака.
При взаимодействии веществ, данных в условии задачи, выделится
Задача 6. (Региональный (III) этап 2004 г., 10-й класс.)
Для устойчивого горения пиротехнической смеси (KClO3 + C) без доступа воздуха необходимо, чтобы на 1 г этой смеси исходных веществ выделялось не менее 1,5 кДж теплоты.
Энтальпия сгорания угля равна –394 кДж/моль.
Энтальпия реакции: KClO3 = KCl + 1,5O2 равна –48 кДж/моль KClO3.
Вычислите минимальную массу (г) угля (допустимо считать его чистым углеродом), которую нужно добавить к 100 г хлората калия для устойчивого горения смеси.
Термохимическое уравнение реакции горения угля:
C (гр.)+ O2 (г.) = CO2 (г.)+ 394 кДж.
При сгорании 1 моль (соответственно 12 г) углерода выделяется 394 кДж теплоты.
Пусть надо взять х г угля, тогда масса пиротехнической смеси будет составлять:
При горении х г углерода выделяется (394•х/12) кДж.
При разложении 100 г KClO3 выделяется (48•100/122,5) кДж.
Отсюда следует, что при горении смеси массой m = (100 + х) выделится:
((394•х/12) + (48•100/122,5)) кДж.
По условию для устойчивого горения необходимо, чтобы на 1 г смеси выделялось не менее 1,5 кДж. Из получившегося уравнения:
[(394•х /12) +(48•100/122,5)]/(100 + х) = 1,5
находим, что х = 3,54 г.
Ответ. К 100 г хлората калия
необходимо добавить 3,54 г угля.
Задача 7. (Региональный (III) этап 2002 г., 11-й класс.)
Теплотой сгорания вещества, в состав которого входят С, Н, N и О, называется тепловой эффект реакции сгорания 1 моль этого вещества в избытке кислорода до СО2 (г.), Н2О (ж.) и N2 (г.), приведенных к начальным (в данном случае к стандартным) условиям эксперимента. Даны стандартные теплоты сгорания мочевины и аммиака: 631,9 кДж/моль и 382,5 кДж/моль соответственно.
1. Запишите термохимические уравнения, тепловые эффекты которых равны соответственно теплотам сгорания мочевины и аммиака.
2. Исходя из уравнений, полученных в п.1, определите тепловой эффект реакции образования мочевины из аммиака и углекислого газа в расчете на 1 моль аммиака.
3. Вычислите значение стандартной теплоты образования мочевины, если теплоты сгорания водорода и графита равны соответственно 285,8 и 393,5 кДж/моль.
4. Вычислите тепловой эффект полного гидролиза мочевины.
5. Напишите систематическое и еще одно тривиальное название мочевины. К какому классу соединений относится мочевина?
1. Исходя из определения теплоты сгорания, можно записать следующие термохимические уравнения реакций:
(NH2)2CO (тв.) + 1,5O2 (г.) = N2 (г.) + CO2 (г.) +2H2O (ж.) + 631,9 кДж,
NH3 (г.) + 0,75O2 (г.) = 0,5N2 (ж.) + 1,5H2O (ж.) + 382,5 кДж.
2. Термохимическое уравнение реакции образования мочевины из аммиака и углекислого газа в расчете на 1 моль аммиака получается комбинацией предыдущих уравнений с учетом коэффициентов:
Qx = (–0,5)631,9 + 382,5= 66,55 кДж.
Тепловой эффект реакции образования мочевины из 1 моль аммиака составляет 66,55 кДж.
3. Термохимические уравнения реакций горения графита и водорода:
С (гр.) + O2 (г.) = CO2 (г.) + 393,5 кДж,
H2 (г.) + 0,5O2 (г.) = H2O (ж.) + 285,8 кДж.
И в той, и в другой реакции из 1 моль исходного вещества образуется 1 моль продукта реакции. Следовательно, теплота сгорания графита численно равна теплоте образования оксида углерода(IV), а теплота сгорания водорода численно равна теплоте образования воды:
Qобр (CO2 (г.)) = 393,5 кДж/моль,
Qобр (H2O (ж.)) = 285,8 кДж/моль.
Воспользуемся уравнением сгорания мочевины:
(NH2)2CO (тв.) + 1,5O2 (г.) = N2 (г.) + CO2 (г.) + 2H2O (ж.) + 631,9 кДж.
Qобр (CO2 (г.)) + 2Qобр (H2O (ж.)) – Qобр ((NH2)2CO (тв.)) = 631,9 кДж.
Qобр ((NH2)2CO (тв.)) = 393,5 + 2•285,8 – 631,9 = 333,2 кДж/моль.
4. Уравнение реакции гидролиза мочевины:
(NH2)2CO (г.) + H2O (ж.) = CO2 (г.) + 2NH3 (г.).
Этот процесс является обратным процессу синтеза мочевины, поэтому для вычисления его теплового эффекта можно воспользоваться данными, полученными при ответе на вопрос 2. Поскольку в процессе гидролиза получается 2 моль аммиака, то вычисленный в ответе на вопрос 2 тепловой эффект надо умножить на два и взять с обратным знаком: –133,1 кДж.
5. Карбамид, диамид угольной кислоты. Класс соединения: амид.
Задача 8. (Региональный (III) этап 2003 г., 11-й класс.)
Ниже приведены данные о процессах.
Образование 36 г H2O (г.) из простых веществ
Выделяется 484 кДж
Полное сгорание 18 г CH3COOH (ж.) до CO2 (г.) и H2O (ж.)
Выделяется 268,2 кДж
Полное сгорание 18,4 г C2H5OH (ж.) до CO2 (г.) и H2O (ж.)
Выделяется 558,8 кДж
Образование 52,8 г CH3COOC2H5 (ж.) в ходе реакции этерификации
Выделяется 3 кДж
Испарение 9 г H2O (ж.)
Поглощается 22 кДж
1. На основании приведенных данных напишите термохимические уравнения, тепловые эффекты которых соответствуют:
• стандартной теплоте образования H2O (г.);
• стандартной теплоте сгорания CH3COOH (ж.);
• стандартной теплоте сгорания C2H5OH (ж.);
• тепловому эффекту реакции этерификации (в расчете на 1 моль эфира).
2. Рассчитайте тепловой эффект реакции этилового эфира уксусной кислоты с водородом на палладиевом катализаторе (в расчете на 1 моль эфира).
1. Стандартные теплоты образования относятся к количеству образуемого вещества, равному одному молю.

следовательно, для написания требуемого термохимического уравнения количество выделившейся в реакции теплоты надо разделить на два:
H2 (г.) + 0,5O2 (г.) = H2O (г.) + 242 кДж. (1)
Стандартная теплота сгорания – тепловой эффект сгорания в кислороде 1 моль вещества до CO2 (г.) и H2O (ж.) (а также N2 (г.), SO2 (г.) и т. д.).

Qсгор(СH3СООН) (ж.) = 268,2/0,3 = 894 кДж/моль;
CH3COOH (ж.) + 2О2 (г.) = 2CO2 (г.) + 2H2O (ж.) + 894 кДж. (2)

Qсгор(С2H5OН) (ж.) = 558,8/0,4 = 1397 кДж/моль;
C2H5OH (ж.) + 3О2 (г.) = 2CO2 (г.) +3H2O (ж.) + 1397 кДж. (3)

Q = 3/0,6 = 5 кДж/моль;
C2H5OH (ж.) + CH3COOH (ж.) = CH3COOC2H5 (ж.) + H2O (ж.) + 5 кДж. (4)
2. Взаимодействие эфира с водородом на палладиевом катализаторе:
CH3COOC2H5 (ж.) + 2H2 (г.) = 2C2H5OH (ж.) + Qx. (5)
Для вычисления неизвестного теплового эффекта воспользуемся законом Гесса. Пользуясь термохимическими уравнениями как алгебраическими выражениями, необходимо так скомбинировать уравнения (1)–(4), чтобы получить уравнение (5). При этом после данной комбинации должны остаться только слагаемые уравнения (5). Из анализа термохимических уравнений (1)–(4) следует, что для вычисления теплового эффекта Qx необходимо учесть тепловой эффект испарения воды, потому что оперировать формулами веществ как обычными членами математических уравнений можно только если эти вещества находятся в одинаковых состояниях.
📺 Видео
Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать

Химия 9 класс (Урок№2 - Тепловой эффект химических реакций. )Скачать

Термохимические уравнения. Экзо- и эндотермические реакции. Задачи на тепловой эффект | Урок 17Скачать

2 2 Закон Гесса, тепловой эффект реакцииСкачать
Тепловой эффект реакции | Химия 10 класс | УмскулСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Расчёт тепловых эффектов реакций по табличным даннымСкачать
Тепловой эффект химической реакции | ХимияСкачать

Типы химических реакций. Тепловой эффект химической реакции | Химия ЕГЭ, ЦТСкачать

Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать