Видео:Видео №3. Как составить изомерыСкачать

Дополнительное задание
1. Объясните с точки зрения теории электронного строения веществ, почему амины называют органическими основаниями.
Амины за счет наличия не поделённой электронной пары у атома азота аминогруппы проявляют основные свойства, подобно аммиаку, взаимодействуя с водой и кислотами, т.е. отщепляя протон, а новая связь образуется по донорно-акцепторному механизму.
2. Как при помощи одного реактива распознать следующие вещества: водный раствор диметиламина и водный раствор 2-аминопропановой кислоты? Дайте обоснованный ответ.
Можно посмотреть среду в этих растворах при помощи индикатора, например лакмусовой бумажкой. В диметиамине среда будет щелочной (диметиламин обладает основными свойствами), и бумажка окрасится в синий цвет. А в 2-аминопропановой кислоте среда будет более кислой, а лакмусовая бумажка покраснеет.
3. Какое из соединений богаче азотом: этиламин или метиламин? Ответ подтвердите расчетом.
4. Напишите структурные формулы двух аминов, в которых массовая доля азота одинакова. Ответ обоснуйте, не прибегая к расчетам.
Массовая доля азота одинакова в аминах, которые являются изомерами, например:
C₂H₅NH₂ (этиламин) и его изомер (CH₃)₂NH – диметиламин.
5. В чем сходство и различие свойств предельных аминов и амммиака?
6. Напишите структурные формулы изомеров первичных аминов состава C₄H₁₁N и назовите эти вещества.
7. Составьте уравнения реакций: а) пропиламина с серной кислотой; б) метиламина с азотной кислотой. Назовите продукты реакций.
8. Даны формулы двух веществ: C₆H₅NH₂ и CH₃NH₂. Сравните влияния углеводородных радикалов в молекулах этих веществ на аминогруппу.
9. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Метан → нитрометан→ метиламин → хлорид метиламмония.
10. Чем целесообразнее отмывать посуду после опытов с анилином: а) водой; б) раствором гидроксида калия; в) соляной кислотой? Ответ обоснуйте.
11. Напишите структурные формулы трех аминокислот, в которых массовая доля азота одинакова. Ответ обоснуйте, не прибегая к расчетам.
12. Напишите уравнения реакций: а) 2-аминобутановой кислоты с гидроксидом калия; б) аминоуксусной кислоты с соляной кислотой; в) 3-аминопропановой кислоты с метанолом.
13. Составьте схему получения аминокислоты из метана. Напишите уравнения соответствующих реакций и укажите условия их протекания.
14. Какие аминокислоты называют незаменимыми? Напишите структурные формулы некоторых из них. Каково значение этих веществ для организма человека?
15. Какую реакцию среды имеет раствор глутаминовой кислоты? Ответ обоснуйте.
В составе глутаминовой аминокислоты две карбоксильные группы и одна аминогруппа, поэтому среда раствора будет кислая.
16. В чем сходство и различие в строении белка и крахмала?
17. Чем определяется специфическая биологическая активность белковой молекулы? В каких случаях она может быть утрачена?
Третичная структура определяет специфические свойства белка, его физиологическую активность. Нарушение этой структуры (при денатурации) приводит к утрате белком особых свойств, например, пропадает каталитическая активность ферментов.
18. Какие виды гидролиза белков вам известны?
Ферментативный (основан на избирательности действия протеолитических ферментов, расщепляющих пептидные связи, образованные определенными аминокислотами), щелочной и кислотный.
19. Составьте схемы образования дипептидов: а) аланин – серин; б) глицин – цистеин.
20. Как опытным путем доказать, что натуральный шелк и шерсть – белки? Опишите ход опыта.
Качественной реакцией на белки являются биуретовая реакций (появление фиолетовой окраски при взаимодействии белка со свежеприготовленным гидроксидом меди (II)) и ксантопротеиновая (желтое окрашивание при взаимодействии белка с концентрированной кислотой).
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Составление формул органических соединений по названиюСкачать  Напишите уравнения реакций с помощью которых можно получить пропиламин изFOR-DLE.ru — Всё для твоего DLE 😉 На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх. |
Задание 1
Какие вещества называют аминами?
Аминами называют органические вещества, в молекулах которых углеводородный радикал связан с аминогруппой ―NH2.
Как классифицируют амины по природе углеводородного радикала?
На предельные и ароматические амины.
В предельных аминах углеводородный радикал ― остаток предельных углеводородов, а в ароматических ― остаток ароматических углеводородов.
Задание 2
Амины называют органическими основаниями. Почему?
Водные растворы аминов содержат в небольшой степени гидроксид-анионы ОН — и имеют щелочную среду. Благодаря этому и способности образовывать соли с неорганическими кислотами их называют органическими основаниями.
Напишите уравнения реакций подтверждающих эту характеристику.
CH3NH2 + H2O ⇄ [CH3NH3] + + OH-
CH3NH2 + HCl ⟶ [CH3NH3]Cl
Сравните основные свойства аммиака, метиламина и анилина.
Основные свойства метиламина выражены сильнее, чем в аммиака. В молекуле метиламина атом азота соединен с углеводородным радикалом, а поскольку электроотрицательность водорода меньше, чем углерода и азота, происходит смещение электронов от трех атомов водорода к атому углерода и затем к атому азота, в результате электронная плотность на атоме азота увеличивается, а повышение электронной плотности превращает азот в более сильного донора пары электронов, то есть способность присоединять к себе катион водорода по донорно-акцепторному механизму, что повышает основные свойства вещества. 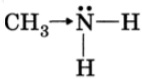
Основные свойства анилина выражены слабее, чем в аммиака. В молекуле анилина атом азота соединен с фенильным радикалом, происходит смещение электронов от атома азота к бензольному кольцу, вследствие этого электронная плотность на атоме азота уменьшается и аналин является более слабым основанием, чем аммиак. 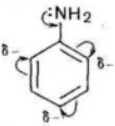
Таким образом, а ммиак является более сильным основанием, чем анилин, но более слабым, чем метиламин.
Задание 3
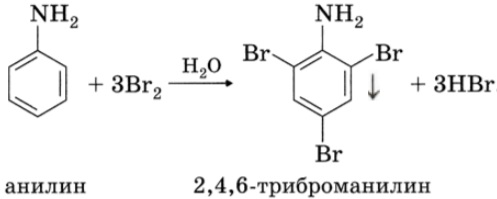
На примере молекулы анилина рассмотрите третье положение теории химического строения органических соединений о взаимном влиянии атомов в молекулах. Ответ подтвердите уравнениями химических реакций.
С одной стороны, в молекуле анилина происходит смещение электронной плотности от аминогруппы к бензольному кольцу, в результате уменьшается электронная плотность на атоме азота и ослабевают основные свойства анилина. Анилин в водном растворе не меняет окраску лакмуса и фенолфталеина.
С другой стороны, увеличивается электронная плотность в бензольном кольце, сильнее всего ― в положениях 2, 4 и 6 относительно аминогруппы, поэтому реакции замещения анилина протекают легче. При действии на анилин брома реакция замещения протекает при обычных условиях без использования катализатора и замещается три атома водорода, образуя 2,4,6-триброманилин.
Задание 4
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
хлорметан ⟶ метанол ⟶ метиламин ⟶ бромид метиламмония.
CH3Cl + NaOH ⟶ CH3OH + NaCl
CH3OH + NH3 ⟶ CH3NH2 + H2O
CH3NH2 + HBr ⟶ [CH3NH3]Br
Задание 5
Смешали 10 л газообразного метиламина (н.у.) и 10 г хлороводорода. Какая масса кристаллического хлорида метиламмония при этом образовалась? Какой газ и в каком объёме остался в колбе после окончания реакции?
Дано: V(CH3NH2)=10 л, m(HCl)=10 г
Найти: m([CH3NH3]Cl)-?, Vостаток(газа)-?
Решение
1. Вычисляем количество вещества метиламина в объёме 10 л по формуле: n=V/VM, где VM ― молярный объём.
n(CH3NH2)=V(CH3NH2)/VM=10 л : 22,4 л/моль=0,446 моль
2. Вычисляем ко личество вещества хлороводорода массой 10 г по формуле: n =m/M, где M ― молярная масса.
M (HCl )=36,5 г/моль
n(HCl)=m(HCl)/M(HCl)=10 г : 36,5 г/моль=0,274 моль
3. Составим химическое уравнение:
HCl + CH3NH2 =[CH3NH3]Cl
По уравнению реакции 1 моль HCl рагирует с 1 моль CH3NH2 , количество вещества одинаковое, то есть с 0,274 моль хлороводорода реагирует 0,274 моль метиламина. По условию задачи имеем 0,446 моль метиламина, следовательно он взят в избытке, то есть реагирует не полностью, поэтому расчеты будем проводить по данным хлороводорода.
n( [CH3NH3]Cl )= n прореаг.( CH3NH2 )= n( HCl )=0,274 моль
nостаток( CH3NH2 )=n ( CH3NH2 )-n прореаг.( CH3NH2 )=0,446 моль-0,274 моль=0,172 моль
4. Вычисляем массу хлорида метиламмония в количестве вещества 0,274 моль формуле: n=m/M, где M ― молярная масса.
M( [CH3NH3]Cl )=67,5 г/моль
m( [CH3NH3]Cl )=n ( [CH3NH3]Cl ) • M( [CH3NH3]Cl )=0,274 г • 67,5 г/моль=18,5 г
5. Вычисляем объём остатка метиламина в количестве вещества 0,172 моль по формуле: V= n • VM, где VM ― молярный объём .
n( CH3NH2 )=n( CH3NH2 ) • VM=0,172 моль • 22,4 л/моль=3,85 л
Ответ: образовалось 18,5 г хлорида метиламмония и осталось 3,85 л метиламина.
Задание 6
При сжигании органического вещества образовалось 1,26 г воды, 0,896 л оксида углерода (IV) и 0,224 л азота (н.у.). Найдите молекулярную формулу этого вещества.
Известно: органическое вещество СхHyNz, m(H2O)=1,26 г, V(СО2)=0,896 л, V(N2) =0,224 л
Найти: формулу СхHyNz — ?
Решение
1-й способ
1. Вычисляем ко личество вещества воды массой 1,26 г по формуле: n =m/M, где M ― молярная масса.
M (H2O )=18 г/моль
n(H2O)=m( H2O )/M( H2O )=1,26 г : 18 г/моль=0,07 моль
2. Вычисляем количество вещества CO2 и N2 в заданном объёме по формуле: n=V/VM, где VM ― молярный объём .
n( CO2 )=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль
n(N 2 )=V( N 2 )/VM=0,224 л : 22,4 л/моль=0,01 моль
3. Вычисляем количество вещества атомов С в 0,04 моль СО2.
n(C)=n(CO2)=0,04 моль
4. Вычисляем количество вещества атомов H в 0,07 моль H2O. В 1 моль Н2О содержится 2 моль атомов Н, а в 0,07 моль Н2О количества вещества атомов в 2 раза больше:
n(H)=2•n(H2O)=2•0,07 моль=0,14 моль
5. Вычисляем количество вещества атомов N в 0,01 моль N2. В 1 моль N2 содержится 2 моль атомов N, а в 0,01 моль N2 количества вещества атомов в 2 раза больше:
n(N)=2•n(N2)=2•0,01 моль=0,02 моль
6. Находим соотношение атомов в веществе:
х:у:z=n(C) : n(H) : n(N)=0,04:0,14:0,02
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,02) равно единице, а большее число делим на него, тогда
х:у:z=0,04/0,02 : 0,14/0,02 : 0,02/0,02=2:7:1, следовательно, формула имеет вид C2H7N, или C2H5-NH 2
2-й способ
1. Вычисляем количество вещества CO2 в объёме 0,896 л и N2 в объёме 0,224 л по формуле: n=V/VM, где VM=22,4 л/моль при н.у.
n( CO2 )=V(CO2)/VM=0,896 л : 22,4 л/моль=0,04 моль
n(N 2 )=V( N 2 )/VM=0,224 л : 22,4 л/моль=0,01 моль
2. Составляем пропорцию для вычисления массы атомов C в 0,04 моль СО2 и решаем ее:
В 1 моль СО2 содержится 12 г С, а
в 0,04 моль СО2 ― х г С
х=m(C)=0,04 моль • 12 г : 1 моль = 0,48 г
3. Составляем пропорцию для вычисления массы атомов N в 0,01 моль N2 и решаем ее:
В 1 моль N2 содержится 28 г N, а
в 0,01 моль H2O ― х г N
х=m(N)=0,01 моль • 28 г : 1 моль = 0,28 г
4. Составляем пропорцию для вычисления массы атомов H в 1,26 г Н2О и решаем ее:
В 18 г H2O содержится 2 г H, а
в 1,26 г H2O ― х г H
х=m(H)=1,26 г • 2 г : 18 г = 0,14 г
5. Находим соотношение атомов в веществе:
х:у:z=m(C)/M(C) : m(H)/M(H) : m(N)/M(N)=0,48/12 : 0,14/1 : 0,28/14=0,04:0,14:0,02
Если соотношение между атомами выражено не целыми, а дробными числами, то считаем, что наименьшее число (0,02) равно единице, а большее число делим на него, тогда
х:у:z=0,04/0,02 : 0,14/0,02 : 0,02/0,02=2:7:1, следовательно, формула имеет вид C2H7N, или C2H5―NH 2
Ответ: C2H7N, или C2H5―NH 2
Задание 7 Создайте компьютерные 3D-модели молекул метиламина и анилина. Рассмотрите взаимное расположение атомов и атомных групп относительно атома азота. Сделайте самостоятельно.
🔥 Видео
ВСЕ неорганические реакции | ЕГЭ по Химии | Катя СтрогановаСкачать

Все 32 и 33 задания с 0 и до уровня ЕГЭ по химии на кислородсодержащие соединенияСкачать

Как составлять УРАВНЕНИЯ РЕАКЦИЙ | БИНАРНЫЕ СОЕДИНЕНИЯ | ХИМИЧЕСКИЕ УРАВНЕНИЯСкачать

Разбор 5 варианта ЕГЭ по химии 2024. Добротин (ФИПИ)Скачать

Все задания №32 из сборника ЕГЭ 2023 (часть 1) | Химия ЕГЭ для 10 класса | УмскулСкачать

Разбор Варианта №17 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать

Вся практика по неорганической химии для ЕГЭ за 6 часов | Екатерина СтрогановаСкачать

Разбор Варианта №21 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать

1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

🔥 РАЗБОР РЕАЛЬНОГО ВАРИАНТА ЕГЭ по химии 🔥 Часть 1Скачать

РЕШАЮ ЕГЭ ПО ХИМИИ НА 80+ ЗА 45 МИНУТ | Химия ЕГЭ 2023 Умскул | Настя МайерСкачать

Органические цепочки с реального ЕГЭ | ЕГЭ ХИМИЯ 2022 | СОТКАСкачать

Идентификация неорганических веществСкачать

Разбор Варианта №19 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать

Извлечение и Качественные реакции сапониновСкачать

ПОЛУЧЕНИЕ Галогенпроизводных. Получение хлорэтана. Реакция Этанола, Хлорида Натрия и Серной КислотыСкачать

Разбор ошибок в заданиях #32 и 34 на примерах реальных бланков 2021 | ЕГЭ по ХимииСкачать