- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ca-> Ca(OH)2-> CaCO3-> Ca(HCO3)2 -> CaCl2 —
- Ваш ответ
- решение вопроса
- Похожие вопросы
- Напишите уравнения реакций с помощью которых можно осуществить следующие превращения ca cacl2 caco3
- 🎥 Видео
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

We are checking your browser. gomolog.ru
Видео:Решение цепочек превращений по химииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702c5fc7f9760bfd • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: Ca-> Ca(OH)2-> CaCO3-> Ca(HCO3)2 -> CaCl2 —
Видео:8 класс. Цепочки превращений. Генетические ряды.Скачать

Ваш ответ
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

решение вопроса
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Похожие вопросы
- Все категории
- экономические 43,415
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,066
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:ОГЭ. Задание 21. Цепочка превращений.Скачать
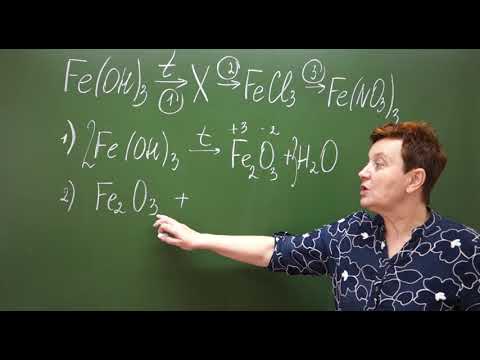
Напишите уравнения реакций с помощью которых можно осуществить следующие превращения ca cacl2 caco3
FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
ПРОВЕРЬТЕ СВОИ ЗНАНИЯ
Упражнение 1. Сравните общие характеристики щелочных и щёлочноземельных металлов. Укажите тип связи и тип кристаллической решётки в простых веществах, образованных этими металлами.
На внешнем энергетическом уровне атомы всех щелочных металлов имеют по одному электрону, а атомы щелочно-земельных металлов ― по два электрона. Для щелочных и щёлочноземельных металлов характерна металлическая связь и металлическая кристаллическая решетка, а отсюда и все типичные для металлов свойства: металлический блеск, пластичность, тепло- и электропроводность. Металлические свойства щелочных металлов возрастают от лития к цезию, а щёлочноземельных ― от кальция к барию. Максимальная степень окисления щелочных металлов равна +1, а щёлочноземельных ― +2. Формула высших оксидов щелочных металлов Me2O, а щёлочноземельных ― MeO. Все они являются основными оксидами, следовательно, взаимодействует с водой, кислотами и кислотными оксидами. Гидроксиды щелочных металлов имеют формулу MeOH, а щёлочноземельные ― Me(OH)2. Данные гидроксиды являются растворимыми основаниями – щёлочами, следовательно, взаимодействует с кислотами, кислотными оксидами и солями.
Упражнение 2. Перечислите общие химические свойства щёлочноземельных металлов. Подчеркните особенности взаимодействия этих металлов с водой.
Щелочные и щёлочноземельные металлы взаимодействуют с неметаллами, водой, кислотами, оксидами менее активных металлов. В результате реакции щелочных и щёлочноземельных металлов с водой образуются щелочь и водород.
Реакция в общем виде взаимодействия щелочных металлов с водой:
2Me + 2H2O = 2MeOH + H2↑
Реакция в общем виде взаимодействия щёлочноземельных металлов с водой:
Me + 2H2О = Me(OH)2 + H2↑
ПРИМЕНИТЕ СВОИ ЗНАНИЯ
Упражнение 1. С помощью какой химической реакции можно доказать, что в состав минералов кальция — известняка, мрамора, кальцита — входит карбонат этого металла? Взаимодействием с сильной кислотой, вследствие чего выделяется углекислый газ, то есть раствор «вскипает».
Напишите уравнение реакции в молекулярной и ионной формах.
CaCO3 + 2HCl = CaCl2 + CO2 ↑ + H2O
CaCO3 + 2H + + 2Cl — → Ca 2+ + 2Cl + + CO2 ↑ + H2O
CaCO3 + 2H + → Ca 2+ + CO2 ↑ + H2O
Упражнение 2. Охарактеризуйте свойства оксида кальция как основного оксида. Ответ подтвердите уравнениями химических реакций в молекулярной и ионной формах.
Взаимодействует с водой:
CaO + H2O = Ca(OH)2
Взаимодействует с кислотными оксидами:
CaO + CO2 = CaCO3
Взаимодействует с кислотами:
CaO + 2HСl = CaCl2 + H2O
CaO + 2H + + 2Cl — ⟶ Ca 2+ + 2Cl — + H2O
CaO + 2H + → Ca 2+ + H2O
3BaCl2 + 2Na3PO4 = 6NaCl + Ba3(PO4)2↓
3Ba 2+ + 6Cl — + 6Na + + 2PO4 3- → 6Na + + 6Cl — + Ba3(PO4)2↓
3Ba 2+ + 2PO4 3- → Ba3(PO4)2↓
Упражнение 4. При обработке 9,8 г смеси карбоната, гидроксида и сульфата кальция выделилось 0,896 л газа (н.у.) и осталось 2,1 г твёрдого остатка. Вычислите массовую долю компонентов в смеси.
Дано: V(CO2)=0,896 л, m (смеси)=9,8 г, m (тв. остатка)=2,1 г
Найти: ω(СaCO3)-?, ω(Сa(OH)2)-?, ω(СaSO4)-?
Решение
1. Количество вещества углекислого газа объемом 0,896 л рассчитываем по формуле: ʋ=V/VM, где VM=22,4 л/моль.
ʋ( Н2О )= V(CO2) / V M=0,896 л : 22,4 л/моль=0,04 моль
2. Составим химические уравнения:
CaCO3 + HCl = CaCl2 + CO2 ↑ + 2H2O
Ca(OH)2 + 2HCl = CaCl2 + 2H2O
CaSO4 + HCl ≠
По уравнению реакции 1 моль карбоната кальция реагирует с выделением 1 моль углекислого газа, количество вещества одинаковое, поэтому:
ʋ(СаСО3)= ʋ(СО2)= 0,04 моль
Поскольку СаС l2 растворимая соль, поэтому твердый остаток ― это соль CaSO4, то есть m(СаSО4)=2,1 г
3. Массу карбоната кальция количеством вещества 0,04 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(СаСО3)=100 г/моль
m(СаСО3)=ʋ(СаСО3)•M(СаСО3)=0,04 моль • 100 г/моль=4 г
4. Рассчитываем массу гидроксида кальция:
m(Ca(OH)2)=m(смеси)-m(CaCO3)-m(CaSO4)=9,8 г — 4 г — 2,1 г=3,7 г
5. Рассчитываем массовую долю компонентов смеси.
ω( СаСО3 ) =( m( СаСО3 ):m(смеси)) •100% =(4 г : 9,8 г) •100% =40,8%
ω( Са(ОН)2 ) =( m( Са(ОН)2 ):m(смеси)) •100% =(3,7 г : 9,8 г) •100% =37,6%
ω( СаSО4 ) =( m( СаSО4 ):m(смеси)) •100% =(2,1 г : 9,8 г) •100% =21,4%
Ответ: 40,8% CaCO3, 37,6% Ca(OH)2, 21,4% CaSO4
Упражнение 5. Какую массу соды (безводный карбонат натрия Na2CO3) необходимо добавить к 100 л жёсткой воды, содержащей 610 мг/л гидрокарбонат-ионов, для её полного умягчения?
Дано: V(H2O)=100 л, ρ(HCO3 — )=610 мг/л=0,61 г/л
Найти: m(Na2CO3)-?
Решение
1. Рассчитываем массу гидрокарбонат-ионов:
m ( HCO3 — )= ρ( HCO3 — ) • V(Н2О) =0,61 г/л • 100 л=61 г
2. Количество вещества гидрокарбонат-ионов рассчитываем по формуле: ʋ=m/M, где M=Mr г/моль.
M( HCO3 — )=61 г/моль
ʋ( HCO3 — )=m( HCO3 — )/M( HCO3 — )=61 г : 61 г/моль=1 моль
3. Составим химическoе уравнениe в общем виде:
Na2CO3 + Ме 2+ + 2HCO3 − =2NaHCO3 + MeCO3↓
По уравнению реакции с 1 моль карбоната натрия реагирует 2 моль гидрокарбонат-ионов, то есть количество вещества карбоната натрия в 2 раза меньше количества вещества гидрокарбонат-ионов, поэтому:
ʋ (Na2СО3)= ʋ ( HCO3 — ):2=1 моль:2=0,5 моль
4. Массу карбоната натрия количеством вещества 0,5 моль рассчитываем по формуле: m=ʋ•M, где M=Mr г/моль.
M(Nа2СО3)=106 г/моль
m(Nа2СО3)=ʋ(Nа2СО3)•M(Na2СО3)=0,5 моль • 106 г/моль=53 г
Ответ: 53 г
Используйте дополнительную информацию и выразите мнение
Вопрос 1. Щелочные металлы получают электролизом расплавов их гидроксидов — щелочей. Для получения щёлочноземельных металлов используют электролиз расплавов их солей. Как вы думаете, почему для этих целей не годятся гидроксиды щёлочноземельных металлов?
Поскольку при расплавлении (нагрев от пропускания электрического тока) гидроксиды шёлочноземельных металлов разлагаются с образованием соответствующих оксидов металла, а не простого вещества металла.
Напишите уравнение электролиза расплава хлорида кальция:
CaCl2(распл.) ⟶ Ca + Cl2↑ (над ⟶ напишите электролиз)
🎥 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать

Цепочки превращений по неорганической химии. Вариант №3.Скачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

1.4. Алканы: Решение цепочек. ЕГЭ по химииСкачать

Химия | Молекулярные и ионные уравненияСкачать

8 класс. Составление уравнений химических реакций.Скачать

9 класс § 4. "Цепочки превращений".Скачать

Самые сложные органические цепочки ЕГЭ 2023 | Екатерина СтрогановаСкачать
