Ртуть — элемент побочной подгруппы второй группы шестого периода периодической системы химических элементов Д. И. Менделеева с атомным номером 80. Обозначается символом Hg (лат. Hydrargyrum). Простое вещество ртуть — переходный металл, при комнатной температуре представляет собой тяжёлую серебристо-белую жидкость, пары которой чрезвычайно ядовиты.
Ртуть — один из двух химических элементов (и единственный металл), простые вещества которых при нормальных условиях находятся в жидком агрегатном состоянии
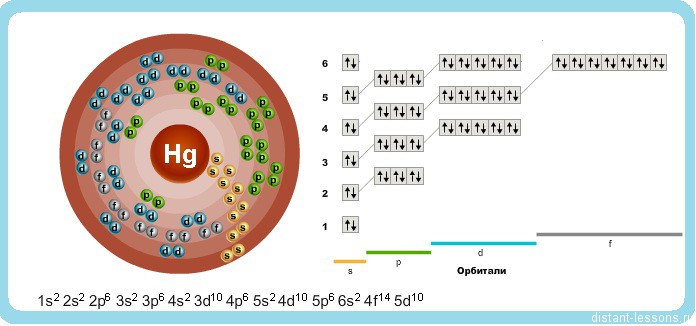
Исходя из электронного строения, можно сделать вывод, что для в соединениях ртуть будет проявлять степени окисления +2 и +1.
Физические свойства ртути:
- при комнатной температуре — сербристо-серая жидкость , легко переходящая в газообразное состояние ;
- электро- и теплопроводна;
- очень высокая плотность вещества;
Как видите, все вышеперечисленные свойства — характеристики металлического вещества, хотя и в жидком состоянии.
Химические свойства ртути:
1) Реакция с кислородом (при нагревании >300 ° С): 2Hg + O2 = 2HgO (красного цвета);
2) реагирует с водородом, но только с атомарным ( так же при нагревании): Hg + 2H = HgH2 — гидрид ртути;
3) C неметаллами ( при нагревании): Hg + S = HgS
4) Взаимодействие с кислотами: с кислотами-не окислителями не взаимодействует
В ряду активности металлов ртуть стоит после водорода, поэтому в реакциях с кислотами-окислителями водород не выделяется:
Как видно из реакции, чаще всего в соединениях ртуть проявляет степень окисления + 2, но +1 тоже встречается, причем в очень необычном виде:
Степень окисления
Соединения ртути
+1
Оксид — не выделен;
Гидроксид — не выделен
Катион ртути — Hg2 2+ , соответственно, соль — нитрат ртути (I) — Hg2(NO3)2
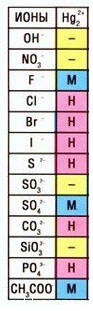
Кстати, таких соединений ртути (I) немало — смотрите таблицу растворимости:
+2
Оксид — HgO (относят к слабым основным или даже амфотерным оксидам);Гидроксид — не выделен
Что касается соединений ртути (II), то не смотря на то, что простое вещество ртуть — металл, в веществах HgS (черные или красные кристаллы) и HgJ2 (желтые кристаллы) cвязь ковалентная.
Связь ртуть-углерод в органических соединениях ртути самая прочная из всех известных металл-органических связей
Соединения ртути чрезвычайно ядовиты, соответственно, как и большинство других ядов, их часто используют в медицине:
- хлорид ртути (I) (каломель) — слабительное;
- меркузал и промеран — сильные мочегонные;
- хлорид ртути (II), цианид ртути (II), амидохлорид ртути и жёлтый оксид ртути(II) — антисептики (в том числе в составе мазей).
- Амальгаму серебра применяют в стоматологии в качестве материала зубных пломб.
- Реакция ртути и воды при нагревании?
- К реакциям замещения относится : а) горение фосфора б) реакция между гидроксидом лития и соляной кислотой в) реакция между калием и водой г) разложение гидроксида алюминия при нагревании?
- Напишите уравнения реакций между хлором и следующими веществами : водородом, литием, алюминием, водой, гидроксидом натрия (при нагревании и без нагревания)?
- Напишите уравнение реакции взаимодействия метилацетилена с бромоводородом, водой в присудствии солей ртути (||) в качестве катализатора?
- К реакциям замещения относится :а) горение фосфора б) реакция между гидроксидом лития и соляной кислотойв) реакция между калием и водой г) разложение гидроксида алюминия при нагревании?
- При нагревании оксида ртути (HgO) образуется ртуть и кислород?
- Оксид ртути(II) при нагревании легко разлагается на простые вещества?
- При взаимодействии ртути и кислорода образуется оксид ртути HgO?
- Напишите уравнение реакции взаимодействия ацетилена с водой в присутствии солей ртути?
- Составить уравнение реакции : При нагревании нерастворимое основание(гидроксид) распадается на основной оксид и воду(H2O)?
- Гидроксиды железа (3), магния, цинка, кальция при нагревании разлагаются на оксид и воду Напишите уравнение реакций?
- Ртуть
- Что такое ртуть
- Соли ртути
- Получение ртути
- Амальгама
- hg Меркурий или Ртуть
- Применение ртути
- Химические свойства ртути
- Похожие страницы:
- Leave a Comment
- 📹 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакция ртути и воды при нагревании?
Химия | 10 — 11 классы
Реакция ртути и воды при нагревании?
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

К реакциям замещения относится : а) горение фосфора б) реакция между гидроксидом лития и соляной кислотой в) реакция между калием и водой г) разложение гидроксида алюминия при нагревании?
К реакциям замещения относится : а) горение фосфора б) реакция между гидроксидом лития и соляной кислотой в) реакция между калием и водой г) разложение гидроксида алюминия при нагревании.
Видео:Капля воды и ртути.Скачать

Напишите уравнения реакций между хлором и следующими веществами : водородом, литием, алюминием, водой, гидроксидом натрия (при нагревании и без нагревания)?
Напишите уравнения реакций между хлором и следующими веществами : водородом, литием, алюминием, водой, гидроксидом натрия (при нагревании и без нагревания).
Во всех реакциях укажите окислитель и восстановитель.
Видео:8 класс. Составление уравнений химических реакций.Скачать

Напишите уравнение реакции взаимодействия метилацетилена с бромоводородом, водой в присудствии солей ртути (||) в качестве катализатора?
Напишите уравнение реакции взаимодействия метилацетилена с бромоводородом, водой в присудствии солей ртути (||) в качестве катализатора.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

К реакциям замещения относится :а) горение фосфора б) реакция между гидроксидом лития и соляной кислотойв) реакция между калием и водой г) разложение гидроксида алюминия при нагревании?
К реакциям замещения относится :
а) горение фосфора б) реакция между гидроксидом лития и соляной кислотой
в) реакция между калием и водой г) разложение гидроксида алюминия при нагревании.
Видео:Что если прыгнуть в бассейн наполненный ртутью #shortsСкачать

При нагревании оксида ртути (HgO) образуется ртуть и кислород?
При нагревании оксида ртути (HgO) образуется ртуть и кислород.
Вычислите массу кислорода если при разложении 4, 32г оксида ртути получилась ртуть массой 4г.
Видео:СМЕРТЕЛЬНЫЕ ОШИБКИ ПРИ СБОРЕ РТУТИ!Скачать

Оксид ртути(II) при нагревании легко разлагается на простые вещества?
Оксид ртути(II) при нагревании легко разлагается на простые вещества.
Почему при восстановлении его водородом может произойти взрыв, даже если водород был предварительно проверен на чистоту?
Напишите уравнения реакций.
Видео:Что делать если разбился ртутный градусникСкачать

При взаимодействии ртути и кислорода образуется оксид ртути HgO?
При взаимодействии ртути и кислорода образуется оксид ртути HgO.
Составьте уравнение реакции.
Видео:РТУТЬ, ОСТОРОЖНО!Скачать

Напишите уравнение реакции взаимодействия ацетилена с водой в присутствии солей ртути?
Напишите уравнение реакции взаимодействия ацетилена с водой в присутствии солей ртути.
Как называется образующийся продукт?
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составить уравнение реакции : При нагревании нерастворимое основание(гидроксид) распадается на основной оксид и воду(H2O)?
Составить уравнение реакции : При нагревании нерастворимое основание(гидроксид) распадается на основной оксид и воду(H2O).
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Гидроксиды железа (3), магния, цинка, кальция при нагревании разлагаются на оксид и воду Напишите уравнение реакций?
Гидроксиды железа (3), магния, цинка, кальция при нагревании разлагаются на оксид и воду Напишите уравнение реакций.
Перед вами страница с вопросом Реакция ртути и воды при нагревании?, который относится к категории Химия. Уровень сложности соответствует учебной программе для учащихся 10 — 11 классов. Здесь вы найдете не только правильный ответ, но и сможете ознакомиться с вариантами пользователей, а также обсудить тему и выбрать подходящую версию. Если среди найденных ответов не окажется варианта, полностью раскрывающего тему, воспользуйтесь «умным поиском», который откроет все похожие ответы, или создайте собственный вопрос, нажав кнопку в верхней части страницы.
1. CH3COOH 2. CH(тройная связь) C — CH2 — CH3 3. CH2 = CH — CH2 — CH2 — CH2 — CH3 4. CH3 — CH(CH3) — CH(CH3) — CH3 5. CH2 = CH — CH = CH2 6. CH3 — CH2 — CH2 — CH2 — CH2 — CH2 — CH2 — CHO — октаналь просто, а октаналя — 3 не бывает. В 4й ф — ле ..
CH3COOH + NaOH(тв) = Na2CO3 + CH4(при нагревании) 2CH4 = C2H4 + H2(в присутствии кислородаи оксидовмарганца, кадмия).
Cl p = 17, n = 35, 5 — 17 = 18, 5 = 18 Ответ : 17 протонов, 18 нейтронов.
Правильная формула будет выглядеть вот так НОСН2СН2СН2ОН — это пропандиол — 1, 3.
Пропандиол — 1, 3 (в вашей формуле ошибка, у С не может быть валентность 5, только 4! ) двухатомный спирт.
Если металл II группы, значит его валентность равна 2. Реакция металла с водой дана ниже : Ме + 2Н₂О→Ме(ОН)₂ + Н₂. Над элементами мы пишем то, что нам дали, а под ними мы пишем их атомные и молекулярные массы, то есть : Остаётся найти х по пропорц..
X + 2H₂O = X(OH)₂ + H₂ по уравнению реакции m(X) / M(X) = m(H₂) / M(H₂) молярная масса металла M(X) = M(H₂)m(X) / m(H₂) M(X) = 2 * 4 / 0, 2 = 40 г / моль X = Ca.
1) СH3 — CH2 — CH2 — CH = CH2(пентен — 1) 2)СH3 — CH = CH — CH2 — CH3(пентен — 2) 3)СH3 — CH2 — C = CH2(2 — метилбутен — 1) I CH3 4) СH3 — CH = C — CH3(2 — метилбутен — 2) I CH3 5)СH3 — CH — CH = CH2(3 — метилбутен — 1) I CH3 6)Во вложении(циклопента..
BaCl₂ + AgNO₃ → Ba(NO₃)₂ + AgCl↓ Pb(NO₃)₂ + K₂S →KNO₃ + PbS↓ 3Ca(NO₃)₂ + 2H₃PO₄ →6HNO₃ + Ca₃(PO₄)₂↓ Ba(NO₃)₂ + Na₂SO₄ →2NaNO₃ + BaSO₄↓ Реакция протекает до конца, если 1. Образуется осадок 2. Выделяется газ 3. Образуется H₂O Стрелками указаны осад..
Я уже сегодня решал похожее задание S + O2 = SO2Найдем кол — во в — ва серы1)n = m / Mn(S) = 8г / 32г / моль = 0. 25 моль2)Vs = Vso2, значит, теперь просто подставим все в форумулу : m = n * MmSO2 = 0. 25моль * 64г / моль = 16 гОтвет : m(SO2) = 16г..
Видео:Гальванические элементы. 1 часть. 10 класс.Скачать

Ртуть
Ртуть это уникальный металл который в нормальных условиях остается в жидком состоянии (расплавленном), известен с давних времен так как встречается в свободном состоянии и называется (меркурий), практически все соединения токсичны и ядовиты. Практическое применение его широко из за его свойств.
Видео:ртуть в водеСкачать

Что такое ртуть
(Hydrargyrum), Hg — хим. элемент II группы периодической системы элементов; ат. н. 80, ат. м. 200,59. Серебристо-белый жидкий металл. В соединениях проявляет степени окисления +1 и +2. Природная ртуть состоит из стабильных изотопов 198Hg, 198Hg, 199Hg, 200 Hg, 201Hg, 202Hg и 204Hg. Получены 18 радиоактивных изотопов, из которых наибольшее практическое значение имеют изотопы 203Hg и 205Hg с периодами полураспада соответственно 47 дней и 5,1 мин.
Ртуть и ее соединения известны с древнейших времен. Содержание Р. в земной коре 8,3 х 10-6. Известно около 30 минералов Р., включая ртуть самородную и амальгамы различных металлов. Некоторые из минералов (киноварь HgS, ее разновидность метациннабарит, ливингстонит HgS х 2Sb2S3 и тиманнит HgTe) встречаются в сравнительно больших количествах и являются источником пром. добычи металла.
Кристаллическая решетка Р. ромбоэдрическая, расстояние между атомами, равное постоянной решетки простейшего ромбоэдра, 2,999 А. Атомный радиус 1,60 А, ионный радиус Hg+ равен 1,12 А. Р.— единственный металл, к-рый остается жидким при низких т-рах (вплоть до т-ры — 38,87° С).
Потенциалы ионизации Hg° → Hg+ → Hg2+ Hg3+ → Н4+ составляют соответственно 10,41; 18,55; 32,43 и 45,98 в. Плотность при т-рах 0 и 20° С равна соответственно 13,5951 и 13,5459 г/см3; t кип 356,58° С; температурный коэфф. объемного расширения твердой Р. в интервале т-р от —89,9 до —39,5° С изменяется от 12,5 х 10-5 до 17,1 х 10 -5 град-1; температурный коэфф. объемного расширения жидкой Р. в интервале т-р от —38,87 до 350° С изменяется от 1,823 х 10-4 до 1,889 х 10-4 град-1; теплоемкость (кал/г- град): 0,0339 (т-ра —38,87° С); 0,03353 (т-ра 0° С); 0,03334 (т-ра 20° С); 0,03275 (т-ра 100° С) и 0,0324 (т-ра 350° С); удельное электрическое сопротивление (т-ры —30; 0 и 20° С) равно соответственно 0,91700; 0,94123 и 0,95833 ом-см. Металлическая Р. диамагнитна. Вязкость жидкой Р. (т-ра 20° С) 0,01544 г/см-сек, поверхностное натяжение 480 дин/см.
Ртутный пар при низких т-рах состоит в основном из атомов, с повышением т-ры степень ассоциации увеличивается, а при критической т-ре он почти целиком состоит из двухатомных молекул. Давление насыщенных паров Р. (мм рт-ст.): 1,447 х 10-8 (т-ра —70° С); 2,046 х 10 -4 (т-ра 0° С);1,2979 х 10 -3 (т-ра 20° С) и 1,3394 х 10-2 (т-ра 50° С). Твердую Р.,как и свинец, можно ковать, протягивать через фильеры, резать ножом и т. д. Твердость по Моосу замерзшей Р.— 1,5.
Сжимаемость жидкой Р. (т-ра 30° С, давление от 1 до 50 бар) 4,051 х 10 -6 бар , коэфф. сжимаемости твердой альфа-ртути (т-ра —73° С, норм, давление) 3,52 X 10 ат-1. При невысоких т-рах Р. инертна ко многим агрессивным жидкостям и газам, включая кислород воздуха. Она практически не взаимодействует с концентрированной серной и соляной к-тами, но хорошо растворяется в азотной к-те, «царской водке», в горячей концентрированной серной к-те.
При нагревании на воздухе окисляется. Если в Р. есть примеси свинца, цинка, меди, кадмия и др., поверхность ее покрывается серой пленкой окислов. С кислородом Р. образует окись HgO, имеющую красную и желтую кристаллические модификации, с галогенами — соединения типа Hg2Г2 и HgГ2 (где Г — фтор, хлор, бром и йод).
Наибольшее значение имеют хлориды ртути: Hg2Cl2 — каломель — белые кристаллы, мало растворимые в воде, а также HgCl2 — сулема — бесцветные кристаллы, растворимые в воде. При взаимодействии Р. с серой образуется сульфид HgS, известный в трех модификациях: альфа-киноварь — красная, метациннабарит — черная и бета-киноварь. Метациннабарит и бета-киноварь неустойчивы и со временем переходят в обыкновенную киноварь.
Соли ртути

Растворением окиси HgO в растворе синильной к-ты, а также взаимодействием щелочного цианида и соли двухвалентной Р. получают бесцветные кристаллы цианида Hg(CN)2. При нагревании смеси Р., концентрированной азотной к-ты и спирта образуется цианат Hg(CNO)2 — гремучая ртуть — белые кристаллы, взрывающиеся при ударе. Взаимодействуя с металлами, Р. образует амальгамы.
Известно большое количество ртуть-органических соединений, в к-рых атомы Р. непосредственно связаны с атомами углерода. Эти соединения находят применение в органическом синтезе при получении элементоорганических соединений.
Получение ртути
В пром-сти металлическую Р. получают гл. обр. пирометаллургическим способом — окислительным обжигом ртутных руд или их концентратов при т-ре 700— 800° С в пламенных, трубчатых, многоподовых и муфельных печах, а также в печах кипящего слоя. При обжиге руды, содержащей, напр., киноварь, Р. восстанавливается до металла, и ее пары вместе с сернистым газом, образующимся при разложении сульфида, попадают в конденсационную систему, где смесь газов охлаждается, пары Р. конденсируются и Р. стекает в приемники.
Для получения металла гидрометаллургическим способом сырье, содержащее Р. в виде сульфида, вначале обрабатывают водным раствором сульфида натрия и едкого натра. Получающийся при этом водный раствор соединения HgS х Na2S цементируют алюминием или подвергают электролизу; выделившуюся Р. фильтруют и затем перегоняют в вакууме. Весьма перспективен способ получения Р., основанный на обжиге ртутного сырья в вакууме.
Ртуть высоких марок чистоты, а также сверхчистая Р. может быть получена при комплексном использовании спец. хим. очистки, перегонки под пониженным давлением воздуха, электролитическим рафинированием в электролизерах с биполярными электродами и последующим перегревом паров Р. выше т-ры 1000° С. Металлическую Р. используют в химии, металлургии, энергетике, электро- и радиотехнике, в приборостроении, строительном деле и др. В хим. пром-сти ртутные катоды применяют для электрохим. получения едкого натра и хлора, а также многочисленных органических соединений.
Амальгама
Способность ртути образовывать амальгамы используют для комплексной переработки полиметаллического сырья методами амальгамной металлургии, для получения высокодисперсных металлических порошков, многокомпонентных сплавов заданных составов, чистых и сверхчистых металлов, содержание примесей в к-рых не превышает 10—6—10-8%. В энергетике Р. используют как рабочее тело в мощных бинарных установках пром. типа, где для генерации Электр, энергии на первых ступенях применяют ртутно-паровые турбины, а на второй — турбины, работающие на водяном паре.
Кроме того, Р. используют в ядерных реакторах для отвода тепла. Пары Р. применяют в люминесцентных лампах дневного света, а также в ртутных кварцевых лампах низкого, высокого и сверхвысокого давления. Помимо этого, пары Р. используют в газотронах, газонаполненных тиратронах и триодах. Особенно широко используют Р. в вакуумной технике.
Ртутные диффузионные насосы незаменимы при получении сверхвысокого (порядка 10-13 мм рт. ст.) вакуума. В лабораторной практике Р. применяют в барометрах, манометрах, вакуумметрах, термометрах, затворах, прерывателях, высоковакуумных насосах, всевозможных реле, терморегулирующих устройствах.
Ее используют в качестве балластной, термостатирую-щей и уплотняющей жидкости. Р. нашла применение в полярографическом анализе. Ртуть и амальгамы используют при амперометрическом и потенциометрическом титровании, кулонометрическом анализе. С помощью Р. определяют пористость материалов.
Р. применяют также для точной калибровки мерной посуды, для определения диаметров капиллярных трубок. Широкое применение находят также соединения Р.: напр.,окись HgO используют в качестве окислителя, для изготовления красок; искусственный сульфид HgS — составная часть люминофоров на основе сульфида кадмия и катализаторов в органическом синтезе.
hg Меркурий или Ртуть
Единственный металл , находящийся при обычной температуре в жидком состоянии (температура плавления ртути -38,8°C ) . Она имеет белый цвет и обладает меньшей восстановительной активностью чем цинк . В ряду напряжений ртуть расположена правее водорода , то есть не вытесняет не вытесняет его из воды и кислот .
Радиус атома ртути почти равен радиусу атому кадмия , а заряд ядра атома значительно больше , поэтому электроны внешнего слоя удерживаются ртутью значительно прочнее .
Природная ртуть состоит из смеси семи изотопов : 196Hg ( распространён 0,155% ) , 198Hg ( 10,04% ) , 199Hg ( 16,94% ) , 200Hg ( 23,14% ) , 201Hg ( 13,17% ) , 202Hg ( 29,74% ) , 204Hg ( 6,82% ) , так же были получены радиоактивные изотопы ртути с массовыми числами 171—210.
Ртуть легко образует с другими металлами сплавы , которые называются амальгамами , например с натрий Na , калий K , серебро Ag , золото Au , платина Pt , цинк Zn , кадмий Cd , олово Sn , свинец Pb образуя с ними жидкие и твердые сплавы.
В недавнем прошлом с помощью ртути получали золото , серебро , а реакции называется амальгамация золота и амальгамация серебра . Также на этой основе лежит покрытие металлических предметов золотом.
Hg химически малоактивна и на воздухе без изменений может хранится длительное время . Однако при длительном слабом нагревании может окислятся , образуя окись ртути :
При растирании в ступке ртуть очень легко взаимодействует с серой , образуя сульфид ртути ( II ) чёрного цвета :
С водой ртуть в реакцию не вступает , но хорошо реагирует с азотной кислотой и концентрированной серной кислотой , обладающие сильными окисляющими действиями . при этом в зависимости от того , при какой температуре ведётся реакция , образуются соли как одновалентные , так и двухвалентной ртути . Соединения как одновалентной , так и двухвалентной ртути достаточно устойчивы , хотя и могут превращаться друг в друга.
Ртуть сильно ядовита , которая даже при комнатной температуре легко испаряется и может вызвать тяжёлые отравления , оказывающие сильное влияние на сердце . При попадании соединений ртути внутрь возникает расстройство деятельности органов пищеварения и почек . Очень ядовиты и соединения ртути , такие как сулема.
Применение ртути
В промышленности применяется она как металл так и некоторые его соли . Металлическую ртуть используют при изготовлении термометров , барометров , в некоторых измерительных приборах , а также при добыче золота для его очистке от примесей , так как ртуть легко образует амальгамы с золотом и другими некоторыми благородными металлами . Так же использовалась в зубоврачебной практике для изготовления пломб.
Применение в медицине в качестве добавления в крема для борьбы со вшами.
Соли ртути также находят некоторое применение такие как сулема HgCl2 используется как дезинфицирующее средство но в последнее время предпочтение другим дез. средствам , каломель Hg2Cl2 ( Cl — Hg — Hg — Cl ) применялось как лёгкое слабительное.
В природе ртуть встречается изредка в самородном жидком состоянии , но в виде соединений , например киновари HgS . Для получения из неё ртути киноварь сначала обжигают :
а затем полученную окись ртути HgO разлагают нагреванием :
Обычно обе реакции протекают одновременно в едином процессе , такими же свойствами обладает оксид серебра при нагревании он восстанавливается до свободного состояния.
Химические свойства ртути
Ртуть при обычных условиях существует в жидком состоянии . Вступает в сплав с другими металлами образуя амальгаму . Жидкая ртуть устойчива на воздухе и в воде , хотя и не покрыта защитной оксидной плёнкой . Эти свойства ртути находятся в соответствии с её высокой ионизационным потенциалом .
Hg , стоящая в ряду напряжений правее водорода , растворяется только в концентрированной азотной и горячей концентрированной серной кислотах , образуя соответствующие соли :
При действии на избыток ртути разбавленной азотной кислоты образуется нитрат ртути ( I ) :
Атомы ртути ( в отличие от цинка и кадмия ) могут связываться друг с другом ковалентной связью , образуя группировку Hg : Hg · . Каждый атом ртути в этом комплексе имеет степень окисления 1+ . Окислители легко повышают степень окисления ртути :
а восстановители переводят Hg⁺ в Hg⁺² и далее в металлическую ртуть ;
Гидроксиды ртути весьма не стабильны и разлагаются уже в ходе реакции :
Нагревание приводит к восстановлению до свободного металла:
Все соединения ртути чрезвычайно ядовиты, а в случае если ртуть была разлита её можно связать (нейтрализовать ) с серой . Поэтому места , где разлита ртуть , посыпают порошком серы или для « демеркурирования » также применяют раствор хлорида железа FeCl3
Статья на тему Ртуть
Похожие страницы:
Понравилась статья поделись ей
Leave a Comment
Для отправки комментария вам необходимо авторизоваться.
📹 Видео
Определение ртути в воде в домашних условияхСкачать

Химия | Молекулярные и ионные уравненияСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

8.Взаимодействие металлов с водойСкачать