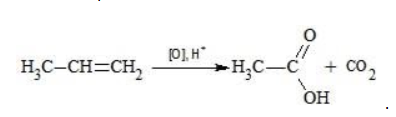
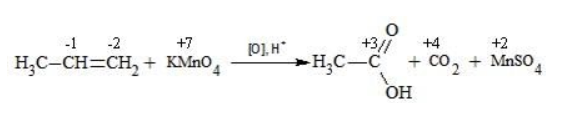
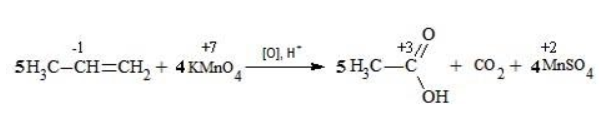
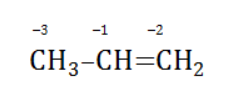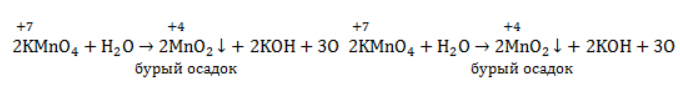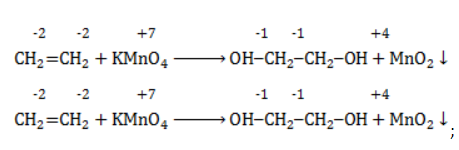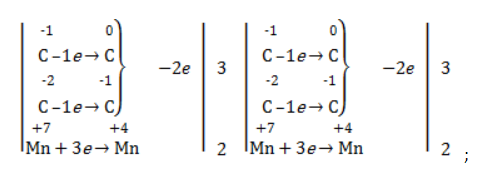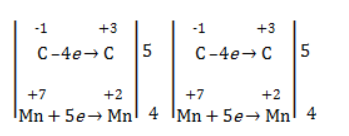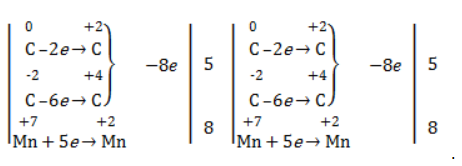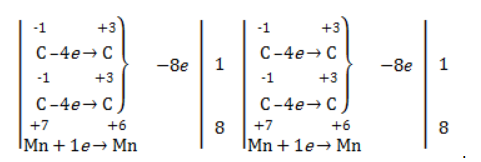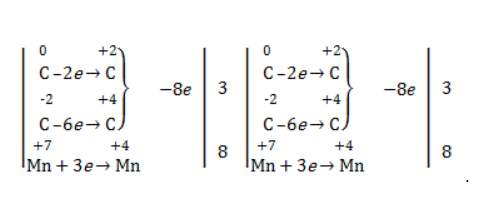Вопрос по химии:
Пишите уравнения реакций окисления бутена-1 и пентена-2: а) избытком кислорода воздуха без катализатора; б) разбавленным водным раствором KMnO4.
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
- Как написать хороший ответ?
- Окисление алкенов перманганатом калия
- Понятие о неполном окислении
- Определение степеней окисления
- Влияние среды на окислитель
- Мягкое окисление
- Жесткое окисление
- Окисление перманганатом калия в кислой среде
- Окисление алкенов в щелочной среде
- Окисление в нейтральном растворе
- Заключение
- 1)написать уравнение реакции окисления бутена-2 перманганатом калия 2)с подмогою каких
- 💥 Видео
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окисление алкенов перманганатом калия
В отличие от предельных углеводородов, алкены характеризуются высокой химической активностью, обусловленной особенностями строения молекулы. При обычных условиях алкены охотно вступают в реакции неполного окисления с превращением в органические соединения других классов. Универсальный реагент в процессах окисления алкенов – перманганат калия.
Видео:Окисление алкенов с Тасей | Химия ЕГЭСкачать

Понятие о неполном окислении
В химии органических соединений под окислением понимается взаимодействие, при котором происходит обеднение реагента водородом или обогащение кислородом, сопровождающееся отдачей электронов молекулой. Обратный процесс называется восстановлением.
Полное окисление происходит при горении углеводородов с разрушением молекулы. Продуктами в этом случае являются углекислый газ и вода. При неполном окислении продуктами становятся различные вещества.
Высокая реакционная способность алкенов обусловливается присутствием в молекуле двойной связи. Один из ее компонентов – слабая 
Определение степеней окисления
Для того чтобы правильно записать уравнение реакции неполного окисления алкена, нужно определить степени окисления атомов до вступления во взаимодействие и после него. Они рассчитываются исходя из электроотрицательности элементов.
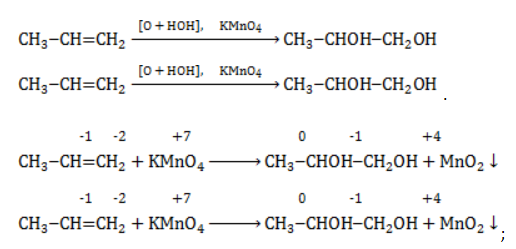
Например, при окислении пропена перманганатом калия 


- В составе группы
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
, отнимая у водородных атомов по одному отрицательному заряду. На связи
сдвига электронов нет. Следовательно, атом углерода приобретает степень окисления -2 -2;
- В группе
аналогичный подсчет показывает для углерода степень окисления -1 -1 (для каждого водорода соответственно +1 +1);
- В радикале
углерод оттягивает на себя отрицательные заряды с трех водородных атомов и имеет степень окисления -3 -3.
В общем виде результат можно записать следующим образом:
Расчет степеней окисления в кислородсодержащих соединениях производится аналогично с учетом большей электроотрицательности кислорода.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Влияние среды на окислитель
Состав раствора (наряду с температурой) определяет, до какого соединения окислится восстановитель – алкен. Окислитель в растворах с различным уровнем кислотности (щелочности) также ведет себя неодинаково.
Неорганическая соль 


В нейтральной и слабощелочной среде марганец приобретает степень окисления +4 +4:
Кислород из перманганат-аниона присоединяется к алкену по месту двойной связи.
Под воздействием серной кислоты марганец восстанавливается до степени окисления +2 +2:
При окислении со щелочью (гидроксид лития достаточно высокой концентрации) марганец восстановится до +6 +6:
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Мягкое окисление
Процесс в нейтральной или слабощелочной среде при обычной температуре представляет собой так называемое мягкое окисление перманганатом калия, или гидроксилирование. В алкене разрывается 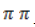
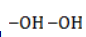
- кислород из перманганат-иона;
- вода.
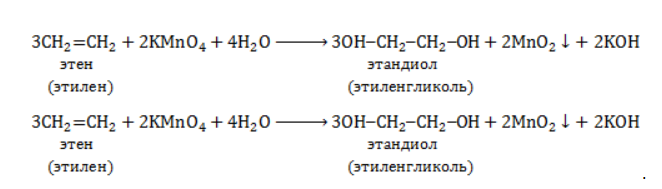
Продукт реакции – диол (двухатомный спирт). Например, окисление этилена перманганатом калия приводит к образованию этиленгликоля:
Для составления полного уравнения нужно:
- определить степени окисления реагентов:
- рассчитать электронный баланс:
- расставить коэффициенты:
- ввести в уравнение недостающие реагенты и продукты, исходя из равенства состава в левой и правой частях уравнения, и определить окончательные коэффициенты:
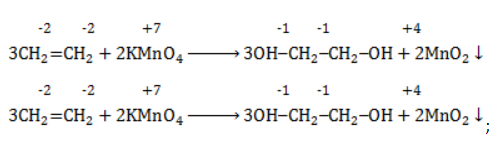
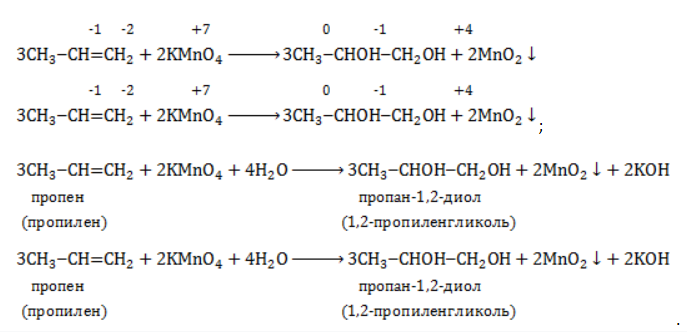
Реакция окисления пропена в нейтральной среде перманганатом калия составляется аналогично:
Дальше мягкое окисление не идет, так как 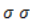
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Жесткое окисление
Жесткими называют процессы окисления, протекающие в нейтральном растворе в условиях повышенной температуры, а также при добавлении кислоты или щелочи. В этих случаях двойная связь в алкене разрушается полностью, а продуктами реакции становятся кетоны, кислоты (с промежуточным окислением до альдегида) либо соли.
Окисление перманганатом калия в кислой среде
Пропен в содержащем кислоту растворе 

Степени окисления участвующих в реакции углеродных атомов и марганца составят:
Электронный баланс определяется только с учетом углерода, вошедшего в состав кислоты:
Сначала расставляются коэффициенты в окислителе, восстановителе и в продуктах окисления:
Затем вписываются недостающие вещества и полностью рассчитываются коэффициенты:
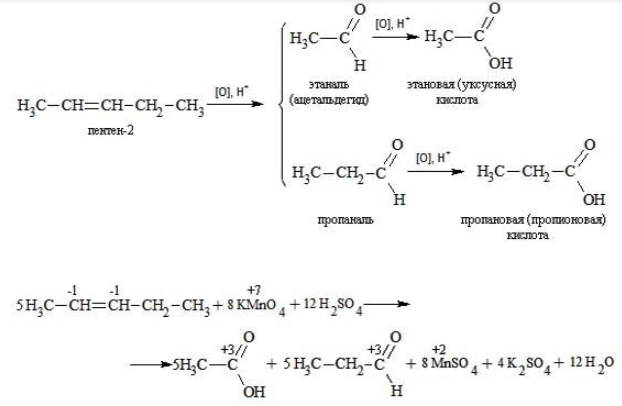
Еще один пример жесткого окисления алкенов перманганатом калия с серной кислотой – реакция с участием пентена-2. Молекула расщепляется по месту двойной связи, и ее фрагменты окисляются через промежуточное образование альдегидов до двух кислот:
Электронный баланс составляется для двух углеродных атомов алкена, поскольку оба они являются восстановителями.
Правило, по которому осуществляется окисление углерода, отражено в таблице:
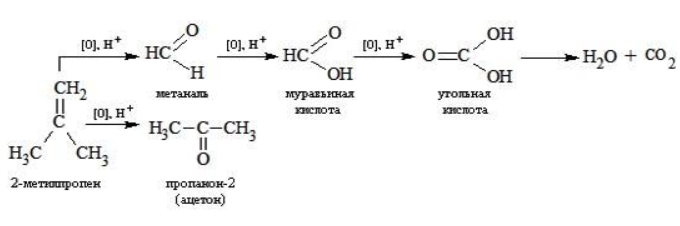
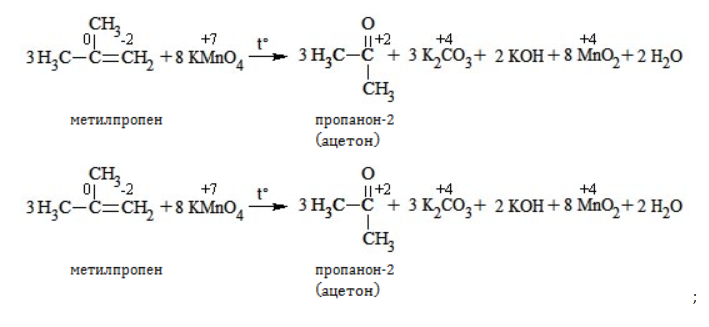
Так, в 2-метилпропене первичный атом окисляется через промежуточные формальдегид (метаналь) и муравьиную кислоту полностью – до углекислого газа, а третичный – только до ацетона:
Окисление алкенов в щелочной среде
При нагревании с концентрированной щелочью алкены окисляются до солей:
Если один из углеродных атомов – первичный, он окисляется до углекислого газа:
Окисление в нейтральном растворе
В условиях высокой температуры образующаяся щелочь вступает в реакцию, в результате которой окисление алкенов продолжается до образования кетонов или солей. Так, при жестком окислении пропена в нейтральной среде получаются те же продукты, что и в присутствии концентрированного гидроксида калия: ацетат 




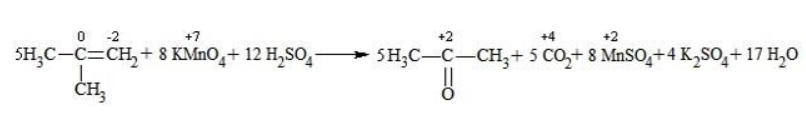
Кетон – результат окисления третичного углеродного атома, и дальнейшую реакцию они не поддерживают. Например, при окислении метилпропена как конечный продукт образуется ацетон:
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Заключение
Взаимодействие с раствором перманганата калия в мягких или жестких условиях является показателем высокой реакционной способности алкенов, которая обусловлена присутствием в молекуле легко разрываемой -связи. Реакции мягкого и жесткого окисления относятся к числу характерных химических свойств алкенов как ненасыщенных углеводородов.
Видео:Составление уравнений реакций. 1 часть. 10 класс.Скачать
1)написать уравнение реакции окисления бутена-2 перманганатом калия 2)с подмогою каких
1)написать уравнение реакции окисления бутена-2 перманганатом калия 2)с помощью каких реактивов можно выполнить превращение бутена-1 в бутен-2 3)получить 4-метилпентен-2 из 4-метилпентена-1 и окислить раствором перманганата
- Kublanova Olesja
- Химия 2019-06-05 11:43:05 0 1
1)
а) При мягеньких условиях в нейтральной либо слабощелочной среде происходит окисление алкена до двухатомного спирта (реакция Вагнера):
OH OH
KMnO/HO
CH — CH = CH — CH —————gt; CH — CH — CH — CH
Полное уравнение:
3 СH + 2 KMnO + 4 HO =
= 3 CH-CHOH-CHOH-CH + 2 MnO + 2 KOH
б) В жестких критериях (кипячение, сильнокислая среда) перманганат разрушает двойную связь с образованием карбоновых кислот либо кетонов в зависимости от характера заместителей при углеродных атомах двойной связи. В нашем случае образуется кислота, при этом в силу симметрии бутена-2, конкретно одна кислота (уксусная), а не две разные:
OH OH
KMnO/H, t
CH — CH = CH — CH ——————gt; CH — C = O + O = C — CH
бутен-2 уксусная кислота (2 молекулы)
Полное уравнение:
5 С H + 8 KMnO + 12 HSO =
= 10 CHCOOH + 8 MnSO + 4 KSO + 12 HO
2)
а) Присоединение галогеноводорода (хлороводорода):
CH = CH — CH — CH + HCl —gt; CH — CHCl — CH — CH
бутен-1 2-хлорбутан
По правилу Марковникова водород приобщается к тому углероду, у которого водорода больше.
б) Отщепление галогеноводорода:
KOH, спирт
CH — CHCl — CH — CH ——————gt; CH — CH = CH — CH
По правилу Зайцева водород отщепляется от того углерода, у которого водорода меньше.
3)
а) присоединение хлороводорода:
HC = CH — CH — CH(CH) + HCl —gt; HС — CHCl — CH — CH(CH)
4-метилпентен-1 2-хлор-4-метилпентан
б) отщепление хлороводорода:
KOH/спирт
HС — CHCl — CH — CH(CH) —————-gt; HС — CH = CH — CH(CH)
в) окисление перманганатом (в мягеньких критериях):
CH OH OH CH
KMnO/HO
HC — CH = CH — CH — CH ——————gt; HС — СH — CH — CH — CH
г) окисление перманганатом в жестких критериях:
CH OH HO CH
KMnO/H, t
HС — СH = CH — CH — CH ——————gt; HС — С=O + O=C — CH — CH
4-метилпентен-2 уксусная изомасляная
кислота кислота
💥 Видео
8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

Составление уравнений реакций. 1 часть. 8 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

8 класс. Составление уравнений химических реакций.Скачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

8 класс. Химия. Как расставить коэффициенты в уравнении?Скачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Составление уравнений окислительно-восстановительных реакций методом электронного балансаСкачать




 углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей
углерод, обладающий большей электроотрицательностью, смещает к себе электронные пары двух связей