Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
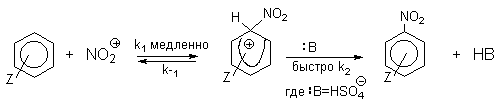
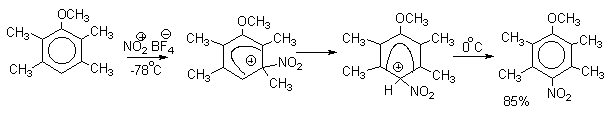
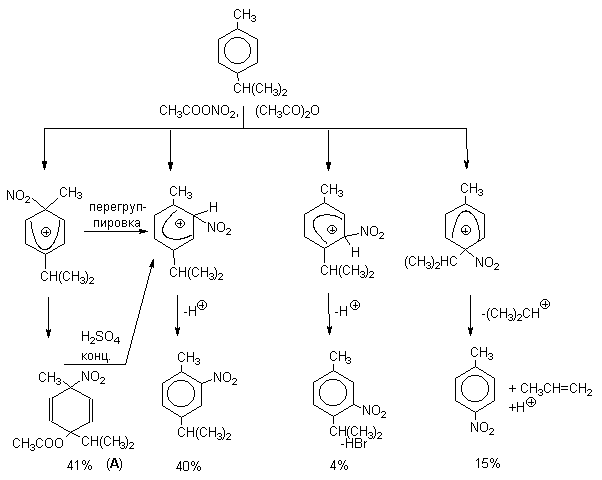
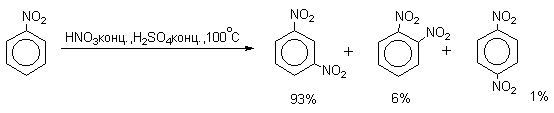
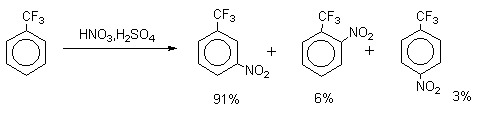
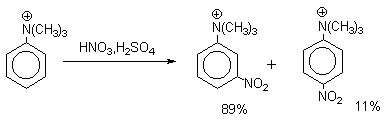
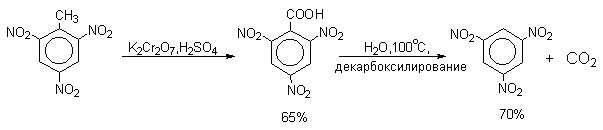
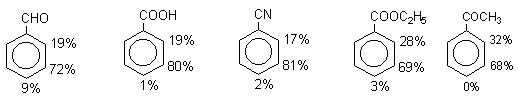
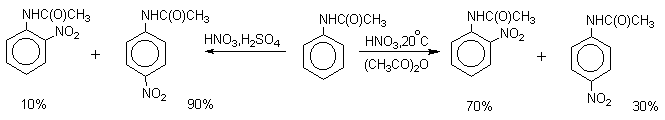
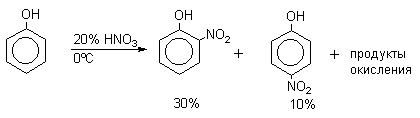
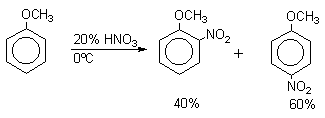
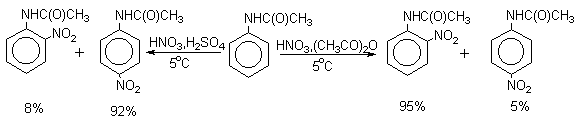
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Нитрование разных производных бензола. Химический опытСкачать  Напишите уравнения реакций нитрования хлорбензола3.Основные реакции электрофильного ароматического замещения Нитрование является механистическим прототипом всех остальных реакций электрофильного ароматического замещения. Эта реакция находит широкое синтетическое применение и механизм ее изучен наиболее подробно. 3.1.1. Природа электрофильного агента Различные арены нитруются в самых разнообразных условиях. Наиболее часто в качестве нитрующего агента используют азотную кислоту в смеси с серной кислотой или азотную кислоту в органических растворителях: уксусной кислоте, нитрометане и т.д. Из других реагентов следует упомянуть соли нитрония (обычно NO2+ BF4- в тетраметиленсульфоне и хлористом метилене) и ацетилнитрат AcONO2 (смешанный ангидрид, образующийся в результате реакции между азотной кислотой и уксусным ангидридом). Незамещенный бензол обычно нитруют смесью концентрированных азотной и серной кислот при 45-50 о С. Этот реагент называется нитрующей смесью. Установлено, что в электрофильном нитровании, независимо от природы нитрующего агента, активным электрофилом является ион нитрония NO2+ . В избытке концентрированной серной кислоты происходит количественное превращение азотной кислоты в гидросульфат нитрония: Доказательства такого равновесия получены с помощью самых разнообразных физико-химических методов: спектров комбинационного рассеяния (полоса NO2+ при 1400 см- 1 ), из кондуктометрических экспериментов, из данных по электролизу (на катоде образуется N2O4), но наиболее убедительные — из криоскопических опытов, которые показали, что каждая молекула HNO3 при растворении в серной кислоте дает четыре частицы. При разбавлении серной кислоты водой концентрация иона NO2+ уменьшается и вместе с этим резко падает и скорость нитрования. Однако очень реакционноспособные арены нитруются даже в таких условиях, когда обнаружить ион NO2+ в растворе какими-либо физическими методами невозможно. Имеются доказательства, что даже в отсутствие серной кислоты нитрование осуществляется ионом нитрония. В таких условиях реакции очень активных аренов имеют нулевой кинетический порядок по ароматическому субстрату (медленная стадия — образование NO2+ без участия ArH). В этих же условиях для менее реакционноспособных аренов кинетический порядок по ArH первый, т.е. лимитирующей скорость стадией становится уже собственно процесс замещения. Подобный эффект наблюдался, например, при нитровании толуола водным раствором азотной и серной кислот. При низкой концентрации H2SO4 порядок по толуолу был нулевым, а при более высокой — первым. В реакциях с HNO3 в нитрометане или уксусной кислоте кинетический порядок также изменяется от нулевого до первого в зависимости от реакционной способности субстрата и условий нитрования. При нулевом порядке по ArH лимитирующей стадией опять-таки является образование иона нитрония: Такие реакции замедляются при добавлении нитрат-ионов, которые по закону действия масс уменьшают концентрацию (H2ONO2)+ и, следовательно, концентрацию NO2+ . Добавки воды тоже замедляют эту реакцию, но в менее заметной степени. Примечательно, что нитрат-ионы не изменяют кинетическое уравнение реакции, а добавки воды приводят к переходу от нулевого к первому порядку. Это связано с тем, что ион нитрония с ArH реагирует медленнее, чем с водой, т.е. обратная реакция k- 2 становится более быстрой, чем реакция k3. Нитрат-ионы никак не могут изменить соотношение скоростей стадий k3 и k- 2 . При использовании в качестве реагента нитрующей смеси (HNO3 + H2SO4) концентрация ионов нитрония в растворе всегда достаточно высока и при избытке реагента постоянна, поэтому нитрование можно рассматривать как двухстадийный процесс. Медленной стадией этого двухстадийного процесса является образование -комплекса. Это доказывается отсутствием кинетического изотопного эффекта водорода при нитровании аренов и дейтероаренов. Однако введение очень объемистых групп с обеих сторон замещающегося водорода может сильно уменьшить скорость стадии k2 и привести к появлению изотопного эффекта. Так, в случае 2,4,6-три-трет-бутилтолуола изотопный эффект значителен: Обобщенный механизм электрофильного замещения предполагает, что можно заместить не только водород, но и другую группу, если электрофильный агент атакует атом углерода, имеющий заместитель. Такие реакции получили название ипсо-замещения. Среди других реакций электрофильного замещения ипсо-замещение чаще всего наблюдалось в реакциях нитрования при несогласованной ориентации двух разветвленных алкильных групп в пара- или орто-положении. Вторичная или третичная алкильная группа отщепляется при этом в виде карбокатиона, который стабилизируется, теряя протон. Типичным примером такого процесса является нитрование 1,4-диизопропилбензола или 1,4-ди-трет-бутилбензола в классических условиях смесью азотной и серной кислот. Известны примеры ипсо-замещения брома и иода, но не хлора или фтора, так как сама нитрогруппа является лучшей уходящей группой по сравнению со фтором или хлором. Следует четко различать ипсо-замещение и ипсо-атаку при электрофильном замещении, поскольку ипсо-атака совсем не обязательно приводит к ипсо-замещению. Рассмотрим это на конкретном примере нитрования 2,3,5,6-тетраметиланизола фторборатом нитрония. При низкой температуре -60 о С в сильнокислой среде образуется ипсо- -комплекс с нитрогруппой в положении 3. При повышении температуры до 0 о С он перегруппировывается в более стабильный «нормальный»- -комплекс с нитрогруппой в положении 4, депротонирование которого дает 2,3,5,6-тетраметил-4-нитроанизол — ожидаемый продукт нитрования. При нитровании пара-цимола (4-изопропилтолуола) фторборатом нитрония получается 85.2% 2-нитро-пара-цимола; 5.3% 3-нитро-пара-цимола и 9.5% 4-нитротолуола — продукта ипсо-замещения изопропильной группы. Аналогичное соотношение продуктов получается при нитровании пара-цимола нитрующей смесью. Однако при нитровании пара-цимола ацетилнитратом в уксусном ангидриде наряду с указанными продуктами в значительном количестве (41%) образуются цис- и транс-изомеры 4-ацетокси-4-изопропил-1-метил-1-нитро-циклогексадиена-2,5 (А), а выход 2-нитро-пара-цимола уменьшается до 40%. Это означает, что ипсо- -комплекс присоединяет ацетат-ион с образованием производного циклогексадиена. Такой способ стабилизации аренониевого иона возможен в нуклеофильной среде (уксусная кислота или уксусный ангидрид), но не в сильнокислой среде. Циклогексадиенилацетат (А) при растворении в серной кислоте превращается в 2-нитро-пара-цимол. Таким образом, не менее половины общего количества 2-нитро-пара-цимола образуется не в результате прямой атаки катиона NO2+ в положение 2, а путем ипсо-атаки в положение 1 с последующей перегруппировкой ипсо- -комплекса в термодинамически более стабильный -комплекс с нитрогруппой в положении 2: Следовательно, самым реакционноспособным положением в молекуле пара-цимола по отношению к электрофильной атаке катионом нитрония оказывается положение I и факторы парциальных скоростей четырех положений пара-цимола относятся как 10:5:1:2,5.Отсюда также следует, что при нитровании 1.4-диалкилбензолов и, возможно, моноалкилбензолов доля орто-нитрозамещенного продукта возрастает также за счет ипсо-атаки по замещенному атому углерода. 3.1.3. Методы синтеза ароматических нитросоединений Для нитрования бензола, толуола, ксилолов и ароматических соединений, содержащих электроноакцепторные заместители, применяют нитрующую смесь, например: 1,3,5-Тринитробензол можно получить нитрованием 1,3-динитробензола в течение многих часов концентрированной азотной кислотой в олеуме, однако выход продукта невелик. Гораздо удобнее получать 1,3,5-тринитробензол из 2,4,6-тринитротолуола (взрывчатое соединение тротил), которое в свою очередь получают нитрованием толуола при 70 о С нитрующей смесью. Следует заметить, что соединения с акцепторными группами, такими как СHO, COOH, COOR, CN, при нитровании нитрующей смесью наряду с обычным мета-изомером дают значительные количества орто-изомера; пара-изомер при этом образуется в малых количествах Хлорбензол при 50-70 о С дает смесь орто- и пара-нитробензола (33-35 и 65-67% соответственно) Нитрующая смесь является довольно сильным окислителем, поэтому ее нельзя использовать для прямого нитрования фенола и анилина, а также их производных с донорными заместителями. НО-Группу в фенолах можно защитить алкилированием (снимается защита действием конц.HI), а NH2-группу в анилинах — ацилированием (снимается защита щелочным или кислотным гидролизом). При этом мы по прежнему имеем сильные ориентанты I-го рода (более сильные, чем алкильные группы), а склонность ароматической системы к окислению резко уменьшается. Соединения ряда бензола, содержащие сильные электронодонорные заместители, можно нитровать азотной кислотой разной концентрации (фенолы и их простые эфиры), азотной кислотой в уксусной кислоте (фенолы), ацетилнитратом (простые эфиры фенолов, ацетанилид). Ацетилнитрат, образующийся при растворении HNO3 в уксусном ангидриде, взрывоопасен, поэтому его обычно не выделяют в индивидуальном виде, а используют его растворы в уксусном ангидриде. Варьируя условия реакций (температуру, нитрующие агенты), можно проводить нитрование региоселективно. Орто-нитрофенол отгоняют с водяным паром из реакционной смеси. После снятия ацетильной защиты получают свободные орто- и пара-анилины. Мета-нитроанилин получают парциальным восстановлением мета-динитробензола сероводородом в водном или спиртовом аммиаке. Ди- и тринитросоединения, содержащие нитрогруппы в орто- или пара-положении друг к другу, или в орто- или пара-положении к электроноакцепторной группе получают окислением амино-группы с помощью реактива Эммонса, представляющего собой раствор пертрифторуксусной кислоты CF3CO3H в хлористом метилене. Нафталин нитруется в более мягких условиях, чем бензол. Видео:Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать  Нитропроизводные хлорбензолаНитропроизводные галогенбензолов имеют большое практическое значение как промежуточные продукты при производстве ВВ, красителей, гербицидов, лекарственных препаратов и т.д. Наибольшее практическое применение имеет динитрохлорбензол, в значительно меньшем объеме производится тринитрохлорбензол (пикрилхлорид). Как отмечалось выше, атом галогена обладает дезактивирующим влиянием на бензольное кольцо, но ориентирует электрофильные реагенты в орто- и пара-положения. Это обусловлено тем, что галоген обладает противоположными по знаку индукционным (-I) и мезомерным (+М) эффектами (стр.24). Так, хлорбензол нитруется в 30 раз медленнее, чем бензол. Мононитрохлорбензол образуется при нитровании хлорбензола серно-азотными кислотными смесями состава 56% H2SO4, 30% HNO3, 14% H2O при 70-80 о С. Пара- и орто-изомеры нитрохлорбензола образуются в соотношении от 73:27 до 65:35 в зависимости от состава нитрующей смеси и температуры. Мета-изомер получается с очень низким выходом (менее 1.5%). Разделение изомеров осуществляют методом фракционной кристаллизации или ректификации. Динитрохлорбензол. При нитровании технического мононитрохлорбензола образуется смесь 2,4-динитрохлорбензола (основной изомер), 2,6-динитрохлорбензола (2-4%) и небольшой примеси 3,4-динитрохлорбензола. 2,4-Динитрохлорбензол получают нитрованием пара-нитрохлорбензола кислотной смесью состава 65% H2SO4, 35% HNO3 в течение 2 час при 45-55 о С с выходом 98.5%. Разделение изомеров можно осуществить дробной кристаллизацией. 2,4-Динитрохлорбензол — реакционноспособное соединение благодаря активации атома хлора в процессах нуклеофильного замещения орто- и пара-нитрогруппами. На этом основано широкое применение 2,4-динитрохлорбензола в синтезе других ВВ ( тетрил, гексил, пикриновая кислота, пикрамид, гексанитродифенил и др.), а также в синтезе гербицидов и красителей. Динитрохлорбензол легко омыляется щелочами, образуя 2,4-динитрофеноляты (схема 13.3.1) Схема 13.3.1 При омылении в присутствии спиртов образуются простые эфиры 2,4-динитрофенола, например, 2,4-динитроанизол. Тринитрохлорбензол (пикрилхлорид) получается нитрованием 2,4-динитрохлобензола безводной кислотной смесью, состоящей из 100%-ной H2SO4 или олеума и 93%-ной HNO3 в течение 12 час при 130 о С с выходом 85% (или при 150 о в течение 3 час). Атом хлора в пикрилхлориде очень подвижен и легко замещается на гидроксил и алкоксил при реакции с основаниями (схема 13.3.2): Схема 13.3.2 В реакции с аммиаком и аминами пикрилхлорид образует пикрамид и его N-алкилпроизводные. 13.4 Нитропроизводные фенола. Гидроксильная группа сильно активирует ароматическое ядро в реакциях электрофильного замещения и обладает орто-пара-ориентирующим действием (стр.23-24). Поэтому нитрование фенола можно осуществлять даже очень слабой азотной кислотой. В этом случае электрофильным реагентом является гораздо менее активный по сравнению с NO2 + нитрозоний-ион, а нитрофенолы образуются в результате последующего окисления нитрозофенолов. Такое нитрование называют каталитическим, т.к. окислы азота, поставляющие необходимый для реакции нитрозоний-ион, выполняют роль катализатора. На практике, однако, предпочитают использовать для нитрования фенолов менее агрессивные по отношению к металлам крепкие кислоты (HNO3 и H2SO4). Чтобы уменьшить потери фенола в побочных окислительных процессах, его предварительно ацилируют по гидроксилу или сульфируют в ядро, что резко снижает электронодонорный характер гидроксильной группы (схема 13.4.1): Схема 13.4.1 Нитрование фенол-2,4-дисульфокислоты представляет собой типичный пример ипсо-нитрования, когда нитроний-ион замещает сульфогруппу (см. схему 13.4.1, а также 10.3.1 на стр. 80). Наличие 2 или даже 3 сульфогрупп в молекуле фенола не подавляет полностью окислительные процессы – более 10% фенола превращается в щавелевую кислоту. Мононитрофенолы, как сказано выше, получают нитрованием фенола разбавленной азотной кислотой, т.к. при использовании кислотных смесей даже средней крепости происходит быстрое экзотермическое окисление и осмоление фенола. Мононитрование дает смесь орто- и пара- нитрофенолов ( 28:71), мета-изомер практически отсутствует. При повышении концентрации азотной кислоты о-: п- отношение уменьшается. о- и п-Нитрофенолы являются слабыми OH-кислотами, способными к образованию солей с основаниями (pKа, соответственно, 7.23 и 7.15). о-Нитрофенол отличается от м- и п-нитрофенолов желтой окраской кристаллов, повышенной летучестью и резким запахом, напоминающим запах горького миндаля. Это объясняется образованием внутримолекулярной водородной связи гидроксильной групппы с кислородным атомом нитрогруппы. Динитрофенолы. При нитровании мононитрофенолов образуются 2,4-( α)- и 2,6-(β )-динитрофенолы. Пара-нитрофенол легко нитруется 54%-ной азотной кислотой до 2,4-динитрофенола, и орто-нитрофенол – значительно труднее, и дает смесь 2,4- и 2,6-динитрофенолов с преобладанием 2,4-изомера. Изомеры можно разделить дистилляцией (2,4-изомер более летуч) или дробной кристаллизацией их бариевых солей из воды. Присутствие второй нитрогруппы в ядре динитрофенолов существенно усиливает их кислотность (pKа 2,4-ДНФ =4.11, pKа 2,6-ДНФ =3.71). Тринитрофенолы.Основной изомер, образующийся при нитровании фенола и его нитропроизводных, представляет собой 2,4,6-тринитрофенол, или пикриновую кислоту. Это сильная ОН-кислота (pKа 0.7), образующая устойчивые к гидролизу соли с металлами и органическими основаниями, называемые пикратами. За его кислотные свойства и горький вкус 2,4,6-тринитрофенол был назван пикриновой кислотой. Вначале пикриновая кислота применялась как желтый краситель для шерсти и шелка, а позднее (вплоть до II мировой войны) стала использоваться как взрывчатое вещество (“мелинит” в России и “шимоза” в Японии). Однако вследствие сильной кислотности тринитрофенол образовывал весьма чувствительные к удару и трению металлические соли с железом, свинцом и медью, что привело к его замене тротилом. Ввиду сложности и опасности прямого нитрования фенола до тринитропроизводного серно-азотными кислотными смесями обычно вначале получают сульфофенолы взаимодействием фенола с концентрированной H2SO4 или олеумом (схема 13.4.2): 2H2SO4 H2SO4 + SO3 Схема 13.4.2 Сульфирующим агентом, скорее всего, является протонированный серный ангидрид (HOSO2 + ) или, возможно, его димер (S2O6), сольватированный серной кислотой. В зависимости от крепости H2SO4 и содержания SO3 в олеуме возможно моно-, ди- и трисульфирование фенола, которое проводится обычно при температуре 110-120 о С. При сульфировании фенола на холоду сульфогруппа вступает в орто-положение, а при 100 о С — в пара-положение. Реакция сульфирования обратима, поэтому орто-фенолсульфокислота при нагревании превращается в пара-фенолсульфокислоту. При нагревании фенола с 10-кратным количеством 20%-ного олеума при 120 О С в течение 3 час образуется смесь ди- и трисульфофенолов. Для получения фенолдисульфокислоты наилучшими условиями являются температура около 100 о С и время сульфирования 30 мин. 2,6-Дисульфофенол при 100-110 о С легко изомеризуется в 2,4-дисульфофенол, который легче нитруется, поэтому в конце сульфирования фенола дают выдержку при 100-110 о С. Сульфофенолы обычно далее нитруют без выделения из реакционной массы. Процесс нитрования сульфофенолов серно-азотными кислотными смесями протекает значительно спокойнее и менее экзотермично, чем прямое нитрование фенола. При действии на фенолсульфокислоту азотной кислоты в избытке конц. H2SO4 происходит замещение в свободные орто-положения кольца (схема 13.4.3): Схема 13.4.3 В присутствии разбавленной H2SO4 за счет реакционной воды на второй стадии нитрования сульфогруппы замещаются нитрогруппами. При этом не требуется кислотооборот. Процесс протекает обычно в гомогенной среде благодаря хорошей растворимости сульфокислот и нитросульфокислот в серной кислоте. В конце процесса из раствора выпадают кристаллы значительно хуже растворимой пикриновой кислоты. Дисульфофенол более устойчив к окислению, чем фенол, но все же при нитровании имеет место частичное окисление, поэтому при введении первой нитрогруппы температура поддерживается не выше 60 о С. Вторая нитрогруппа вводится в более жестких условиях, при температуре 60-80 о С, а третья – при 100 о С. 💡 ВидеоАрены: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  Нитрование алкановСкачать  Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать  Химические свойства бензола и его гомологов. 1 часть. 11 класс.Скачать  6.3. Ароматические углеводороды (бензол и его гомологи): Химические свойства. ЕГЭ по химииСкачать  25. Схема реакции и химическое уравнениеСкачать  Бензол. Строение и свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  Нитрование бензолаСкачать  НИТРОВАНИЕ БЕНЗОЛА, ТОЛУОЛА, БЕНЗОЙНОЙ КИСЛОТЫСкачать  НитрированиеСкачать  Бензол - представитель ароматических углеводородов | Химия 10 класс #19 | ИнфоурокСкачать  Арены. Бензол. Химия 10 класс. Урок 12Скачать  Арены: реакции замещения | Химия ЕГЭ для 10 класса | УмскулСкачать  Бензол и его гомологи | Химические свойства | ПолучениеСкачать  Реакции ионного обмена. 9 класс.Скачать  Арены: реакция замещения | Химия 10 класс | УмскулСкачать  9.3. Фенол: Химические свойстваСкачать  |

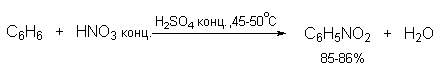
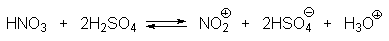
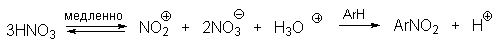
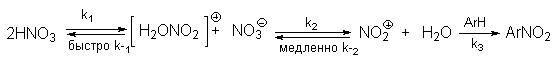
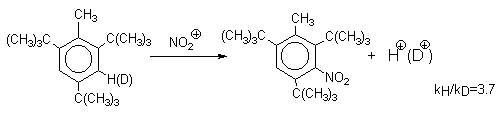
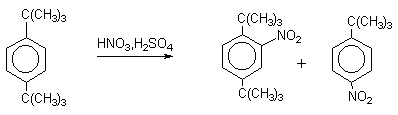
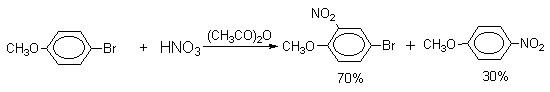
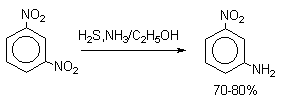
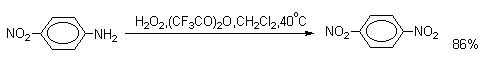
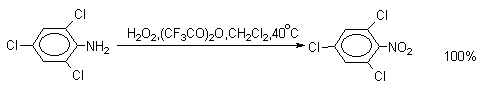
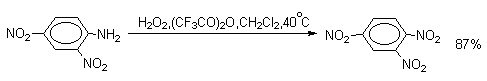


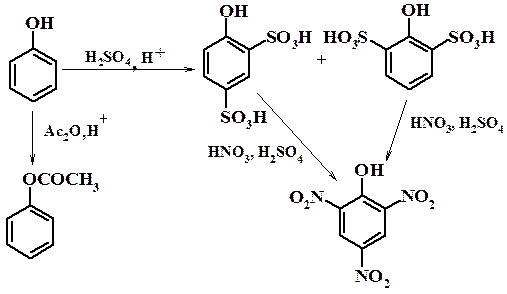
 SO3 + H3O + + HSO4¯; 4H2SO4
SO3 + H3O + + HSO4¯; 4H2SO4 
