Бутанол-1, бутиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение бутанола-1
- Водородные связи и физические свойства спиртов
- Изомерия бутанола-1
- Структурная изомерия
- Химические свойства бутанола-1
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CH2–CH2–CH2–OK + H2O → СН3–CH2–CH2–CH2–OH + KOH
- 2. Реакции замещения группы ОН
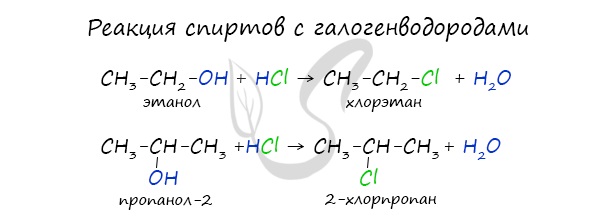
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование спиртов
- Получение бутанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- Acetyl
- Составьте уравнение реакций :1) внутримолекулярная дегидратация пропанола — 22) межмолекулярная дегидратация бутанола — 13) окисление пропанола — 1?
- Написать реакции этерификации, дегидратации, окисление, аммонолиз с бутанол — 2?
- Составьте уравнения реакций между следующими веществами?
- Напишите окисление пропанола — 1 и пропанола — 2?
- В реакцию дегидратации не может вступать :1)метанол2)пропанол — 13)этиленгликоль4)фенол?
- Можете написать дегидратацию пропанола?
- На БУТЕН — 2 подействуйте водой?
- Помогите, пожалуйста?
- Напишите уравнение реакции межмолекулярной дегидратации пропан 1 — ола с этанолом?
- Напишите уравнение реакций межмолекулярной дегидратации :2 — метилпентанол, 1 — метанол?
- Бутанол — 1 введите введите в реакцию внутримолекулярной дегидратации?
- Спирты
Видео:7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать

Строение бутанола-1
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому бутанол-1 – жидкость с относительно высокой температурой кипения.
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому спирты очень хорошо растворимы в воде. Молекулы спиртов в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Бутанол-1 смешивается с водой в любых соотношениях.
Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать

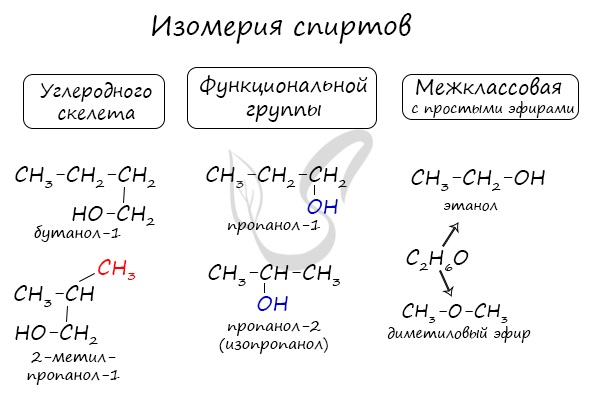
Изомерия бутанола-1
Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать

Структурная изомерия
Для бутанола-1 характерна структурная изомерия – изомерия положения гидроксильной группы, изомерия углеродного скелета и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С4Н10О бутиловый спирт СН3–CH2–CH2–CH2–OH, метилпропиловый эфир CH3–O–CH2–CH2–CH3, метилизопропиловый эфир CH3–O–CH(CH3)2, диэтиловый эфир CH3–CH2–O–CH2–CH3 |
| Бутиловый спирт | Метилпропиловый эфир |
| СН3–CH2–CH2–CH2–OH | CH3–O–CH2–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Бутанол-1 и бутанол-2 |
| Бутанол-1 | Бутанол-2 |
| СН3–CH2–CH2–CH2–OH | СН3–CH(OH) –CH 2 –CH 3 |
Изомеры углеродного скелета отличаются положением строением углеродного скелета. Такая изомерия характерна для спиртов, которые содержат 4 или больше атомов углерода.
| Например. Бутанол-1 и изобутанол-2 |
| Бутанол-1 | Изобутанол |
| СН3–CH2–CH2–CH2–OH | СН3–CH(CH3) –CH 2 –OH |
Видео:Все химические свойства спиртов | Химия ЕГЭ для 10 класса | УмскулСкачать

Химические свойства бутанола-1
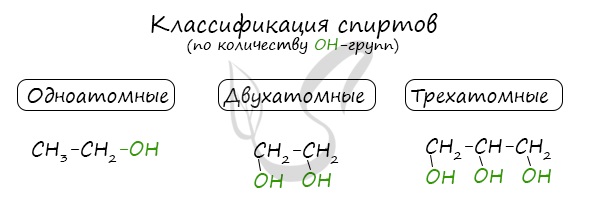
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства бутанола-1
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому бутанол-1 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Бутанол-1 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, бутанол-1 взаимодействует с калием с образованием бутилата калия и водорода . |
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, бутилат калия разлагается водой: |
СН3–CH2–CH2–CH2–OK + H2O → СН3–CH2–CH2–CH2–OH + KOH
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, бутанол-1 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии бутанола-1 с аммиаком образуется бутиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, бутанол-1 реагирует с уксусной кислотой с образованием бутилацетата (бутилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии бутанола-1 с азотной кислотой образуется бутилнитрат. |
Видео:Вся теория по спиртам для ЕГЭ | Химия ЕГЭ для 10 класса | УмскулСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из бутанола-1 под действием концентрированной серной кислоты при высокой температуре образуется бутен-1: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации бутанола-1 при низкой температуре образуется дибутиловый эфир: |
Видео:Урок 83. Межмолекулярные взаимодействия.Скачать
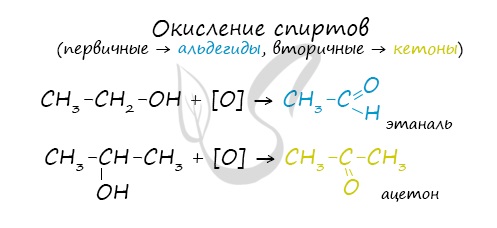
4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Первичные спирты окисляются до альдегидов.
| Например, бутанол-1 окисляется оксидом меди до бутаналя. |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Первичные спирты окисляются до альдегидов.
| Например, при окислении бутанола-1 образуется бутаналь |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) первичные спирты окисляются до карбоновых кислот.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии бутанола-1 с перманганатом калия в серной кислоте образуется бутановая кислота |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания бутанола-1: |
Видео:Альдегиды и кетоны: цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать

5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании бутанола-1 образуется бутаналь. |
Видео:Все химические свойства спиртов за 45 минут | Химия 10 класс | УмскулСкачать

Получение бутанола-1
Видео:Все 32 и 33 задания с 0 и до уровня ЕГЭ по химии на кислородсодержащие соединенияСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 1-хлорбутана с водным раствором гидроксида натрия образуется бутанол-1 |
Видео:Все задания №32 из сборника ЕГЭ 2023 (часть 2) | Химия ЕГЭ для 10 класса | УмскулСкачать

2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты.
Видео:Органическая химия. СпиртыСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
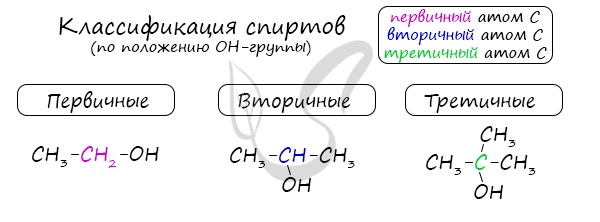
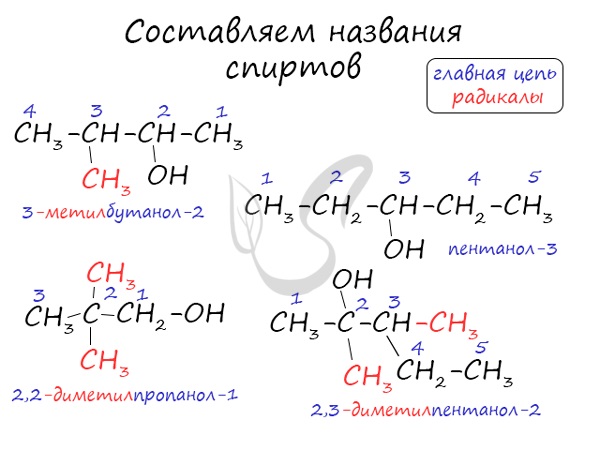
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Тема 9. Межмолекулярное взаимодействие и водородная связьСкачать  Составьте уравнение реакций :1) внутримолекулярная дегидратация пропанола — 22) межмолекулярная дегидратация бутанола — 13) окисление пропанола — 1?Химия | 10 — 11 классы Составьте уравнение реакций : 1) внутримолекулярная дегидратация пропанола — 2 2) межмолекулярная дегидратация бутанола — 1 3) окисление пропанола — 1. Если что — то непонятно — спрашивай. Видео:Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать  Написать реакции этерификации, дегидратации, окисление, аммонолиз с бутанол — 2?Написать реакции этерификации, дегидратации, окисление, аммонолиз с бутанол — 2. Видео:117. Реакция диспропорционирования (дисмутации).Скачать  Составьте уравнения реакций между следующими веществами?Составьте уравнения реакций между следующими веществами. полученные органические вещества. 1) Пропанол — 1 и бромоводород 2) Бутанол — 2 и натрий 3) Пропанол — 2 и кислород. Видео:Задание 32. ЕГЭ 2022 по химии (ЕГЭ 2018. Демо. Задание 33. Цепочка превращений органических веществ)Скачать  Напишите окисление пропанола — 1 и пропанола — 2?Напишите окисление пропанола — 1 и пропанола — 2. Видео:Спирты. Ч.5-2. Химические свойства. Реакции по С-О связи в предельных одноатомных спиртах.Скачать  В реакцию дегидратации не может вступать :1)метанол2)пропанол — 13)этиленгликоль4)фенол?В реакцию дегидратации не может вступать : Видео:Расстановка коэффициентов методом электронного баланса | Химия TutorOnlineСкачать  Можете написать дегидратацию пропанола?Можете написать дегидратацию пропанола. Видео:Решаем 1 вариант из сборника Добротина 2021 | ЕГЭ по химииСкачать  На БУТЕН — 2 подействуйте водой?На БУТЕН — 2 подействуйте водой. Полученное соединение введите в реакцию внутримолекулярной дегидратации! Видео:Разбор всех типов 26-28 задач из сборника Добротина 2023 | Екатерина СтрогановаСкачать  Помогите, пожалуйста?Написать уравнения возможных реакций, дать им названия : 1) гидрирование пропана ; 2) гидрирование бутена ; 3) дегидрирование этана ; 4) изомеризация бутана ; 5) полимеризация этена ; 6) дегидратация пропанола (C3H7OH) 7) дегидратация пропена. Напишите уравнение реакции межмолекулярной дегидратации пропан 1 — ола с этанолом?Напишите уравнение реакции межмолекулярной дегидратации пропан 1 — ола с этанолом. Напишите уравнение реакций межмолекулярной дегидратации :2 — метилпентанол, 1 — метанол?Напишите уравнение реакций межмолекулярной дегидратации : 2 — метилпентанол, 1 — метанол. Бутанол — 1 введите введите в реакцию внутримолекулярной дегидратации?Бутанол — 1 введите введите в реакцию внутримолекулярной дегидратации. На полученное соединение подействуйте водой (среда кислая). Продукт реакции назовите. Конечный продукт введите в реакцию межмолекулярной дегидратации? На этой странице находится вопрос Составьте уравнение реакций :1) внутримолекулярная дегидратация пропанола — 22) межмолекулярная дегидратация бутанола — 13) окисление пропанола — 1?. Здесь же – ответы на него, и похожие вопросы в категории Химия, которые можно найти с помощью простой в использовании поисковой системы. Уровень сложности вопроса соответствует уровню подготовки учащихся 10 — 11 классов. В комментариях, оставленных ниже, ознакомьтесь с вариантами ответов посетителей страницы. С ними можно обсудить тему вопроса в режиме on-line. Если ни один из предложенных ответов не устраивает, сформулируйте новый вопрос в поисковой строке, расположенной вверху, и нажмите кнопку. 3)F , электронная конфигурация ласт. Уровня есть таблице менделева над название элемента. Ответ : 3) F Электронная формула фтора : 1s ^ 2 2s ^ 2 2p ^ 5 Внешний энергетический уровень — второй 2s ^ 22p ^ 5. Простое вещество — это химическое соединение, образованное атомами одного химического элемента. Например : кислород О2, водород Н2, озон О3. Сложное вещество — это химическое соединение, образованное атомами разных химических элементов. Например, .. Mр — ра = 100 г p = 1, 26 г / мл Cm = 4, 5 M = 4, 5 моль / л Cm = n / V = > n = Cm * V V = m / p = 100 / 1, 26 = 79, 4 мл = 0, 0794 л n = 4, 5 * 0, 0794 = 0, 3573 моль M(H2SO4) = 98 г / моль m = n * M = 0, 3573 * 98 = 35, 0154 г Я думаю так, ну или х.. СпиртыСпирты — кислородсодержащие органические соединения, функциональной группой которых является гидроксогруппа (OH) у насыщенного атома углерода. Спирты также называют алкоголи. Первый член гомологического ряда — метанол — CH3OH. Общая формула их гомологического ряда — CnH2n+1OH. Классификация спиртовПо числу OH групп спирты бывают одноатомными (1 группа OH), двухатомными (2 группы OH — гликоли), трехатомными (3 группы OH — глицерины) и т.д. Одноатомные спирты также подразделяются в зависимости от положения OH-группы: первичные (OH-группа у первичного атома углерода), вторичные (OH-группа у вторичного атома углерода) и третичные (OH-группа у третичного атома углерода). Номенклатура и изомерия спиртовНазвания спиртов формируются путем добавления суффикса «ол» к названию алкана с соответствующим числом атомов углерода: метанол, этанол, пропанол, бутанол, пентанол и т.д. Для спиртов характерна изомерия углеродного скелета (начиная с бутанола), положения функциональной группы и межклассовая изомерия с простыми эфирами, которых мы также коснемся в данной статье. Получение спиртов
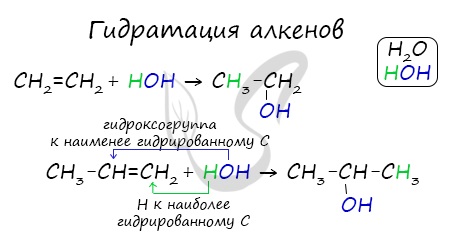
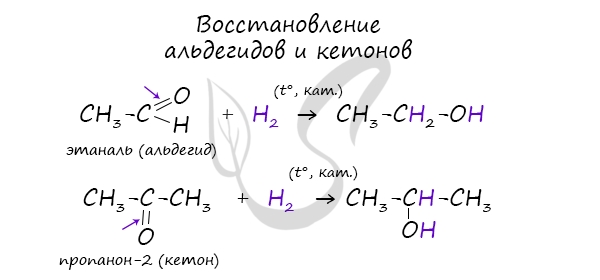
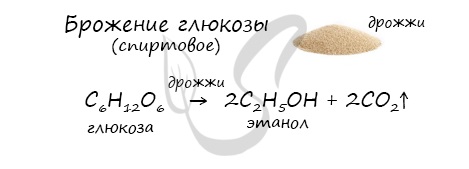
Помните, что в реакциях галогеналканов со сПИртовым раствором щелочи получаются Пи-связи (π-связи) — алкены, а в реакциях с водным раствором щелочи образуются спирты. Присоединения молекулы воды (HOH) протекает по правилу Марковникова. Атом водорода направляется к наиболее гидрированному атому углерода, а гидроксогруппа идет к соседнему, наименее гидрированному, атому углерода. В результате восстановления альдегидов и кетонов получаются соответственно первичные и вторичные спирты. Синтез газом в промышленности называют смесь угарного газа и водорода, которая используется для синтеза различных химических соединений, в том числе и метанола. Получение этанола брожением глюкозы В ходе брожения глюкозы выделяется углекислый газ и образуется этанол. В результате такой реакции у атомов углерода, прилежащих к двойной связи, формируются гидроксогруппы — образуется двухатомный спирт (гликоль). Химические свойства спиртовПредельные спирты (не содержащие двойных и тройных связей) не вступают в реакции присоединения, это насыщенные кислородсодержащие соединения. У спиртов проявляются новые свойства, которых мы раньше не касались в органической химии — кислотные. Щелочные металлы (Li, Na, K) способны вытеснять водород из спиртов с образованием солей: метилатов, этилатов, пропилатов и т.д. Необходимо особо заметить, что реакция с щелочами (NaOH, KOH, LiOH) для предельных одноатомных спиртов невозможна, так как образующиеся алкоголяты (соли спиртов) сразу же подвергаются гидролизу. Реакция с галогеноводородами Реакция с галогеноводородами протекают как реакции обмена: атом галогена замещает гидроксогруппу, образуется молекула воды. В результате реакций спиртов с кислотами образуются различные эфиры. Дегидратация спиртов (отщепление воды) идет при повышенной температуре в присутствии серной кислоты (водоотнимающего) компонента. Возможен межмолекулярный механизм дегидратации (при t 140°С) механизм дегидратации становится внутримолекулярный — образуются алкены. Названия простых эфиров формируются проще простого — по названию радикалов, входящих в состав эфира. Например:
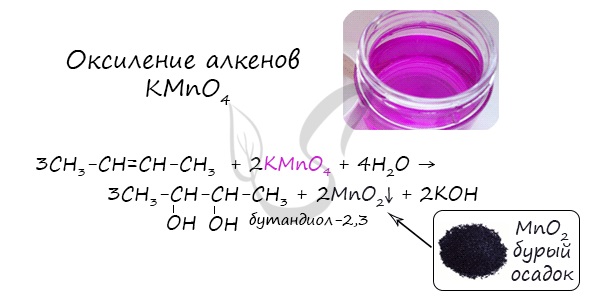
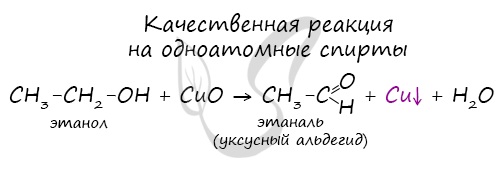
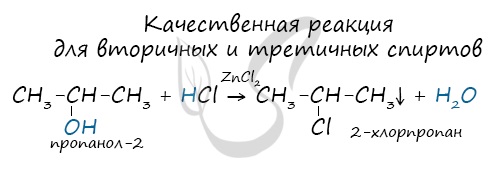
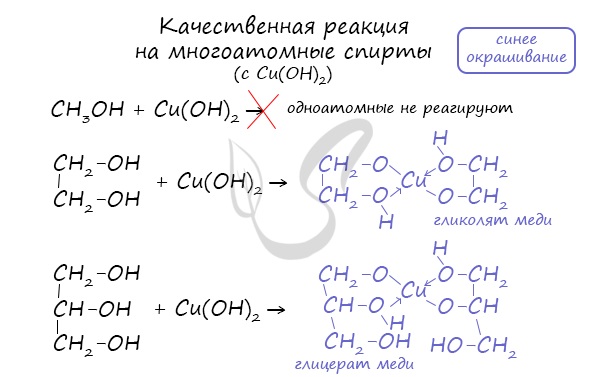
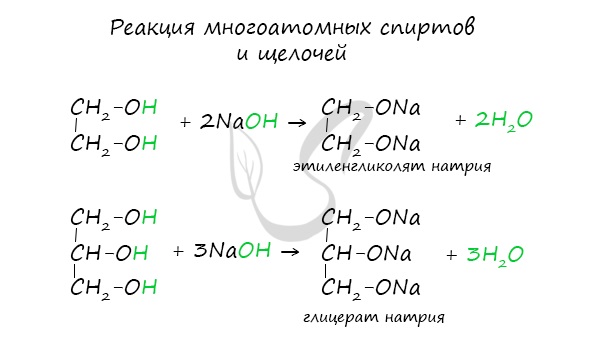
Качественной реакцией на спирты является взаимодействие с оксидом меди II. В ходе такой реакции раствор приобретает характерное фиолетовое окрашивание. Замечу, что в обычных условиях третичные спирты окислению не подвергаются. Для них необходимы очень жесткие условия, при которых углеродный скелет подвергается деструкции. Вторичные и третичные спирты определяются другой качественной реакцией с хлоридом цинка II и соляной кислотой. В результате такой реакции выпадает маслянистый осадок. Первичные спирты окисляются до альдегидов, а вторичные — до кетонов. Альдегиды могут быть окислены далее — до карбоновых кислот, в отличие от кетонов, которые являются «тупиковой ветвью развития» и могут только снова стать вторичными спиртами. Такой реакцией является взаимодействие многоатомного спирта со свежеприготовленным гидроксидом меди II. В результате реакции раствор окрашивается в характерный синий цвет. Важным отличием многоатомных спиртов от одноатомных является их способность реагировать со щелочами (что невозможно для одноатомных спиртов). Это говорит об их более выраженных кислотных свойствах. © Беллевич Юрий Сергеевич 2018-2022 Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию. |