Просмотр содержимого документа
«Образование и разрушение гидроксокомплексов»

Учитель сош № 21: Сукнева Л.Е .
- При подготовке к ЕГЭ по химии задания уровня С выходят далеко за рамки двухчасовой школьной программы, например составление уравнений окислительно-восстановительных реакций или уравнений реакций по разрушению комплексных солей. Найти ответы на некоторые вопросы порой не удается ни в одном учебнике или пособии .
- Одно из заданий высокого уровня сложности ( уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания. Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
- Одно из заданий высокого уровня сложности ( уровня С) проверяет знания об амфотерных свойствах веществ. Для успешного выполнения этого задания нужно знать в том числе и способы разрушения комплексных солей. В учебной литературе этому вопросу уделяется мало внимания. Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
- Амфотерные свойства имеют оксиды и гидроксиды многих металлов. Они не растворяются в воде, но растворяются в кислотах и щелочах.При подготовке к ЕГЭ нужно усвоить материал о свойствах соединений алюминия, цинка, бериллия, железа и хрома.
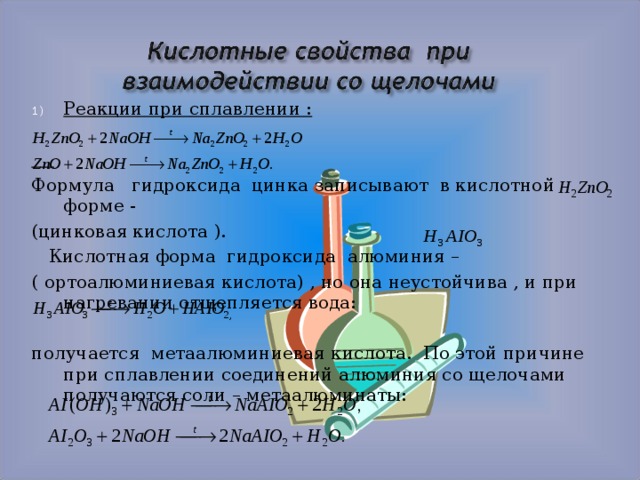
- Реакции при сплавлении :
Формула гидроксида цинка записывают в кислотной форме —
Кислотная форма гидроксида алюминия –
( ортоалюминиевая кислота) , но она неустойчива , и при нагревании отщепляется вода:
получается метаалюминиевая кислота. По этой причине при сплавлении соединений алюминия со щелочами получаются соли – метаалюминаты:
Следует отметить , что при взаимодействии соединений алюминия со щелочами ( рН = 14) в растворе получаются разные формы комплексных солей ( к.ч.(А I ) =6)
т.е. гексагидроксоалюминат натрия
и тетрагидроксодиакваалюминат натрия.
Соединения бериллия ( ВеО и Ве(ОН) 2 ) взаимодействуют со щелочами аналогично соединениям цинка, соединения хрома ( III) и железа ( III) ( Cr 2 O 3 , Cr(OH) 3 , Fe 2 O 3 , Fe(OH) 3 ) — аналогично соединениям алюминия, но оксиды этих металлов взаимодействуют только при сплавлении.
Cr 2 O 3 + 2Na OH = 2NaCrO 2 +H 2 O
метахромит натрия ( хромат( III) натрия)
Fe 2 O 3 +2NaOH =2NaFeO 2 +H 2 O .
феррит натрия (ферр а т ( III) натрия)
При взаимодействии гидроксидов этих металлов со щелочами в растворе образуются комплексные соли с координационным числом 6.
Гидроксид хрома ( III) легко растворяется в щелочах:
Гидроксид железа ( III) имеет очень слабые амфотерные свойства взаимодействует только с горячими концентрированными растворами щелочей:
Железо и хром с растворами щелочей не реагируют , образование солей возможно только при сплавлении с твердыми щелочами.
1) При действии избытка сильной кислоты получаются две средних соли и вода:
2) При действии сильной кислоты ( в недостатке ) получаются средняя соль активного металла , амфотерный гидроксид и вода:
3) При действии слабой кислоты получается кислая соль активного металла , амфотерный гидроксид и вода:
4) При действии углекислого или сернистого газа получается кислая соль активного металла и амфотерный гидроксид:
5)При действии солей , образованных сильными кислотами и катионами , происходит взаимное усиление гидролиза получаются два амфотерных гидроксида и соль активного металла:
6)При нагревании гидроксокомплексов щелочных металлов выделяется вода:
1)Составьте уравнения четырех возможных реакций между растворами следующих соединений: гексагидроксохромат (III) калия, хлорид алюминия , сероводород , соляная кислота.
3) Напишите уравнения четырех возможных реакций между растворами гексагидроксоалюмината калия, карбоната калия, угольной кислоты, хлорида хрома( III) .

Применение таблиц-схем и моделей на уроках химии
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Напишите уравнения реакций между хлоридом алюминия и гексагидроксохромат калия
Даны водные растворы: гексагидроксоалюмината калия , хлорида алюминия, сероводорода и гидроксида рубидия.
Напишите уравнения четырёх возможных реакций между всеми предложенными веществами, не повторяя пары реагентов.
Написаны четыре уравнения возможных реакций между указанными веществами:
Видео:Химия | Молекулярные и ионные уравненияСкачать

Задачи 30, 31 ЕГЭ по химии-2020
Задачи 30 и 31 из реального ЕГЭ по химии-2020, все задачи на окислительно-восстановительные реакции из реального экзамена ЕГЭ по химии, задания 30 и 31 из реального ЕГЭ 2020 (основная волна и резервные дни — 16 июля 2020 года, 24 июля 2020) с текстовыми решениями и ответами.
| Выдержка из формулировки каждого варианта 30 задания: «В ответе запишите уравнение только одной из возможных окислительно-восстановительных реакций с участием выбранных веществ. Составьте электронный баланс, укажите окислитель и восстановитель.» Выдержка из формулировки каждого варианта 31 задания: «Запишите молекулярное, полное и сокращённое ионное уравнения реакции с участием выбранных веществ.» Ниже приведены перечни веществ, а также дополнительные условия, которые были указаны в соответствующем варианте 30 и 31 задания. 1) Если вещество растворимо в воде, то допустимо использование водного раствора этого вещества. 2) Если концентрация кислоты указана, то следует использовать кислоту указанной концентрации. 3) Если концентрация кислоты не указана, то можно использовать и разваленную и концентрированную кислоту. |
1. Нитрат бария, сульфид калия, соляная кислота, нитрит натрия, перманганат калия, ацетат железа(II).
📹 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Взаимодействие хлорида железа III с роданидом калияСкачать

Решение цепочек превращений по химииСкачать

Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

8 класс. Составление уравнений химических реакций.Скачать

ПОЛУЧЕНИЕ AlCl3 | ГИДРОКСИД АЛЮМИНИЯ И ЕГО РАСТВОРЕНИЕСкачать

ОКСИДЫ ХИМИЯ — Что такое Оксиды? Химические свойства Оксидов | Реакция ОксидовСкачать

хлорид алюминия и гидроксид натрияСкачать

8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Равновесие в растворе роданида железаСкачать

Качественная реакция на хлорид, бромид, йодид ион.Скачать

Все ОВР с перманганатом для ЕГЭ 2023 | Интенсив | Екатерина Строганова | 100балльныйСкачать

Это Самый Простой Урок Химии. Химия с нуля — АмфотерностьСкачать

Качественные реакции на хлорид-, бромид- и йодид-ионыСкачать

Качественная реакция на ион трехвалентного железаСкачать

Получение хлорида калия (synthesis of potassium chloride) KClСкачать