
задача №1
к главе «Глава 5. Органические вещества. § 35(36). Спирты».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
- Химия практическая. колледж практ работы химия № 1. Лабораторная работа 1 Моделирование построения Периодической таблицы химических элементов 8
- Лабораторная работа № 8.
- 3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.
- Химические свойства спиртов
- Одноатомные спирты
- Реакции замещения
- Замещение атома водорода в гидроксильной группе
- Замещение гидроксильной группы
- Реакции элиминирования (отщепления)
- Дегидратация
- Дегидрирование спиртов
- Реакции окисления
- Горение
- Неполное окисление
- ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫ
- Замещение атомов водорода гидроксильных групп
- Замещение гидроксильных групп
- Химические свойства фенолов
- Реакции с участием гидроксильной группы
- Кислотные свойства
- Реакции замещения в ароматическом ядре
- Галогенирование
- Нитрование
- Реакции присоединения
- 📹 Видео
Видео:Уравнивание реакций горения углеводородовСкачать

Химия практическая. колледж практ работы химия № 1. Лабораторная работа 1 Моделирование построения Периодической таблицы химических элементов 8
| Название | Лабораторная работа 1 Моделирование построения Периодической таблицы химических элементов 8 |
| Анкор | Химия практическая |
| Дата | 17.11.2020 |
| Размер | 336.63 Kb. |
| Формат файла |  |
| Имя файла | колледж практ работы химия № 1.docx |
| Тип | Лабораторная работа #151406 |
| страница | 8 из 10 |
| Подборка по базе: (ЛамПанель)Практическая работа №4.docx, Лабораторная работа по схемотехнике СУ.pdf, Практическая работа 1 курсы.odt, Практическая работа № 1.docx, (ЛамПанель)Практическая работа №1.docx, Практическая работа №5.doc, 8 класс химия Контрольная работа по теме.docx, Хорькова Н. Н. 2 к. исправленная работа.docx, Практическая работа № 3. Проанализируйте содержание и методическ, Курсовая работа 3 экипаж.docx Видео:Спирты: химические свойства | Химия ЕГЭ для 10 класса | УмскулСкачать  Лабораторная работа № 8.Цель:Изучить свойства одноатомных и многоатомных спиртов на примере этанола и глицерина; свойствах альдегидов на примере формальдегида. Оборудование:Видеоурок с демонстрацией опытов, периодическая система химических элементов Д.И.Менделеева. Спирты- это соединения, содержащие одну или несколько гидроксильных групп (-ОН). Спирты, у которых гидроксильная группа связана с ароматическим кольцом, называются фенолами. Спирты, содержащие несколько групп —ОН, называют многоатомные спирты. 2) Спирты взаимодействуют с галогеноводородами и галогеноводородными кислотами: 3) Окисление в более мягких условиях (неполное окисление) приводит к образованию карбонильных соединений – альдегидов или кетонов: 4) Реакции фенола по бензольному кольцу: Альдегиды – это органические вещества, содержащие так называемую альдегидную группу Химические свойства альдегидов и кетонов. 1.Aльдегиды легко окисляются до соответствующих карбоновых кислот. 2.Качественная реакция на альдегиды С аммиачным раствором оксида серебра <реакция серебряного зеркала). R-CH=O + Ag2O NH3 → R-COOH + 2 Ag↓ 1.Изобразите структурны формулы всех спиртов молекулярная форма которых С5Н9ОН, подпишите их названия. 2. Составьте уравнение реакции окисления 1‑пропанола и 2‑пропанола. В чем сходство и отличие молекул полученных веществ. 3. Охарактеризуйте физические свойства предельных спиртов. Какое их физиологическое действие на живые организмы. 4. Изобразите структурные формулы всех альдегидов молекулярная формула которых С5Н10О., подпишите их названия. 5. С помощью какой реакции можно доказать, что в растворе находится альдегид? Поджигаем метанол, этанол, амиловый (пентиловый) спирты. Опишите наблюдения. Запишите уравнения реакций. Небольшие кусочки натрия помещаем в чаши с бутанолом, этанолом и с водой. В пробирку с глицерином при комнатной температуре бросаем кусочек натрия. Вторую пробирку с глицерином и кусочком натрия подогреваем. К раствору сульфата меди приливаем NaOH. К образовавшемуся Cu (OH)2 приливаем глицерин, перемешиваем. Запишите уравнение реакции и свои наблюдения: Возьмите медную проволоку и разогрейте ее в пламени спиртовки. Опустите медную проволоку в пробирку с С2 Н5 ОН. Запишите уравнение реакции. Прилейте бутиловый спирт СН3 -СН2-СН2 – СН2 ОН к раствору КМnО4.Перемешайте. Запишите уравнение реакции и свои наблюдения: а) Получение фенолята натрия. В пробирку с фенолом прилейте NaОН. ОПЫТ № 8. Взаимодействие фенола с бромной водой. Прилить водный раствор фенола к бромной воде. Получите осадок Cu (OH)2 из раствора меди и раствора гидроксида натрия NaOH. К осадку прилейте формальдегид и содержимое пробирки нагрейте. При нагревании формальдегида с аммиачным раствором оксида серебра (в воде оксид серебра нерастворим) происходит окисление формальдегида в муравьиную кислоту НСООН и восстановление серебра. Видео:Составление уравнений реакций горения. 11 класс.Скачать  3.5. Характерные химические свойства предельных одноатомных и многоатомных спиртов, фенола.В зависимости от типа углеводородного радикала, а также в некоторых случаях особенностей прикрепления группы -ОН к этому углеводородному радикалу соединения с гидроксильной функциональной группой разделяют на спирты и фенолы. Спиртами называют соединения, в которых гидроксильная группа соединена с углеводородным радикалом, но не присоединена непосредственно к ароматическому ядру, если таковой имеется в структуре радикала. Если в структуре углеводородного радикала содержится ароматическое ядро и гидроксильная группа, при том соединена непосредственно с ароматическим ядром, такие соединения называют фенолами. Почему же фенолы выделяют в отдельный от спиртов класс? Ведь, например, формулы очень похожи и создают впечатление веществ одного класса органических соединений. Однако непосредственное соединение гидроксильной группы с ароматическим ядром существенно влияет на свойства соединения, поскольку сопряженная система π-связей ароматического ядра сопряжена также и с одной из неподеленных электронных пар атома кислорода. Из-за этого в фенолах связь О-Н более полярна по сравнению со спиртами, что существенно повышает подвижность атома водорода в гидроксильной группе. Другими словами, у фенолов значительно ярче, чем у спиртов выражены кислотные свойства. Видео:ВСЕ ПРО АЛКАНЫ за 8 минут: Химические Свойства и ПолучениеСкачать  Химические свойства спиртовОдноатомные спиртыРеакции замещенияЗамещение атома водорода в гидроксильной группе1) Спирты реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от защитной пленки Al2O3), при этом образуются алкоголяты металлов и выделяется водород: Образование алкоголятов возможно только при использовании спиртов, не содержащих растворенной в них воды, так как в присутствии воды алкоголяты легко гидролизуются: 2) Реакция этерификации Реакцией этерификации называют взаимодействие спиртов с органическими и кислородсодержащими неорганическими кислотами, приводящее к образованию сложных эфиров. Такого типа реакции являются обратимыми, поэтому для смещения равновесия в сторону образования сложного эфира, реакцию желательно проводить при нагревании, а также в присутствии концентрированной серной кислоты как водоотнимающего агента: Замещение гидроксильной группы1) При действии на спирты галогеноводородных кислот происходит замещение гидроксильной группы на атом галогена. В результате такой реакции образуются галогеналканы и вода: 2) При пропускании смеси паров спирта с аммиаком через нагретые оксиды некоторых металлов (чаще всего Al2O3) могут быть получены первичные, вторичные или третичные амины: Тип амина (первичный, вторичный, третичный) будет в некоторой степени зависеть от соотношения исходного спирта и аммиака. Видео:7.1. Спирты: Номенклатура, классификация, изомерия. ЕГЭ по химииСкачать  Реакции элиминирования (отщепления)ДегидратацияДегидратация, фактически подразумевающая отщепление молекул воды, в случае спиртов различается на межмолекулярную дегидратацию и внутримолекулярную дегидратацию. При межмолекулярной дегидратации спиртов одна молекула воды образуется в результате отщепления атома водорода от одной молекулы спирта и гидроксильной группы — от другой молекулы. В результате этой реакции образуются соединения, относящиеся к классу простых эфиров (R-O-R): Внутримолекулярная дегидратация спиртов протекает таким образом, что одна молекула воды отщепляется от одной молекулы спирта. Данный тип дегидратации требует несколько более жестких условий проведения, заключающихся в необходимости использования заметно более сильного нагревания по сравнению с межмолекулярной дегидратацией. При этом из одной молекулы спирта образуется одна молекула алкена и одна молекула воды: Поскольку молекула метанола содержит только один атом углерода, для него невозможна внутримолекулярная дегидратация. При дегидратации метанола возможно образование только простого эфира (CH3-O-CH3). Нужно четко усвоить тот факт, что в случае дегидратации несимметричных спиртов внутримолекулярное отщепление воды будет протекать в соответствии с правилом Зайцева, т.е. водород будет отщепляться от наименее гидрированного атома углерода: Дегидрирование спиртова) Дегидрирование первичных спиртов при нагревании в присутствии металлической меди приводит к образованию альдегидов: б) В случае вторичных спиртов аналогичные условия приведут у образованию кетонов: в) Третичные спирты в аналогичную реакцию не вступают, т.е. дегидрированию не подвергаются. Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать  Реакции окисленияГорениеСпирты легко вступают в реакцию горения. При этом образуется большое количество тепла: Неполное окислениеНеполное окисление первичных спиртов может приводить к образованию альдегидов и карбоновых кислот. В случае неполного окисления вторичных спиртов возможно образование только кетонов. Неполное окисление спиртов возможно при действии на них различных окислителей, например, таких, как кислород воздуха в присутствии катализаторов (металлическая медь), перманганат калия, дихромат калия и т.д. При этом из первичных спиртов могут быть получены альдегиды. Как можно заметить, окисление спиртов до альдегидов, по сути, приводит к тем же органическим продуктам, что и дегидрирование: Следует отметить, что при использовании таких окислителей, как перманганат калия и дихромат калия в кислой среде возможно более глубокое окисление спиртов, а именно до карбоновых кислот. В частности, это проявляется при использовании избытка окислителя при нагревании. Вторичные спирты могут в этих условиях окислиться только до кетонов. Видео:9.3. Фенол: Химические свойстваСкачать  ПРЕДЕЛЬНЫЕ МНОГОАТОМНЫЕ СПИРТЫЗамещение атомов водорода гидроксильных группМногоатомные спирты так же, как и одноатомные реагируют со щелочными, щелочноземельными металлами и алюминием (очищенным от пленки Al2O3); при этом может заместиться разное число атомов водорода гидроксильных групп в молекуле спирта: 2. Поскольку в молекулах многоатомных спиртов содержится несколько гидроксильных групп, они оказывают влияние друг на друга за счет отрицательного индуктивного эффекта. В частности, это приводит к ослаблению связи О-Н и повышению кислотных свойств гидроксильных групп. Большая кислотность многоатомных спиртов проявляется в том, что многоатомные спирты, в отличие от одноатомных, реагируют с некоторым гидроксидами тяжелых металлов. Например, нужно запомнить тот факт, что свежеосажденный гидроксид меди реагирует с многоатомными спиртами с образованием ярко-синего раствора комплексного соединения. Так, взаимодействие глицерина со свежеосажденными гидроксидом меди приводит к образованию ярко-синего раствора глицерата меди: Данная реакция является качественной на многоатомные спирты. Для сдачи ЕГЭ достаточно знать признаки этой реакции, а само уравнение взаимодействия уметь записывать необязательно. 3. Так же, как и одноатомные спирты, многоатомные могут вступать в реакцию этерификации, т.е. реагируют с органическими и кислородсодержащими неорганическими кислотами с образованием сложных эфиров. Данная реакция катализируется сильными неорганическими кислотами и является обратимой. В связи с этим при осуществлении реакции этерификации образующийся сложный эфир отгоняют из реакционной смеси, чтобы сместить равновесие вправо по принципу Ле Шателье: Если в реакцию с глицерином вступают карбоновые кислоты с большим числом атомов углерода в углеводородном радикале, получающиеся в результате такой реакции, сложные эфиры называют жирами. В случае этерификации спиртов азотной кислотой используют так называемую нитрующую смесь, представляющую собой смесь концентрированных азотной и серной кислот. Реакцию проводят при постоянном охлаждении: Сложный эфир глицерина и азотной кислоты, называемый тринитроглицерином, является взрывчатым веществом. Кроме того, 1%-ный раствор данного вещества в спирте обладает мощным сосудорасширяющим действием, что используется при медицинских показаниях для предотвращения приступа инсульта или инфаркта. Замещение гидроксильных группРеакции данного типа протекают по механизму нуклеофильного замещения. К взаимодействиям такого рода относится реакция гликолей с галогеноводородами. Так, например, реакция этиленгликоля с бромоводородом протекает с последовательным замещением гидроксильных групп на атомы галогена: Видео:2CH3OH + 3O2 → 2CO2 + 4H2O | Реакция горения метанолаСкачать  Химические свойства феноловКак уже было сказано в самом начале данной главы, химические свойства фенолов заметно отличаются от химических свойств спиртов. Связано это с тем, что одна из неподеленных электронных пар атома кислорода в гидроксильной группе сопряжена с π-системой сопряженных связей ароматического кольца. Реакции с участием гидроксильной группыКислотные свойстваФенолы являются более сильными кислотами, чем спирты, и в водном растворе в очень небольшой степени диссоциированы: Большая кислотность фенолов по сравнению со спиртами в плане химических свойств выражается в том, что фенолы, в отличие от спиртов, способны реагировать со щелочами: Однако, кислотные свойства фенола выражены слабее, чем даже у одной из самых слабых неорганических кислот – угольной. Так, в частности, углекислый газ, при пропускании его через водный раствор фенолятов щелочных металлов, вытесняет из последних свободный фенол как еще более слабую, чем угольная, кислоту: Очевидно, что любой другой более сильной кислотой фенол также будет вытесняться из фенолятов: 3) Фенолы являются более сильными кислотами, чем спирты, а спирты при этом реагируют с щелочными и щелочноземельными металлами. В связи с этим очевидно, что и фенолы будут реагировать с указанными металлами. Единственное, что в отличие от спиртов, реакция фенолов с активными металлами требует нагревания, так как и фенолы, и металлы являются твердыми веществами: Реакции замещения в ароматическом ядреГидроксильная группа является заместителем первого рода, и это значит, что она облегчает протекание реакций замещения в орто- и пара-положениях по отношению к себе. Реакции с фенолом протекают в намного более мягких условиях по сравнению с бензолом. ГалогенированиеРеакция с бромом не требует каких-либо особых условий. При смешении бромной воды с раствором фенола мгновенно образуется белый осадок 2,4,6-трибромфенола: НитрованиеПри действии на фенол смеси концентрированных азотной и серной кислот (нитрующей смеси) образуется 2,4,6-тринитрофенол – кристаллическое взрывчатое вещество желтого цвета: Реакции присоединенияПоскольку фенолы являются ненасыщенными соединениями, возможно их гидрирование в присутствии катализаторов до соответствующих спиртов: 📹 ВидеоГорение этилового и изопропилового спиртов.Скачать  7.4. Спирты: Химические свойства. ЕГЭ по химииСкачать  Горение. 7 класс.Скачать  29. Общая реакция горения для всех углеводородов. Как расставить коэффициенты реакции легкоСкачать  Химия 10 класс (Урок№6 - Одноатомные предельные спирты.)Скачать  Химия 10 класс (Урок№7 - Фенолы и ароматические спирты.)Скачать  Спирты и фенолы. Тема 21. Химические свойства, получение и применение спиртовСкачать  9.1. Фенол: Строение, номенклатураСкачать  Спирты и фенолы: цепочки. Часть 1/3. 10 класс и ЕГЭ по химииСкачать  Реакции горенияСкачать  Горение этилового спиртаСкачать  Химические свойства фенола. 10 класс.Скачать  |
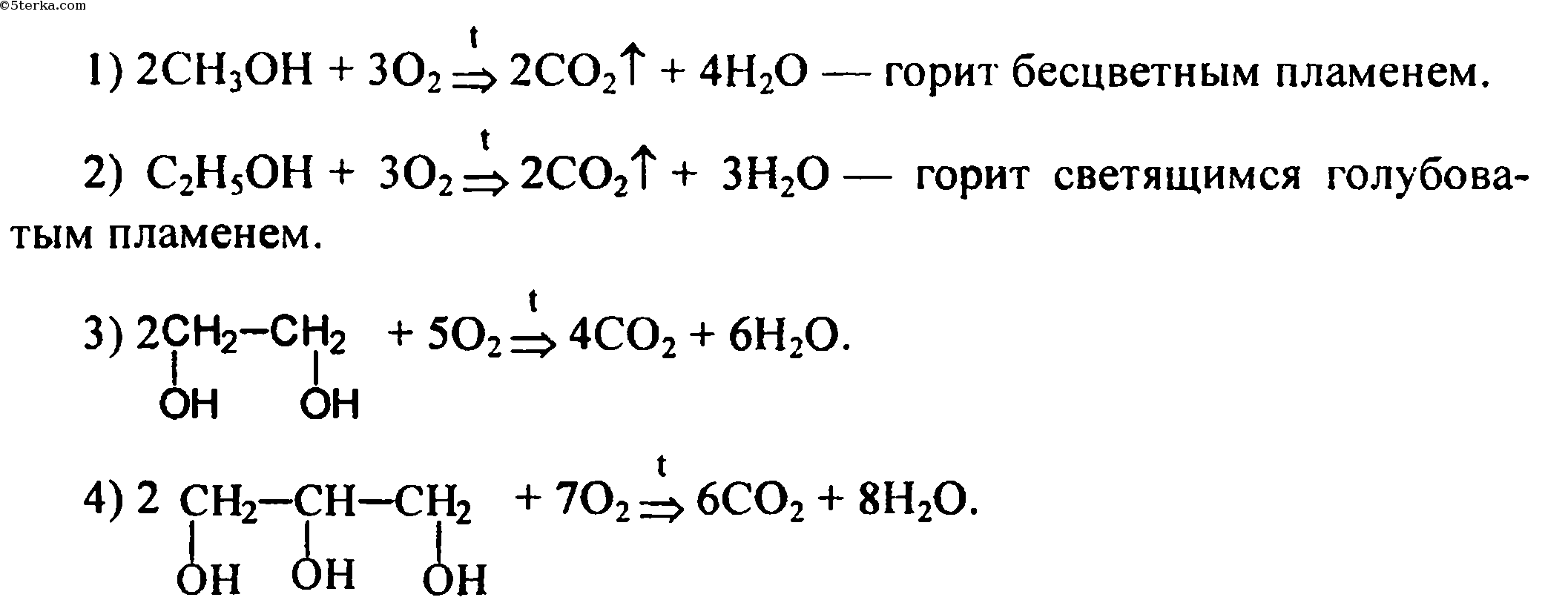






 ,
,
 Наблюдение и вывод:
Наблюдение и вывод: