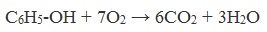161. Из хлорбензола получите n-хлоранилин. Напишите реакции n-хлоранилина с НСl, NaNO2 (в среде НСl), СН3СОСl.
n-хлоранилин можно получить восстановлением n-нитрохлорбензола, его в свою очередь получаем нитрованием хлорбензола:
Рассмотрим взаимодействие n-хлоранилина с хлороводородом :
Реакция n-хлоранилина с нитритом натрия с солянокислой среде –реакция диазотирования:
Реакция n-хлоранилина с хлорангидридом уксусной кислоты :
171. Напишите уравнения реакций диазотирования n-толуидина, м-нитроанилина, n-хлоранилина, сульфаниловой кислоты нитритом натрия в растворе соляной кислоты и амилнитритом в кислой среде.
Реакции диазотирования нитритом натрия в солянокислой среде :
Реакции диазотирования амилнитритом в кислой среде :
181. Из анилина получите симм-трибромбензол.
Для получения симм-трибромбензола бромируем имеющийся анилин, получаем 2,4,6-триброманилин :
Для полученного 2,4,6-триброманилина проводим реакцию диазотирования в присутствии серной кислоты :
Далее к полученной соли диазония добавляем этанол в качестве восстановителя и получаем симм-трибромбензол :
191. Из бензола получите n-бромфенол, трибромфенол, м — нитроанизол, дифениловый эфир.
Для получения n-бромфенола и трибромфенлоа из бензола вначале получим фенол, для этого проведем реакцию бензола с серной кислотой, полученную сульфокислоту нагреем с гидроксидом натрия, и полученную соль растворим в кислоте:
Далее к полученному фенолу добавляем бром:
Для получения м –нитроанизола из бензола вначале бензол нитрируем, потом проведем реакцию сульфирования, т. к нитро — группа заместитель второго ода, то сульфогруппа встанет в мета положении по отношениют к ниро группе, затем полученную м-нитросульфокислоту подвергнем сплавлению с гидроксидом натрия, и наконец, на полученную соль подействуем хлорметаном :
Для получения дифенилового эфира из бензола проведем реакцию сульфирования бензола с последующим спеканием сульфокислоты с гидроксидом натрия.
Вторую часть бензола подвергнем бромированию.
При взаимодействии полученного фенолята натрия и бромбензола получим заданный дифениловый эфир :
Видео:Взаимодействие уксусной кислоты с карбонатом натрияСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
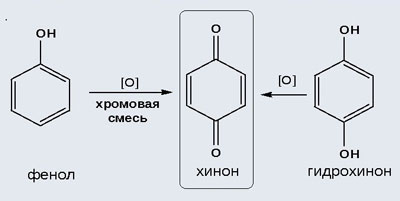
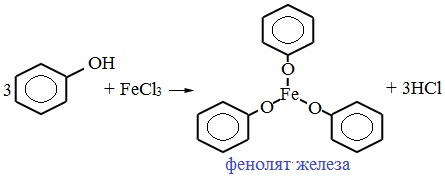
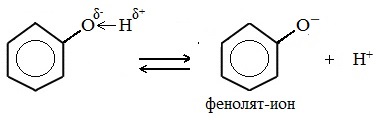
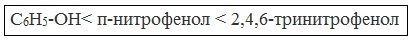
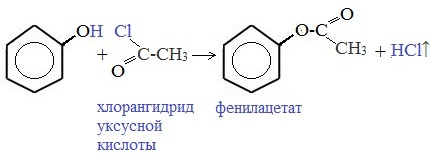
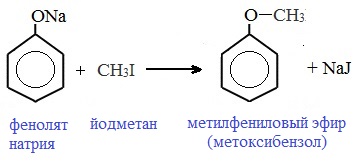
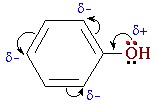
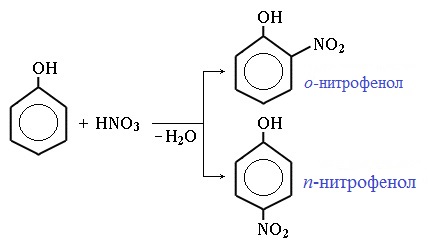
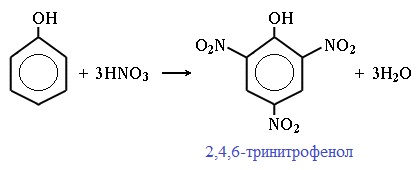
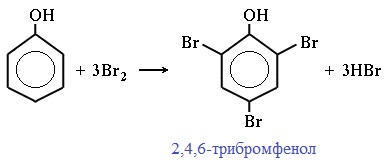
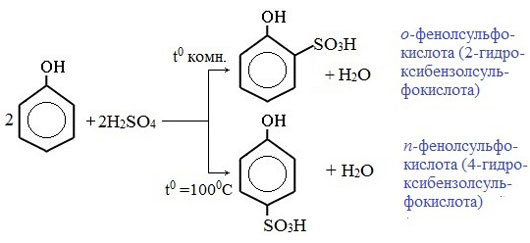
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Взаимодействие уксусной кислоты с гидроксидом натрияСкачать  Напишите уравнения реакций фенолята натрия с хлорангидридом уксусной кислотыХимические свойства фенолов определяются наличием в молекуле гидроксильной группы и бензольного кольца. I. Реакции с участием гидроксильной группыФенолы являются более сильными кислотами, чем спирты и вода, т.к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается. Фенолы в водных растворах диссоциируются по кислотному типу: на фенолят-ионы и ионы водорода: Фенол диссоциирует обратимо, это слабая кислота. Однако его силы кислотных свойств достаточно, чтобы изменять окраску индикатора, имеющего в нейтральной среде фиолетовый цвет. В растворе фенола лакмус краснеет. 1) Взаимодействие с активными металлами с образованием фенолятов (сходство со спиртами) Видеоопыт «Взаимодействие фенола с металлическим натрием» 2) Взаимодействие со щелочами с образованием фенолятов (отличие от спиртов) Видеоопыт «Взаимодействие фенола с раствором щелочи» Образующиеся в результате реакций феноляты легко разлагаются при действии кислот. Даже такая слабая кислота, как угольная, вытесняет фенол из фенолятов. Следовательно, !Феноляты – соли слабой карболовой кислоты, разлагаются угольной кислотой: По кислотным свойствам фенол превосходит этанол в 10 6 раз. При этом во столько же раз уступает уксусной кислоте. В отличие от карбоновых кислот, фенол не может вытеснить угольную кислоту из её солей C6H5-OH + NaHCO3 = реакция не идёт – прекрасно растворяясь в водных растворах щелочей, он фактически не растворяется в водном растворе гидрокарбоната натрия. Кислотные свойства фенола усиливаются под влиянием связанных с бензольным кольцом электроноакцепторных групп (NO2 — , Br — ) 2,4,6-тринитрофенол или пикриновая кислота сильнее угольной. 3) Образование сложных и простых эфиров Как и спирты, фенолы могут образовывать простые и сложные эфиры. Фенолы не образуют сложные эфиры в реакциях с кислотами. Сложные эфиры образуются при взаимодействии фенола с ангидридами или хлорангидридами карбоновых кислот: Простые эфиры образуются при взаимодействии фенолятов с алкилгалогенидами: II . Реакции, с участием бензольного кольцаВзаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра. Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно, в орто- и пара- положениях (+ М -эффект ОН-группы): Поэтому фенол значительно активнее бензола вступает в реакции электрофильного замещения в ароматическом кольце. Реакции замещения 1) Нитрование Под действием 20% азотной кислоты HNO3 фенол легко превращается в смесь орто- и пара- нитрофенолов: При использовании концентрированной HNO3 образуется 2,4,6-тринитрофенол (пикриновая кислота): У нее кислотные свойства выражены сильнее, чем у фенола, т.к. нитрогруппы оттягивают электронную плотность от бензольного кольца и делают связь О-Н еще более полярной. Пикриновая кислоты является взрывчатым веществом, в чистом виде представляет собой желтые кристаллы. 2) Галогенирование Фенол легко при комнатной температуре взаимодействует с бромной водой с образованием белого осадка 2,4,6-трибромфенола ( качественная реакция на фенол! ): Образуется белый осадок трибромфенола. Видеоопыт «Взаимодействие фенола с бромной водой» 3) Сульфирование Соотношение о- и п-изомеров определяется температурой реакции: при комнатной температуре в основном образуется о-фенолсульфокислота, при t=1000С – пара-изомер: 1) Гидрирование фенола Эта реакция идет с разрушением ароматического кольца. Продукт реакции циклический одноатомный спирт — циклогексиловый спирт (циклогексанол). 2) Конденсация с альдегидами При нагревании фенола с формальдегидом в присутствии кислотных или основных катализаторов происходит реакция поликонденсации и образуется фенолформальдегидная смола. Данная реакция имеет большое практическое значение и используется при получении фенолформальдегидных смол. III. Реакция окисленияФенолы легко окисляются даже под действием кислорода воздуха. При стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. 1) Горение (полное окисление) Фенолы, как и большинство органических веществ, сгорают до углекислого газа и воды. 2) Окисление хромовой смесью При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона также образуется хинон: IV. Качественная реакция! — обнаружение фенолаДля обнаружения фенолов используется качественная реакция с хлоридом железа (III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа. Видеоопыт «Качественная реакция на фенол» Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией на фенол: Для фенолов реакции по связям С-О не характерны, поскольку атом кислорода прочно связан с атомом углерода бензольного кольца за счет участия своей неподеленной электронной пары в системе сопряжения. 📹 ВидеоОпыты по химии. Реакция нейтрализацииСкачать  Реакция уксусной кислоты с карбонатом натрияСкачать  9.3. Фенол: Химические свойстваСкачать  ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать  8 класс. Массовая доля растворенного вещества. Решение задач.Скачать  Реакция нейтрализации гидроксида натрия соляной (хлороводородной) кислотойСкачать  Получение уксусной кислоты из ацетата натрия (Synthesis of acetic acid from sodium acetate)Скачать  Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать  Взаимодействие уксусной кислоты с металламиСкачать  Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать  11.3. Карбоновые кислоты и их соли: Химические свойства. ЕГЭ по химииСкачать  11.1. Карбоновые кислоты: Строение, номенклатура, изомерия. ЕГЭ по химииСкачать  Получение ледяной уксусной кислоты/Synthesis of glacial acetic acidСкачать  Взаимодействие соды с соляной кислотойСкачать  019 Взаимодействие уксусной кислоты с гидроксидом натрияСкачать  ФенолыСкачать  9.1. Фенол: Строение, номенклатураСкачать  75. Ионные реакции в растворах электролитовСкачать  |






















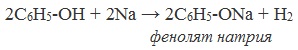
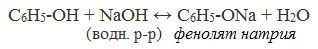
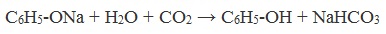

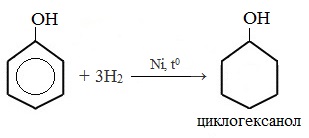
 Реакции присоединения
Реакции присоединения