- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Химия, Биология, подготовка к ГИА и ЕГЭ
- Электролиз расплавов оксидов
- Электролиз расплавов оснований
- Электролиз расплавов солей
- Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
- 🎬 Видео
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

We are checking your browser. gomolog.ru
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Электролиз. 10 класс.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70213e3d695c0bcd • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химия, Биология, подготовка к ГИА и ЕГЭ
Мы уже рассматривали электролиз растворов солей, теперь давайте разберем электролиз расплавов веществ.
В этой лекции мы рассмотрим электролиз расплавов трех видов веществ:
- электролиз расплавов оксидов;
- электролиз расплавов оснований;
- электролиз расплавов солей.
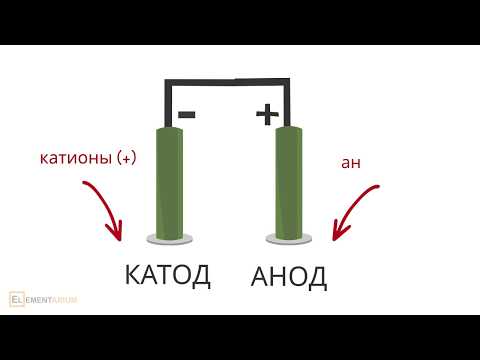
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
- У анода анионыокисляются.
- На катоде катионы восстанавливаются.
В первой строке все слова начинаются с гласной буквы, во второй — с согласной.
КАТ од — КАТ ионы (ионы у кат ода)
АН од — АН ионы (ионы у ан ода)
Видео:уравнения электролизаСкачать

Электролиз расплавов оксидов
На катоде идет восстановление: Me n+ + ne — = Me 0 , т.е. на катоде выделяется металл.
На аноде окисляется кислород: O -2 -2e — = O2
Возьмем для примера электролиз расплава оксида калия: 2K2O -> 4K + O2
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Электролиз расплавов оснований
На катоде традиционно восстанавливается металл:
На аноде будет окисляться кислород в составе гидроксид-группы:
Электролиз расплавов солей
1. Электролиз расплава бескислородной соли:
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде окисляется бескислородный анион: A n- — ne — = A 0
Электролиз расплава NaCl: 2NaCl = 2Na + Cl2
2. Электролиз расплава кислородсодержащей соли (элемент аниона не в высшей степени окисления):
На катоде всегда восстанавливается металл: Me n+ +ne — = Me 0
На аноде будет окисляться элемент аниона: SO3 2- — 2e — = SO3
Например, электролиз расплава сульфита натрия:
S в сульфите имеет степень окисления +4, при электролизе она окисляется до +6 — SO3
3. Электролиз расплава кислородсодержащей соли (элемент аниона в высшей степени окисления):
На катоде все без изменений 🙂
На аноде — т.к. элемент уже в высшей степени окисления, то окисляться будет кислород:
Например, электролиз расплава карбоната натрия:
Важно понимать, что эти реакции не идут сами по себе. Их протекание возможно только при действии электрического тока.
Видео:Часть 3-1. Электролиз расплава. Решаем примеры уравнений (подробно).Скачать

Тренировочный вариант №2 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года
Тренировочная работа №5 ЕГЭ по химии Статград-2022 от 20 апреля 2022 года, вариант 2, вариант ХИ2110502 с ответами и решениями. Ответы на тренировочный вариант Статград №5 ЕГЭ по химии 20.04.2022.
| Для выполнения заданий 1–3 используйте следующий ряд химических элементов: 1) S, 2) Al, 3) O, 4) Fe, 5) Te Ответом в заданиях 1–3 является последовательность цифр, под которыми указаны химические элементы в данном ряду. 1. Какие из указанных элементов имеют в возбуждённом состоянии конфигурацию внешнего уровня ns 2 np 3 nd 1 ? Запишите номера выбранных элементов в порядке возрастания. 2. Из указанного ряда выберите три элемента, принадлежащие одной подгруппе Периодической системы. Расположите их в порядке увеличения полярности связи в водородном соединении. Запишите в поле ответа номера выбранных элементов в нужной последовательности. 3. Из указанного ряда выберите два элемента, которые во многих соединениях проявляют степень окисления +3. Запишите в поле ответа номера выбранных элементов в порядке возрастания. 4. Из предложенного перечня выберите два вещества, в молекулах которых имеется тройная связь. Запишите номера выбранных ответов в порядке возрастания. 5. Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы: А) амфотерного оксида; Б) сильного основания; В) кислой соли. Запишите в поле ответа выбранные цифры в нужной последовательности. 6. В двух колбах находился раствор сульфида аммония. В первую колбу добавили раствор вещества Х, а во вторую – раствор вещества Y. В первой колбе выделился газ и выпал осадок, а во второй выделился газ, а раствор остался прозрачным. Из предложенного перечня выберите вещества X и Y, которые могут вступать в описанные реакции. Запишите в поле ответа выбранные цифры в нужной последовательности. 7. Установите соответствие между веществом и реагентами, с каждым из которых это вещество может взаимодействовать: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 8. Установите соответствие между исходными веществами, вступающими в реакцию и продуктами, которые образуются при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 9. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа номера выбранных веществ в нужной последовательности. 10. Установите соответствие между структурной формулой вещества и классом/группой органических соединений, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 11. Из предложенного перечня выберите два вещества, в молекулах которых есть только σ-связи. 12. Из предложенного перечня выберите все вещества, способные окислять альдегиды. Запишите номера выбранных ответов в порядке возрастания. 13. Из предложенного перечня выберите два вещества, которые реагируют с пропиламином. Запишите номера выбранных ответов в порядке возрастания. 14. Установите соответствие между реагирующими веществами и органическим продуктом, который образуется при взаимодействии этих веществ: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 15. Установите соответствие между схемой реакции и веществом Х, принимающим в ней участие: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите в поле ответа выбранные цифры в нужной последовательности. 16. Задана следующая схема превращений веществ: Определите, какие из указанных веществ являются веществами X и Y. Запишите в поле ответа выбранные цифры в нужной последовательности. 17. Из предложенного перечня выберите все реакции, которые происходят без изменения степеней окисления элементов. 18. Из предложенного перечня выберите все реакции, скорость которых возрастает при увеличении pH среды. Запишите номера выбранных ответов в порядке возрастания. 1) Cl2 + KOH → KCl + KClO + H2O 19. Установите соответствие между схемой реакции и свойством, которое проявляет элемент азот в этой реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности. 20. Установите соответствие между формулой вещества и продуктами электролиза водного раствора или расплава этого вещества, выделившимися на инертных электродах: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
Запишите выбранные цифры в нужной последовательности.
|






 MnO2 + 2NO2↑
MnO2 + 2NO2↑
 2CH3CHO
2CH3CHO CH3CH=CHC6H5
CH3CH=CHC6H5