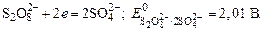Пример 1. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора MgSO4 с инертными электродами.
Решение. Стандартный электродный потенциал системы Mg 2+ + 2e ® Mg равен –2,363 В. Сульфат магния является солью, обра-зованной слабым основанием и сильной кислотой, поэтому вследствие гидролиза среда в его водном растворе будет слабокислотной (рН – ,
а ионы Мg 2+ будут накапливаться в прикатодном пространстве.
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
поскольку отвечающий этой системе электродный потенциал кислородного электрода в слабокислотной среде
значительно меньше, чем стандартный потенциал, характеризующий систему:
Ионы 
Умножая уравнение катодного процесса на 2 для подведения баланса по электронам и складывая его с уравнением анодного процесса, получают суммарное уравнение процесса электролиза:
Принимая во внимание, что одновременно происходит накопление ионов магния в прикатодном пространстве и сульфат-ионов в прианодном пространстве, итоговое уравнение процесса можно записать так:
6 Н2О + 2MgSO4 = 2H2 + 2Mg(OH)2¯ + O2 + 4H + + 2
Следует учитывать, что гидроксид магния – малорастворимое соединение.
Пример 2. Написать уравнения процессов, протекающих при электролизе водного раствора, содержащего смесь солей Cu(NO3)2 и ZnBr2. Электроды графитовые.
Решение. На катоде возможно протекание следующих процессов:
Cu 2+ + 2e = Cu 
Zn 2+ + 2 e = Zn 
2H2O + 2e ® H2 + 2OH – 
Необходимо учитывать, что выделение водорода протекает со значительным перенапряжением.
Наибольший потенциал у первого процесса, поэтому на катоде будут восстанавливаться ионы меди:
На аноде возможно протекание следующих процессов:
2H2O – 4e = O2 + 4H + 
В прианодном пространстве накапливаются нитрат–ионы.
Суммарное уравнение процесса электролиза можно получить сложением уравнений катодного и анодного процессов:
Сu 2+ + 2Br – = Cu + Br2
Принимая во внимание, что одновременно происходит накопление ионов цинка в прикатодном пространстве и нитрат-ионов в прианодном, итоговое уравнение процесса можно записать так:
Сu(NO3)2 + ZnBr2 = Cu + Br2 + Zn 2+ + 2
Пример 3. Какие процессы будут протекать на железных электродах при электролизе водного раствора Al2(SO4)3 в атмосфере воздуха в нейтральной среде?
В атмосфере воздуха рН »7.
На катоде возможно протекание следующих процессов:
Fe 2+ + 2e = Fe 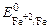
2H2O + 2e ® H2 + 2OH – 
Al 3+ + 3e = Al 
Вследствие того, что выделение водорода сопровождается перенапряжением, наибольший потенциал становится у первого процесса, поэтому на катоде будут восстанавливаться ионы железа: Fe 2+ + 2 e = Fe.
В прикатодном пространстве накапливаются ионы алюминия Al 3+ .
На железном аноде возможно протекание следующих процессов:
Fe – 2e = Fe 2+ 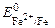


2H2O – 4e = O2 + 4H + 
При электролизе расплава хлорида натрия на электродах протекают процессы
Согласно первому закону Фарадея, время, необходимое для получения 150 г металлического натрия, определяем по формуле

где Mэк.(Na) – молярная масса эквивалента натрия, г/моль; z – число электронов, участвующих в электродном процессе; I – сила тока, А; F – постоянная Фарадея; h – выход по току.
Объем хлора образуется в количестве 1 моль и составляет
Пример 5. Серебрение изделий ведется в растворе азотнокислого электролита с плотностью тока 3 А/дм 3 . Рассчитать толщину серебряного слоя, образующегося за 2 мин, если выход по току h = 0,90. Плотность серебра r = 10 490 кг/м 3 .
Решение. Согласно закону Фарадея, масса выделившегося серебра

После преобразований находим толщину покрытия
где i = I/S – плотность тока; r – плотность металла.
Пример 6. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000 А×ч.
Решение. Объем моль эквивалента водорода при н.у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А×ч., следовательно, для выделения 112 л потребуется 268 А×ч. Найдем выход по току водорода:

Пример 7. При электролизе водного раствора меди сульфата 
Решениезадачи следует начинать с описания объекта изучения – электрохимических реакций. До электролиза в растворе прошли реакции:
а) диссоциация
б) гидролиз
Электрохимическая система: (-) К С 
Процессы на катоде (–) и на аноде (+) А при электролизе:
Определим массу кислорода 
Молярная масса эквивалентов кислорода 
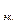
5,6 л 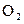
х =
На аноде выделилось 0,28/5,6 = 0,05 моль эквивалентов О2.
Вычислим массу меди 
Согласно второму закону Фарадея:
Пример 8. Через щелочной раствор, содержащий комплексные ионы двух- и четырехвалентного олова, 


Решение. Процессы диссоциации комплексных ионов в растворе:


Электрохимическая система: (–) К: Sn 
Примем, что электроосаждение происходит из ионов Sn 4+ и Sn 2+ :
(–) К: 

“Sn” (+) A: Sn
Масса олова 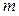
Масса олова 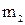
Общая масса выделившегося на катоде олова m:
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Напишите уравнения электролиза водных растворов сульфата магния
Вопрос по химии:
напишите уравнение электролиза водных растворов хлорида кальция,сульфата магния
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
CaCl2 +H2O=Н2 + Cl2 + Ca(OH)2
CaCl2 = Ca2+Cl-
К(+) Са2+, Н2О |2Н2О + 2е = Н2 + 2ОН- | 1
А(+) Cl-, Н2О |2Сl- — 2е = Сl2 | 1
MgSO4 + H2O = H2 +O2 + Mg(OH)2 + H2SO4
MgSO4 = Mg2+ + SO4-
К(+) Mg2+, H2O | 2Н2О + 2е = Н2 + 2ОН- | 1
А(-) SO42-, H2O | 2Н2О — 2е = O2 + 4H+
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Составьте схемы электролиза водных растворов: а) сульфата меди; б) хлорида магния; в) сульфата калия. Во всех случаях электролиз
Видео:Электролиз. 10 класс.Скачать

Ваш ответ
Видео:Опыты по химии. Электролиз раствора сульфата натрияСкачать

решение вопроса
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Похожие вопросы
- Все категории
- экономические 43,300
- гуманитарные 33,630
- юридические 17,900
- школьный раздел 607,261
- разное 16,836
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
💥 Видео
Электролиз растворов. 2 часть. 10 класс.Скачать

уравнения электролизаСкачать

Электролиз растворов. 1 часть. 10 класс.Скачать

Электролиз. Как составлять уравнения электролиза водных растворов солей.Скачать

Электролиз раствора сульфата меди(II)Скачать

Электролиз раствора сульфата меди(II)Скачать

Электролиз раствора сульфата натрияСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Электролиз раствора сульфата меди(II)Скачать

Задание ЕГЭ №20. Электролиз расплавов и растворов.Скачать

Электролиз. Часть 7. Электролиз с растворимым анодомСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

ЭлектролизСкачать

Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Электролиз раствора сульфата натрия | ЕГЭ по химииСкачать