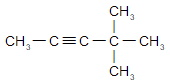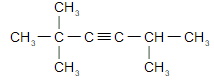Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Содержание Видео:Решите уравнение tg п(x-3)/6 = 1/корень из 3. В ответе напишите наибольший отрицательный корень.Скачать  Напишите уравнения бутина-1 и 3-метилпентина-1 со следующими веществами: а) с водородом в присутствиВидео:Задание 3 ЕГЭ по математике. Урок 11Скачать  Ответы на вопроса) CH3 — CH2 — C тройная связь CH а) CH3 — CH2 — C тройная связь CH б) 3-метилпентин-1 Видео:Решите уравнение: tg пx/4 = -1 В ответе напишите наибольший отрицательный корень.Скачать  Напишите уравнения бутина 1 и 3 метилпентина 1 с металлическим натриемFOR-DLE.ru — Всё для твоего DLE 😉 На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх. |
Задание 1
Какие углеводороды называют алкинами? Алкинами называют углеводороды с общей формулой CnH2n-2, в молекулах которых содержится одна тройная углерод-углеродная связь С≡С.
Приведите названия, молекулярные и структурные формулы первых четырёх представителей гомологического ряда алкинов.
| Название | Молекулярная формула | Структурная формула |
| этин | C2H 2 | HC≡CH |
| пропин | C3H 4 | HC≡C ― CH 3 |
| бутин-1 | C4H 6 | HC≡C ― CH2 ― CH 3 |
| пентин-1 | C5H 8 | H3C ― C≡C ― CH2 ― CH 3 |
Задание 2
Сравните общие формулы диеновых и ацетиленовых углеводородов. Общие формулы CnH2n-2 одинаковые.
Можно ли однозначно сказать, к какому классу углеводородов принадлежит вещество с формулой C4H6? Нельзя, т.к. молекулярная формула не отражает пространственное строение молекулы. Например, формуле C4H6 могут соответствовать алкин и алкадиен.
Напишите структурные формулы одного алкадиена и одного алкина, имеющих такой состав, и назовите их.
| Структурная формула алкадиена C4H6: | Структурная формула алкина C4H6: |
| CH2=CH―CH=CH2 бутадиен-1,3 | H3C ― C≡C ― CH 3 бутин-2 |
Какой вид изомерии характерен для этих соединений? Для алкадиенов и алкинов характерны следующие виды изомерии:
― углеродного скелета;
― положение связи (двойной или тройной) ;
― межклассовая изомерия; цис-транс-изомерия.
Задание 3
Назовите по международной номенклатуре следующие углеводороды:
а) 4-метилпентин-2 (опечатка в задании)
б) пентин-1
в) 3,3-диметилбутин-1
Задание 4
Напишите структурные формулы следующих алкинов:
а) бутин-1;
HC≡C ― CH2 ― CH 3
б) пентин-2;
CH3 ― C≡C ― CH2 ― CH 3
в) 4,4-диметилпентин-2;
г) 2,2,5-триметилгексин-3.
Завдання 5
Сравните химические свойства этилена и ацетилена. Какие общие черты и различия вы можете отметить? Ответ проиллюстрируйте уравнениями химических реакций.
Этилен и ацетилен сгорают в кислороде:
CH2=CH2 + 3O2 ⟶ 2CO2 + 2H2O
2HC≡CH + 5O2 ⟶ 4CO2 + 2H2O
В реакции гидратации этилена образуется спирт, а ацетилена – альдегид:
CH2=CH2 + H2O кат. ⟶ CH3 ― CH2 ― OH
HC≡CH + H2O кат. ⟶ CH3 ― CHO
Этилен и ацетилен вступают в реакцию гидрогалогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + HBr ⟶ CH3 ― CH2Br
HC≡CH + HBr ⟶ CH2=CHBr
CH2=CHBr + HBr ⟶ CH3 ― CHBr2
Этилен и ацетилен вступают в реакцию галогенирования, при этом с ацетиленом она протекает в две стадии:
CH2=CH2 + Br2 ⟶ CH2Br ― CH2Br
Задание 7
На технический карбид кальция массой 40 г подействовали избытком воды. При этом образовалось 11,2 л газа (н.у.). Определите массовую долю примесей в карбиде кальция.
Дано: m(CaC2 c прим.)=40 г, V(C2H2)=11,2 л
Найти: ω(примеси)-?
Решение
1-й способ
1. Количество вещества этина рассчитываем по формуле: ʋ=V/Vm, где Vm― молярный объём.
ʋ(C2H2)=V( C2H2 )/Vm=11,2 л : 22,4 л/моль=0,5 моль
2. Составляем химическое уравнение: CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
По уравнению реакции ʋ(CaC2): ʋ(C2H2)=1:1 , количества вещества одинаковые, поэтому :
ʋ(CaC2)=ʋ( C2H2 )=0,5 моль
3. Массу технического карбита кальция рассчитываем по формуле: m=ʋ•M, где M ― молярная масса.
M(CaC2)=64 г/моль
m( CaC2 )= ʋ(CaC2) • M( CaC2 )=0,5 моль • 64 г/моль=32 г
4. Рассчитываем массу примесей в техническом карбиде кальция.
m(примесей)=m(CaC2 c прим.)-m(CaC2)=40 г — 32 г=8 г
5. Рассчитываем массовую долю примесей в техническом карбиде кальция:
ω(примеси)=(m(примеси)/ m(CaC2 c прим.)) • 100% =8 г : 40 г • 100%=20%
2-й способ
1. Составляем химическое уравнение:
х г 11,2 л
CaC2 + 2H2O ⟶ C2H2↑ + Ca(OH)2
64 г 22,4 л
Над формулами соединений CaC2 и C2H2 записываем неизвестную массу технического карбида кальция (х г) и приведенный в условии задачи объём этина (11,2 л), а под формулами соединений ― массу и объём количества вещества согласно коэффициентам в химическом уравнении. При н.у. 1 моль любого газа занимает объём 22,4 л.
M(CaC2)=64 г/моль, поэтому масса 1 моль=64 г
х= m( CaC2)=64 г • 11,2 л : 22,4 л=32 г
2. Рассчитываем массовую долю технического карбида кальция:
ω( CaC2 )=(m( CaC2 )/ m(CaC2 c прим.)) • 100% =32 г : 40 г • 100%=80%
3. Рассчитываем массовую долю примесей в техническом карбиде кальция.
ω (примеси)= ω (CaC2 c прим.)- ω (CaC2)=100% — 80%=20%
Ответ: ω(примеси)=20%
Задание 8
Термохимическое уравнение реакции горения ацетилена имеет вид 2C2H2 + 5O2 ⟶ 4CO2 + 2H2O + 2600 кДж Рассчитайте количество теплоты, которое выделится при сгорании 44,8 л ацетилена (н.у.).
По термохимическому уравнению реакции с 44,8 л (2 моль) С2H2 выделяется 2600 кДж теплоты,
по условию задачи с 44,8 л С2H2 ― х кДж теплоты.
х = 22,4 л ● 2600 кДж : 22,4 л=2600 кДж
Ответ: 2600 кДж
Видео:🔴 В бак, имеющий форму цилиндра, налито ... | ЕГЭ БАЗА 2018 | ЗАДАНИЕ 13 | ШКОЛА ПИФАГОРАСкачать

Задачи к разделу Алкины
В настоящем разделе представлены задачи по теме Алкины с готовыми решениями: изомерия, номенклатура, способы получения и свойства.
1) Напишите структурные формулы следующих алкинов: а) 4-этил-2-гексин; б) 4-метил-4-изобутил-1-децин; в) 5,10-диметил-5-изобутил-2-додецин; г) 3,7-диметил-6-изопропил-4-децин; д) 1,5-гексадиин; е) 2-метил-винилацетилен;
2)Назовите по систематической номенклатуре ИЮПАК соединение:
Нумеруем самую длинную углерод-углеродную цепь, начиная с того конца, к которому ближе расположена тройная связь:
Данное соединение относится к классу алкинов, поэтому корень соединения —ундец, суффикс – ин. Тройная связь расположена во втором положении, поэтому – 2-ундецин
Теперь рассмотрим, какие заместители присутствуют в этом соединении:
- При четвертом атоме углерода расположена изопропильная группа, следовательно, прибавляем 4-изопропил;
- При шестом атоме углерода расположена более сложная группа, не имеющая тривиального названия, поэтому назовем ее отдельно:
Самая длинная цепь состоит из трех атомов углерода, все связи насыщенные. В первом и втором положении находятся две метильные группы (при их нумерации используем обозначения, отличающиеся от обозначения главной цепи, например, 1`, 2`). Таким образом, данная группа называется — 1`, 2`- диметилпропил.
Теперь дадим полное название соединению по систематической номенклатуре ИЮПАК:
4-изопропил-6-(1`, 2`- диметилпропил)-2-ундецин
3)Волокно виньон используют для изготовления рыболовных сетей, электроизоляции и др. Его получают сополимеризацией хлористого винила с винилацетатом. Напишите уравнения реакций получения винилхлорида и винилацетата, исходя из ацетилена, уксусной кислоты и хлороводорода, а также схему реакции сополимеризации хлорвинила с винилацетатом.
4)Образец индивидуального газообразного вещества может быть этаном, этиленом, ацетиленом. Каким образом качественно можно установить природу этого газа? Охарактеризуйте углерод-углеродные связи в этом ряду соединений.
Для того, чтобы доказать присутствие этилена можно воспользоваться реакцией его взаимодействия с бромной водой. При этом происходит обесцвечивание раствора брома (в этом случае выделение бромоводорода не должно наблюдаться):
Часто применяется качественная реакция окисления алкенов нейтральным раствором перманганата калия до гликолей; при этом малиновый цвет перманганата меняется на бурый цвет МnO2:
Реакция с солями меди (I) очень чувствительна на присутствие ацетилена в газовой фазе. При пропускании ацетилена в бесцветный аммиачный раствор ацетата меди (I) образуется красновато-коричневый или фиолетовый аморфный осадок карбида меди (Cu2C2).
Этан химически инертен. Его можно определить по отсутствию реакций с перманганатом калия и солями меди (I). Этан с этими веществами не реагирует.
Углерод-углеродные связи алканов представлены в разделе Строение и физические свойства алканов; связи алкенов – в разделе Строение, изомерия и номенклатура алкенов; связи алкинов – в разделе Строение алкинов, а также в задаче 5 данного раздела.
5)Нарисуйте схемы образования σ- и π-связей для соединений: а) метилацетилена; б) винилацетилена; в) диметилацетилена. Обозначьте валентные состояния атомов углерода, виды σ — и π -связей и углы между направлениями σ-связей. Какие эффекты взаимного влияния атомов возникают в молекулах этих веществ?
σ-Связь – это ковалентная связь, возникшая при перекрывании s-, p- и гибридных атомных орбиталей вдоль оси, проходящей через центры ядер связываемых атомов (осевое перекрывание).
π-Связь – это ковалентная связь, образованная боковым перекрытием негибридных р-орбиталей. Такое перекрывание происходит вне оси, соединяющей ядра атомов.
Рассмотрим виды гибридизаций, характерных для атома углерода органических соединений.
sp-Гибридизация
Тройная связь включает одну σ- и две π-связи, образуемые двумя sp-гибридизованными атомами углерода.
σ-Связь возникает при осевом перекрывании sp-гибридизованных орбиталей двух расположенных рядом атомов углерода;
одна из π-связей образуется при боковом перекрывании рy-орбиталей, другая – при боковом перекрывании рz-орбиталей. π-Cвязи находятся во взаимно перпендикулярных плоскостях.
Образование связей на примере молекулы ацетилена H–C≡C–H можно изобразить в виде схемы:
C≡C σ-связь (перекрывание 2sp-2sp);
С–Н σ-связь (перекрывание 2sp-орбиталей углерода и 1s-орбитали водорода).
sp 2 -Гибридизация
Двойная связь включает одну σ- и одну π-связи.
σ-Связь возникает при осевом перекрывании sp 2 -гибридизованных орбиталей, а π-связь – при боковом перекрывании р-орбиталей двух соседних гибридных атомов углерода. σ-Связи, образованные sp 2 -гибридными атомными орбиталями, лежат в одной плоскости под углом 120°. По своей природе π-связь резко отличается от σ-связи: π-связь менее прочная из-за меньшей эффективности перекрывания р-орбиталей.
Образование связей в молекуле этилена можно изобразить следующей схемой:
С=С σ-связь (перекрывание 2sp 2 -2sp 2 ) и π-связь (2рz-2рz)
С–Н σ-связь (перекрывание 2sp 2 — орбиталей углерода и 1s-орбитали водорода).
sp 3 -Гибридизация (тетраэдрическая)
При гибридизации одной s- и три р-орбиталей образуются четыре равноценных по форме и энергии sp 3 -гибридные орбитали. Оси sp 3 -гибридизованных орбиталей направлены к вершинам правильного тетраэдра. Тетраэдрический угол между ними равен 109°28′, что соответствует наименьшей энергии отталкивания электронов.
Для атома углерода и других элементов 2-го периода этот процесс может быть представлен в виде следующей схемы:
Теперь рассмотрим конкретные соединения из задачи.
а) Метилацетилен
В молекуле метилацетилена проявляются положительные индуктивный и мезомерный эффекты.
б) Винилацетилен
В молекуле винилацетилена проявляются положительные индуктивный и мезомерный эффекты.
в)Диметилацетилен
В молекуле диметилацетилена проявляются положительные индуктивный и мезомерный эффекты.
6)Волокно нитрон ближе всех других синтетических волокон приближается по свойствам к натуральной шерсти. Материал для него получают полимеризацией акрилонитрила, который синтезируют из ацетилена и синильной кислоты. Охарактеризуйте виды связей в молекуле этого соединения. Напишите уравнение реакции получения акрилонитрила и схему его полимеризации.
В акрилонитриле присутствует два вида связей: ковалентная полярная (С – N, C – H) и ковалентная неполярная (C – C). Шесть σ-связей и три π-связи.
7)Получите 3-метилпептин-1 двумя способами и составьте для него уравнения реакций: а) с водой в присутствии катализатора (реакция Кучерова); б) с аммиачным раствором оксида серебра; в) с бутанолом-2; г) с уксусной кислотой. Все вещества назовите.
Получить алкины можно, например, путем дегалогенирования дигалогенпроизводных (1) или алкилирования солей ацетиленовых углеводородов (2):
Составим схемы уравнений реакций полученного 3-метилпентина-1 с H2O (Hg 2+ ) – реакция Кучерова, с аммиачным раствором Ag2O, с C4H9OH, c CH3COOH:
8)Напишите уравнения реакций, с помощью которых можно осуществлять следующие превращения: а) бутина-1 в изопропилэтилацетилен; б) 3,3-диметилбутена-1 в 3,3-диметилбутин-1; в) пентина-1 в пентин-2.
В реакции а) Изопропилэтилацетилен можно получить из бутина-1 с помощью реакций замещения водородного атома при тройной связи на металлический натрий (в жидком аммиаке). Далее, при прибавлении 2-хлорпропана получается изопропилэтилацетилен.
В реакциях б) и в) нужные продукты реакции можно получить путем присоединения молекулы галогена (б) или галогенводорода (в) и последующем отщеплением HCl от полученного галогенпроизводного:
Подробнее о способах получения алкинов и способах их получения смотрите в разделах Получение алкинов и Свойства алкинов
📺 Видео
Профильный ЕГЭ 2021. Интенсив СИРОП урок 2. Задача 13Скачать

Теорема Виета для многочлена 3 порядка. 10 класс.Скачать

№ 1753 из сборника задач Б.П.Демидовича (Неопределённые интегралы).Скачать

Функциональный анализ 1. Частично упорядоченные множества. Теорема Хаусдорфа. Лемма ЦорнаСкачать

ОКТЧ 26. Решётки. Теорема Минковского-Главки для октаэдраСкачать

Теорема Гёделя о (не)полнотеСкачать

Многочлен с одной переменной. 10 класс.Скачать

🔴 В бак, имеющий форму прямой призмы, налито ... | ЕГЭ БАЗА 2018 | ЗАДАНИЕ 13 | ШКОЛА ПИФАГОРАСкачать

✓ Свойства функций, непрерывных на отрезке. Теоремы Вейерштрасса и Коши | матан #022 | Борис ТрушинСкачать

№ 1741 из сборника задач Б.П.Демидовича (Неопределённые интегралы).Скачать

8.11 Интегрирование дифференциального биномаСкачать

Теорема Безу и разложение многочлена на множителиСкачать

ОКТЧ 4. Теорема Кантора-Бернштейна. Счётные множестваСкачать

Мокроусов И.С. | Семинар 3 по Алгебре и геометрии, 2024, весна | ВМК МГУСкачать

Теорема о трех перпендикулярах. Признак перпендикулярности плоскостей | Математика | TutorOnlineСкачать

ОГЭ 2021 Задание № 18 Теорема Пифагора Вариант 13. Математика 21.08.2021Скачать