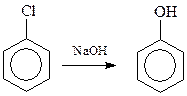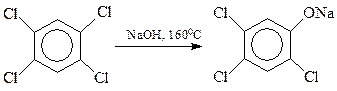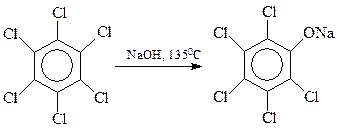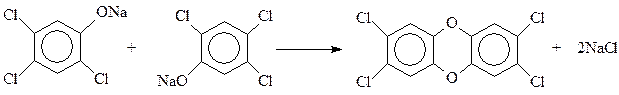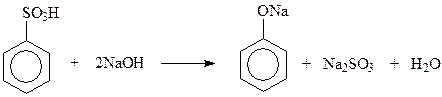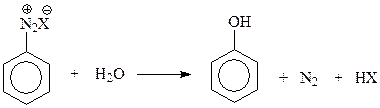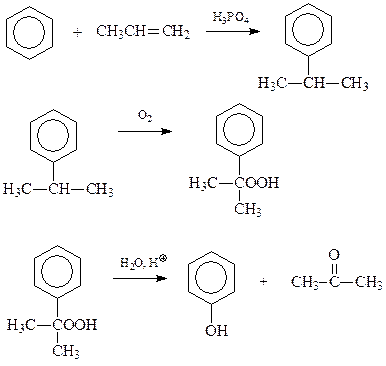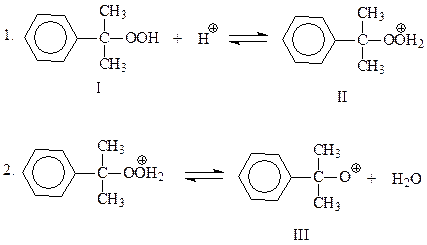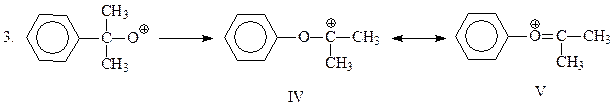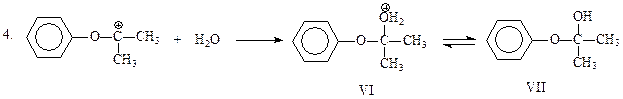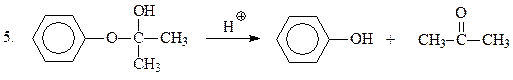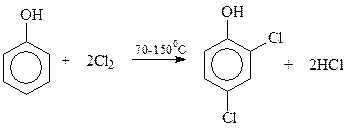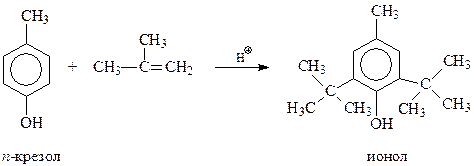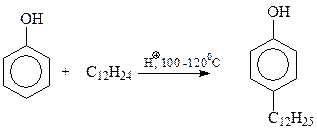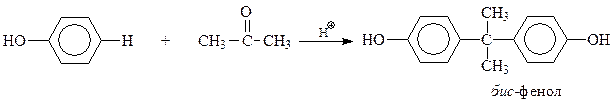14.1.1.1. Гидролиз галогенпроизводных аренов. Гидролиз самого хлорбензола протекает с большим трудом из-за –I-эффекта атома хлора по механизму «элиминирование – присоединение». Условия гидролиза: 10-15%-ный водный раствор NaOH, 350 0 С, 315 атм., время реакции – 20 мин
Хлорбензолы, содержащие в кольце и другие заместители электроноакцепторного типа, гидролизуются значительно легче по бимолекулярному механизму. Интересно, что в качестве таких облегчающих гидролиз заместителей могут выступать и атомы галогена. На этом основано получение хлорфенолов: 2,4,5-трихлорфенола и пентахлорфенола
С сожалением приходиться отмечать, что процесс гидролиза тетрахлорбензола часто выходит из-под контроля. При этом быстро и самопроизвольно температура реакции повышается со 160 0 С до 230 0 С и выше, происходит соответствующее повышение давления. При таком развитии событий (Севезо, 1976 г.) две молекулы фенолята натрия трихлорфенола вступают между собой в реакцию Вильямсона с образованием 2,3,7,8-тетрахлордибензо-п-диоксина
Диоксин – один из наиболее ядовитых органических соединений, созданных когда-либо руками человека. Среднесмертельная доза для человека, полученная расчетным путем, составляет при однократном оральном поступлении 0,05-0,07 микрограммов (миллионных долей грамма).
14.1.1.2. Щелочной плав солей сульфоновых кислот. Этот метод раньше, до разработки кумольного метода, широко применялся для получения фенола и крезолов. Замещение сульфогруппы на гидроксил осуществляется при нагревании солей сульфоновых кислот с едкими щелочами при 300 0 С и выше
14.1.1.3. Замещение диазогруппы на гидроксил. Эта реакция протекает легко даже в водном растворе соли диазония при 5 – 10 0 С
Гидролиз солей диазония – удобный и универсальный лабораторный метод получения разнообразных фенолов.
14.1.1.4. Кумольный метод. Такое название получил метод синтеза фенола разложением гидроперекисей алкилбензолов, чаще всего кумола (Сергеев, Удрис, Кружалов)
В приведенной схеме ключевым является превращение гидроперекиси кумола в фенол и ацетон.
Предложен следующий механизм кислотного разложения гидроперекиси.
В начальной стадии происходит протонирование гидроксильного кислорода гидроперекиси, который далее отщепляет молекулу воды и превращается в окисный катион
Эта промежуточная частица претерпевает перегруппировку по механизму 1,2-фенильного сдвига. Сам факт этой перегруппировки свидетельствует, что резонансный гибрид канонических структур IV и V устойчивее, чем окисный катион III. Полагают, что движущая сила перегруппировки достаточно велика и, возможно, 2 и 3 стадии рассматриваемого механизма протекают одновременно
Электрофильная частица, представленная формулами IV и V, присоединяет воду и отщепляет протон. В результате получается гемикеталь VII, образованный фенолом и ацетоном
На финальной стадии имеет место гидролиз неустойчивого полукеталя
В настоящее время по кумольному методу получают основное количество фенола.
14.1.1.5. Разные реакции. В основу синтеза сложных фенолов, особенно находящих практическое применение, положены самые обычные реакции алкилирования, галогенирования и конденсации самого фенола.
Ниже приводятся примеры таких специальных синтезов.
Как известно, необходимый для синтеза гербицида 2,4-Д дихлорфенол получают хлорированием фенола
Одним из эффективных антиоксидантов, ингибирующих окисление многих веществ кислородом воздуха, оказались так называемые экранированные фенолы, особенно 4-метил-2,6-ди-трет-бутилфенол (ионол). Его можно получить алкилированием п-крезола изобутиленом
Так же с использованием реакции Фриделя-Крафтса осуществляется синтез алкилфенолов исходя из фенола и тримеров и тетрамеров пропилена и изобутилена
Еще один пример – синтез так называемого бис-фенола, на основе которого производится ценнейший полимер – поликарбонат, относящийся к сложным эфирам угольной кислоты
В бензольное кольцо в фенолах могут быть введены и функциональные группы. Одним из интересных примеров может послужить синтез салициловой кислоты по реакции Кольбе-Шмидта
- Карточка к занятию по химии в 10 профильном классе по теме «Фенол».
- Дистанционное обучение как современный формат преподавания
- Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Дистанционные курсы для педагогов
- Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
- Материал подходит для УМК
- Другие материалы
- Вам будут интересны эти курсы:
- Оставьте свой комментарий
- Автор материала
- Дистанционные курсы для педагогов
- Подарочные сертификаты
- Кислородосодержащие Углеводороды.
- 🎥 Видео
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Карточка к занятию по химии в 10 профильном классе по теме «Фенол».
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
№1. Напишите структурные формулы следующих веществ: 1) м-нитрофенол; 2) о-крезол; 3) 2,6-диметилфенол; 4) о-нитрофенол; 5) пикриновая кислота; 6) бензиловый спирт.
Фенолы: химические свойства.
I . Реакции с участием гидроксильной группы.
№2. Напишите уравнения реакций:
1) фенола с калием; 2) фенола с гидроксидом калия; 3) раствора фенолята калия с соляной кислотой; 4) раствора фенолята калия с углекислым газом; 5) фенолята натрия с хлорэтаном; 6) фенолята натрия с хлорангидридом уксусной кислоты ; 7) фенола с хлоридом железа ( III ).
II . Реакции с участием бензольного кольца.
№3. Напишите уравнения реакций:
1) фенола с хлором; 2) фенола с бромной водой; 3) нитрования фенола; 4) фенола с концентрированной серной кислотой; 5) гидрирование фенола.
III . Реакция поликонденсации.
№4. Напишите уравнение реакции фенола с формальдегидом.
IV . Окисление кислородом воздуха.
№ 5. Напишите схему окисления фенола кислородом.
№6. Напишите уравнения реакций получения фенола:
1) гидролизом хлорбензола; 2) щелочным гидролизом хлорбензола; 3) щелочным плавлением солей бензолсульфокислоты; 4) из бензола и пропилена ( кумольный способ).
№7. Напишите уравнения реакций щелочного гидролиза: 1) о-нитрохлорбензола; 2) 2,4,6-тринитрохлорбензола.
№8. Напишите уравнения реакций по схеме превращений:
Пропанол-1 → 1-бромпропан → н-гексан → бензол → изопропилбензол → фенол
№9. Составьте уравнения реакций получения из бензола о-крезола.
Курс повышения квалификации
Дистанционное обучение как современный формат преподавания
- Сейчас обучается 939 человек из 80 регионов
Курс повышения квалификации
Инструменты онлайн-обучения на примере программ Zoom, Skype, Microsoft Teams, Bandicam
- Курс добавлен 31.01.2022
- Сейчас обучается 23 человека из 14 регионов
Курс повышения квалификации
Педагогическая деятельность в контексте профессионального стандарта педагога и ФГОС
- Сейчас обучается 40 человек из 24 регионов
Ищем педагогов в команду «Инфоурок»
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Дистанционные курсы для педагогов
«Взбодрись! Нейрогимнастика для успешной учёбы и комфортной жизни»
Свидетельство и скидка на обучение каждому участнику
Найдите материал к любому уроку, указав свой предмет (категорию), класс, учебник и тему:
5 587 911 материалов в базе
Материал подходит для УМК
«Химия. Углубленный уровень», Габриелян О.С.
Самые массовые международные дистанционные
Школьные Инфоконкурсы 2022
33 конкурса для учеников 1–11 классов и дошкольников от проекта «Инфоурок»
«Психологические методы развития навыков эффективного общения и чтения на английском языке у младших школьников»
Свидетельство и скидка на обучение каждому участнику
Другие материалы
- 17.07.2019
- 174
- 0
- 06.07.2019
- 774
- 0
- 25.06.2019
- 278
- 1
- 21.06.2019
- 594
- 29
- 17.06.2019
- 3154
- 37
- 12.06.2019
- 364
- 3
- 05.06.2019
- 536
- 6
- 02.06.2019
- 192
- 0
Вам будут интересны эти курсы:
Оставьте свой комментарий
Авторизуйтесь, чтобы задавать вопросы.
Добавить в избранное
- 18.07.2019 485
- DOCX 26.6 кбайт
- 9 скачиваний
- Оцените материал:
Настоящий материал опубликован пользователем Кучина Елена Вениаминовна. Инфоурок является информационным посредником и предоставляет пользователям возможность размещать на сайте методические материалы. Всю ответственность за опубликованные материалы, содержащиеся в них сведения, а также за соблюдение авторских прав несут пользователи, загрузившие материал на сайт
Если Вы считаете, что материал нарушает авторские права либо по каким-то другим причинам должен быть удален с сайта, Вы можете оставить жалобу на материал.
Автор материала
- На сайте: 2 года и 10 месяцев
- Подписчики: 0
- Всего просмотров: 7298
- Всего материалов: 16
Московский институт профессиональной
переподготовки и повышения
квалификации педагогов
Видео:Гидролиз солей. 9 класс.Скачать

Дистанционные курсы
для педагогов
663 курса от 690 рублей
Выбрать курс со скидкой
Выдаём документы
установленного образца!
Учителя о ЕГЭ: секреты успешной подготовки
Время чтения: 11 минут
В Ростовской и Воронежской областях организуют обучение эвакуированных из Донбасса детей
Время чтения: 1 минута
Инфоурок стал резидентом Сколково
Время чтения: 2 минуты
Каждый второй ребенок в школе подвергался психической агрессии
Время чтения: 3 минуты
В ростовских школах рассматривают гибридный формат обучения с учетом эвакуированных
Время чтения: 1 минута
Школьник из Сочи выиграл международный турнир по шахматам в Сербии
Время чтения: 1 минута
РДШ организовало сбор гуманитарной помощи для детей из ДНР
Время чтения: 1 минута
Подарочные сертификаты
Ответственность за разрешение любых спорных моментов, касающихся самих материалов и их содержания, берут на себя пользователи, разместившие материал на сайте. Однако администрация сайта готова оказать всяческую поддержку в решении любых вопросов, связанных с работой и содержанием сайта. Если Вы заметили, что на данном сайте незаконно используются материалы, сообщите об этом администрации сайта через форму обратной связи.
Все материалы, размещенные на сайте, созданы авторами сайта либо размещены пользователями сайта и представлены на сайте исключительно для ознакомления. Авторские права на материалы принадлежат их законным авторам. Частичное или полное копирование материалов сайта без письменного разрешения администрации сайта запрещено! Мнение администрации может не совпадать с точкой зрения авторов.
Только 23 февраля!
Получите новую
специальность
по низкой цене
Цена от 1220 740 руб. Промокод на скидку Промокод скопирован в буфер обмена ПП2302 Выбрать курс Все курсы профессиональной переподготовки
Видео:ЩЕЛОЧНОЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать
Кислородосодержащие Углеводороды.
Кислородосодержащие углеводороды.
Спирты и фенолы.
Контрольная работа 90минут.
Вариант №2
1. Напишите структурные формулы изомерных фенолов и ароматических спиртов состава С8Н10О.
2. По какой причине, при каких условиях могут реагировать между собой одноатомные спирты? Какие вещества при этом образуются? Напишите уравнения реакции.
3. Напишите уравнение реакций щелочного гидролиза следующих соединений:
а) Хлорбензол; б) О-нитрохлорбензол; в) 2,4,6-тринитрохлорбензол. Назовите продукты реакций.
4. Составьте уравнения и назовите продукты реакции.
5. Для сжигания 50мл метанола (p=0,80 г/мл) необходим воздух объёмом:
а) 150мл; б)200мл; в)250мл; г)180мл.
6. 14г смеси ароматического углеводорода, являющегося гомологом бензола, и фенола обработали бромной водой, при этом выпало 33,1г осадка (растворимостью пренебречь). Определить структурную формулу ароматического углеводорода, если известно, что его в исходной смеси находилось 0,05 моль.
Кислородосодержащие органические вещества: спирты, фенолы.
Контрольная работа 90 мин.
Вариант №8.
1. Молекула этанола содержит атомы углерода в следующем виде гибридизации:
1) Sp 3 2) Sp 2 3)Sp 4)Sp и Sp 3
2. Изомерами предельных одноатомных спиртов являются:
4) предельные одноосновные кислоты;
3. При нагревании метанола с концентрированной серной кислотой получается:
4. Найдите соответствие между реагентами и органическими продуктами реакции.
| 1) Кумол и кислород | А. 1,2-дибромэтан |
| 2) Этанол и натрий | Б. 1,1-дибромэтан |
| 3) Глицерин и избыток азотной кислоты | В. Этаноат натрия |
| 4) Этиленгликоль и избыток бромоводорода | Г. Этилат натрия |
| Д. тринитроглицерин | |
| Е. фенол и ацетон | |
| Ж. тринитропропан |
5. Установите молекулярную формулу предельного трехатомного спирта, массовая доля водорода в котором составляет 10%.
6. При действии избытка натрия на смесь этанола и фенола выделилось 6,72 л водорода (н.у.). Для полной нейтрализации этой же смеси потребовался раствор объемом 25 мл (р=1,4 г/мл) с массовой долей гидроксида калия 40%. Определите массовые доли веществ в исходной смеси. (59,3% фенола; 40,7% этанола)
Кислородосодержащие органические вещества: спирты, фенолы.
Контрольная работа 90 мин.
Вариант №6.
1. В двух пробирках находится этиловый спирт и этиленгликоль. Как можно различить эти вещества?
2. Наличие функциональной группы в молекулах спиртов не влияет на:
1)Растворимость в воде;
2)Строение углеводородного радикала;
4)Характерные химические свойства;
3. Найдите соответствие между названием спирта и способом его получения:
| Способ получения | Название продукта |
| 1.Восстановление пропаналя | А.Этанол |
| 2.Гидратация пропена | Б.Этиленгликоль |
| 3.Окисление этилена раствором перманганата калия | В.Пропанол — 1 |
| 4.Гидролиз бромэтана | Г.Пропанол — 2 |
4. Составьте уравнения реакций в соответствии со схемой превращений:
Назовите вещества X1 – X4.
5. При сжигании 156г смеси метанола с этанолом образовалось 134,4 л (н.у) оксида углерода (IV). Вычислите количество вещества каждого спирта в исходной
6. Для полной нейтрализации смеси фенола и уксусной кислоты требуется 46,8 мл 20% — ного по массе раствора гидроксида калия плотностью 1,2 г/мл.
При взаимодействии этой же смеси с бромной водой образуется 33,1 г осадка. Определите массовые доли уксусной кислоты и фенола в исходной смеси.
Кислородосодержащие органические соединения.
Спирты, фенолы.
Контрольная работа. 90мин.
Вариант 13.
- Молекула этанола содержит атомы углерода в следующем виде гибридизации:
1) SP³ 2) SP² 3) SP 4) SP и SP³
- Гомологи этанола является:
1) бензиловый спирт 2) виниловый спирт
3) древесный спирт 4) этиленгликоль
- Этанол может реагировать с:
А. водородом Г. гидроксидом меди
Б. натрием Д. бромоводородом
В. гидроксидом натрия Е. гидроксидом меди
- В результате следующих превращений:
Образуется конечный продукт (х5):
А. глицерат меди В. фенолят меди
Б. гликолят меди Г. этилат меди
- Сколько литров воздуха потребуется для полного сгорания 2,3г этанола (считать объемную долю кислорода в воздухе 20%)? Ответ приведите с точностью до десятых
- Определите молекулярную формулу предельного одноатомного спирта, зная, что 18,5г его в реакции с некоторым щелочным металлом выделят 2,8л водорода (н.у.)
Кислородосодержащие Углеводороды.
🎥 Видео
Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз солей | ХимияСкачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

11 класс. Гидролиз солей.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Электролиз. 10 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Гидролиз солейСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Химия | ГидролизСкачать