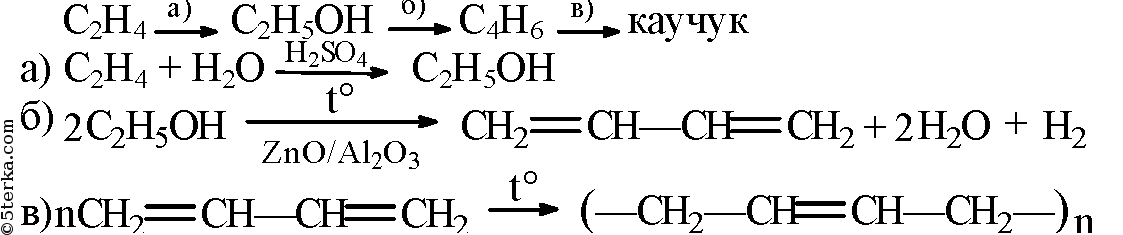- 2. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: С2Н4 → С2Н5ОН → С4Н6
- Напишите уравнение реакций, при помощи которых можно осуществить превращения по схеме C2H5OH — C2H4 — C2H6 — C2H5CL?
- Напишите уравнение реакции с помощью которых можно осуществить след превращения?
- Напишите уравнение реакций с помощью которых можно осуществить превращения?
- Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращения?
- Напишите уравнения реакций с помощью которых можно осуществить превращения по схеме 1 2 С — — — — СН4 — — — — СН3Br?
- Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения ?
- Напишите уравнения реакций , при помощи которых можно осуществить превращения ?
- Напишите уравнения реакций, при помощи которых можно осуществить превращения?
- Напишите уравнения реакций с помощью которых можно осуществить превращения по схеме Дать название исходных веществ и продуктов реакции?
- Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения ?
- Напишите уравнение реакции с помощью которых можно осуществить превращения по схеме CaC2 — C2H2?
- Ответы на контрольную работу по теме «Органические вещества»(Габриелян)
- Основные разделы
- Контрольные работы
- Ответы на контрольную работу по теме «Органические вещества»(Габриелян)
- 🎦 Видео
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

2. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения: С2Н4 → С2Н5ОН → С4Н6

задача №2
к главе «Тема III. Непредельные углеводороды (алкены, алкадиены и алкины). Работа 3 Диеновые углеводороды. Природный каучук. Вариант 1».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Напишите уравнение реакций, при помощи которых можно осуществить превращения по схеме C2H5OH — C2H4 — C2H6 — C2H5CL?
Химия | 10 — 11 классы
Напишите уравнение реакций, при помощи которых можно осуществить превращения по схеме C2H5OH — C2H4 — C2H6 — C2H5CL.
С2Н5ОН — — > ; СН2 = СН2 + Н2 при t> ; 140, H2SO4
CH2 = CH2 + H2 — — > ; CH3 — CH3 при t и катализатор
СН3 — СН3 + Cl2 — — > ; CH3 — CH2 — Cl + HCl на свету.
Видео:Решение цепочек превращений по химииСкачать

Напишите уравнение реакции с помощью которых можно осуществить след превращения?
Напишите уравнение реакции с помощью которых можно осуществить след превращения.
Укажите условия их протекания : СН4 — СНСI — CH3OH — CHOH — HCOOH.
Видео:8 КЛАСС | Как решать ЦЕПОЧКИ ХИМИЧЕСКИХ РЕАКЦИЙ | Цепочки превращенийСкачать

Напишите уравнение реакций с помощью которых можно осуществить превращения?
Напишите уравнение реакций с помощью которых можно осуществить превращения.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращения?
Напишите уравнения реакций, с помощью которых можно осуществить цепочку превращения.
CaO → CaC2 → C2H2 → C2H3Cl → (–CHCl–CH2–)n.
Видео:Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Напишите уравнения реакций с помощью которых можно осуществить превращения по схеме 1 2 С — — — — СН4 — — — — СН3Br?
Напишите уравнения реакций с помощью которых можно осуществить превращения по схеме 1 2 С — — — — СН4 — — — — СН3Br.
Видео:Химические Цепочки — Решение Цепочек Химических Превращений // Химия 8 классСкачать

Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения ?
Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения :
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Напишите уравнения реакций , при помощи которых можно осуществить превращения ?
Напишите уравнения реакций , при помощи которых можно осуществить превращения :
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите уравнения реакций, при помощи которых можно осуществить превращения?
Напишите уравнения реакций, при помощи которых можно осуществить превращения.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Напишите уравнения реакций с помощью которых можно осуществить превращения по схеме Дать название исходных веществ и продуктов реакции?
Напишите уравнения реакций с помощью которых можно осуществить превращения по схеме Дать название исходных веществ и продуктов реакции.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения ?
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения :
Видео:8 класс. Цепочки превращений. Генетические ряды.Скачать

Напишите уравнение реакции с помощью которых можно осуществить превращения по схеме CaC2 — C2H2?
Напишите уравнение реакции с помощью которых можно осуществить превращения по схеме CaC2 — C2H2.
На этой странице находится ответ на вопрос Напишите уравнение реакций, при помощи которых можно осуществить превращения по схеме C2H5OH — C2H4 — C2H6 — C2H5CL?, из категории Химия, соответствующий программе для 10 — 11 классов. Чтобы посмотреть другие ответы воспользуйтесь «умным поиском»: с помощью ключевых слов подберите похожие вопросы и ответы в категории Химия. Ответ, полностью соответствующий критериям вашего поиска, можно найти с помощью простого интерфейса: нажмите кнопку вверху страницы и сформулируйте вопрос иначе. Обратите внимание на варианты ответов других пользователей, которые можно не только просмотреть, но и прокомментировать.
Решение есть на фотографии.
N = m / M m = n * M m (Na2O) = 1, 5 моль * 62 г / моль = 93 г.
Считаем конечную массу раствора m = 125 + 50 = 175 г Считаем массу кислоты в первом растворе m = w * m(раствора) = 0. 12 * 50 = 6 г Масса кислоты не менялась Считаем массовую долю кислоты в конечном растворе w = m(H2SO4) / m(раствора) = 6 / 175 = 0.
MgSO4 + 2KOH — — >Mg(OH)2↓ + K2SO4 Mg⁺² + SO⁻²₄ + 2K⁺ + 2OH⁻ — — >Mg(OH)2↓ + 2K⁺ + SO⁻²₄ Mg⁺² + 2OH⁻ — — >Mg(OH)2↓ AgNO3 + HCL — — >AgCL↓ + HNO3 Ag⁺ + NO⁻₃ + H⁺ + CL⁻ — — >AgCL↓ + H⁺ + NO⁻₃ Ag⁺ + CL⁻ — — >AgCL↓ FeS + 2HCL — — >H2S↑ + FeCL2 Fe⁺² + S⁻²..
А) MgSo4 + 2KOH = Mg(OH)2↓ + K2SO4 б)AgNO3 + HCl = AgCl↓ + HNO3 в)FeS + 2HCl = FeCl2 + H2S↑ г)Ba(OH)2 + FeSO4 = Fe(OH)2↓ + BaSO4↓.
Могу лишь написать их образование и среду, может чем — то поможет : 1. BaSO4 образован сильным основанием Ва(ОН)2 и сильной кислотой H2SO4, среда нейтральная, гидролизу не подвергается. 2. MgCO3 образован слабым основанием Mg(OH)2 и слабой кислотой..
Реакция электролиза хлорида калия : 2KCl = 2K + Cl2⬆️ Масса примесей : m(прим. ) = 150г * 0, 1 = 15 г Масса чистого хлорида калия : m (KCl) = 150г — 15г = 135г Масса калия : m(K) = (40 г / моль * 2 * 135г) : (75, 5 г / моль * 2) = 68, 79г.
Мед — ? 25×100 = 2500 2500÷6. 25 = 400 руд.
У них у всех не металлическое а все остальное есть в табл. Менделеева.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Ответы на контрольную работу по теме «Органические вещества»(Габриелян)
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Основные разделы
Видео:Уравнивание реакций горения углеводородовСкачать

Контрольные работы
Видео:Химия | Молекулярные и ионные уравненияСкачать

Ответы на контрольную работу по теме «Органические вещества»(Габриелян)
- Post category:Контрольные работы по химии 9 класс
- Reading time: 14 минут чтения
ЗАДАНИЕ 1
Даны формулы веществ:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества А и Ж.
Напишите структурные формулы веществ Б и 3.
А спирты. Метанол
Б алканы. СН3-СН2-СН3
В алкены
Г углеводы
Д аминокислоты
Е арены
Ж альдегиды. Этаналь
З карбоновые кислоты
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СН3—СН2—СН3 → СН2=СН—СН3 → СО2.
Назовите все вещества в цепочке.
СН3-СН2-СН3 → СН2=СН-СН3 + Н2 (пропан – пропен)
2СН2=СН-СН3 + 9О2→ 6СО2 + 6Н2О (пропен – углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу уксусной кислоты. Опишите применение этого вещества в быту и промышленности.
СН3СООН
Применение в промышленности. Растворитель при производстве лаков, красок; реагент для получения сложных эфиров. Используется для переведения целлюлозы в раствор (получение ацетата целлюлозы) , для растворения некоторых полимеров (например, хитозана) ; в орг. синтезе. В пищевой промышленности — добавка Е260 — консервант. Можно использовать для получения уксусного ангидрида, который используется в орг синтезе. Также для приготовления буферных растворов (уксусный буфер) или просто для подкисления среды.
Применение в быту. Столовый уксус — 9%, уксусная эссенция — 80%. В малых количествах приправа к блюдам. Также для дезинфекции, удаления накипи с чайника; как очищающее средство, для создания запаха.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества Б и Е.
Напишите структурные формулы веществ Б и Ж.
А алкины
Н-С≡С-Н
Б алканы, метан
В спирты
Г альдегиды
Д сл.эфиры
Е алкены, этилен
Ж алканы
З карбоновые кислоты
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений: СН3—СН2—ОН → СН2=СН2 → С02.
Назовите все вещества в цепочке.
2. С2Н4 + 3О2 = 2СО2 + 2Н2О (этилен – углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу этилового спирта. Опишите применение этого вещества в быту и промышленности.
С2H5OH
Применение:
Топливо; сырьё для получения многих химических веществ, растворитель, компонент антифризов и стеклоомывателей; в бытовой химии этанол применяется в чистящих и моющих средствах, в особенности для ухода за стеклом и сантехникой; в медицине – антисептик, растворитель, консервант, противоядие и др. В быту: наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Применяется для фиксирования и консервирования биологических препаратов.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества Г и Е.
Напишите структурные формулы веществ А и Д.
Б алкины
В многоатомные спирты
Г карбоновые кислоты, уксусная кислота
Д алкены
Е спирты, этанол
Ж полиолефины
З алканы
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
С2Н4 —> С2Н6 —> С2Н5Сl.
Назовите все вещества в цепочке.
С2Н4 + Н2 → С2Н6 (этилен – этан)
CH3CH3+Cl2→CH3CH2Cl +HCl (этан – хлорэтан)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу пропана. Опишите применение этого вещества в быту и промышленности.
C3H8
Топливо
При выполнении газопламенных работ на заводах и предприятиях:
в заготовительном производстве;
для резки металлолома;
для сварки неответственных металлоконструкций.
При кровельных работах.
При дорожных работах для разогрева битума и асфальта.
В качестве топлива для переносных электрогенераторов.
Для обогрева производственных помещений в строительстве.
Для обогрева производственных помещений (на фермах, птицефабриках, в теплицах).
Для газовых плит, водогрейных колонок в пищевой промышленности.
В быту:
при приготовлении пищи в домашних и походных условиях;
для подогрева воды;
для сезонного обогрева отдалённых помещений — частных домов, отелей, ферм;
для сварки труб, теплиц, гаражей и других хозяйственных конструкций с использованием газосварочных постов.
В последнее время широко используется в качестве автомобильного топлива, так как дешевле и экологически безопаснее бензина.
В химической промышленности используется для получения пропилена, сырья для производства полипропилена.
Является исходным сырьём для производства растворителей.
В пищевой промышленности пропан зарегистрирован в качестве пищевой добавки E944.
Хладагент.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите вещества А и Г.
Напишите структурные формулы веществ А и Г.
А алканы, пентан
Б многоатомные спирты
В алкены
Г спирты, метанол
Д альдегиды
Е сложные эфиры
Ж карбоновые кислоты
З алкены
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
С2Н5ОН → СН2=СН2 → хлорэтан.
Назовите все вещества в цепочке.
C2H4+HCl→C2H5Cl (этилен – хлорэтан)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу ацетилена. Опишите применение этого вещества в быту и промышленности.
Структурная формула ацетилена H–C≡C–H
Ацетилен широко применяют в органическом синтезе. Он является одним из исходных веществ при производстве синтетических каучуков, поливинилхлорида и других полимеров. Из ацетилена получают уксусную кислоту, растворители (1,1,2,2-тетрахлорэтан и 1,1,2-трихлорэтен). При сжигании ацетилена в кислороде температура пламени достигает 3150 °С, поэтому его используют при сварке и резке металлов.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ А и 3.
А спирты, метанол
Б алканы, пропан
В алкены, пропен
Г углеводы, сахароза
Д аминокислоты, глицин
Е арены, бензол
Ж альдегиды, этаналь
З карбоновые кислоты, уксусная кислота
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
Укажите условия протекания реакций. Назовите все вещества в цепочке.
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу этилена. Опишите применение этого вещества в быту и промышленности.
C2Н4
Этилен является одним из базовых продуктов промышленной химии и стоит в основании ряда цепочек синтеза. Основное направление использования этилена — в качестве мономера при получении полиэтилена Этилен — исходное соединение для получения полиэтилена высокого и низкого давления и олигомеров этилена, являющихся основой ряда синтетических смазочных масел. Этилен применяют как исходный материал для производства ацетальдегида и синтетического этилового спирта. Также он используется для синтеза этилацетата, стирола, винилацетата, хлористого винила; при производстве 1,2-дихлорэтана, хлористого этила.
Этилен используют для ускорения созревания плодов — например, помидоров, дынь, апельсинов, мандаринов, лимонов, бананов; дефолиации растений, снижения предуборочного опадения плодов, для уменьшения прочности прикрепления плодов к материнским растениям, что облегчает механизированную уборку урожая.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ В и Д.
А алкины, ацетилен
Б алканы, метан
В спирты, этанол
Г альдегиды, метаналь
Ж сл.эфиры, метилэтаноат
Е алкены, этилен
Ж углеводы, глюкозы
З карбоновые кислоты, муравьиная (метановая)
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
Укажите условия протекания реакций. Назовите все вещества в цепочке.
CH3CHO+H2 (температура, Ni) -> CH3CH2OH (этанол)
5C2H5OH + 4KMnO4 + 6H2SO4 → 5CH3COOH (уксусная кислота) + 2K2SO4 + 4MnSO4 + 11H2O
CH3COOH + NaOH → CH3COONa (ацетат натрия)+ H2O
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу этиленгликоля. Опишите применение этого вещества в быту и промышленности.
HO—CH₂—CH₂—OH
Этиленгликоль – для производства лавсана и для приготовления антифризов — водных растворов, замерзающих значительно ниже 0°С (использование их для охлаждения двигателей позволяет автомобилям работать в зимнее время) В производстве целлофана, полиуретанов и ряда других полимеров. Как растворитель красящих веществ;
В органическом синтезе. Этиленгликоль является исходным сырьём для производства взрывчатого вещества нитрогликоля. Этиленгликоль также применяется: при производстве конденсаторов, при производстве 1,4-диоксана, как теплоноситель в системах чиллер-фанкойл, в качестве компонента крема для обуви (1—2 %), в составе для мытья стёкол вместе с изопропиловым спиртом.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ Е и 3.
А алканы, этан
Б алкины, ацетилен
В многоатомные спирты, этиленгликоль
Г карбоновые кислоты, уксусная кислота
Д алкены, этилен
Е спирты, этанол
Ж полиолефины, полиэтилен
З алканы
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СН≡СН→ СН2=СН2→ С2Н5ОН→ СО2.
Укажите условия протекания реакций. Назовите все вещества в цепочке.
СН≡СН + Н2 (платина, темп.) →СН2=СН2 (ацетилен – этилен)
CH2=CH2 + H2O t,H3PO4→ CH3-CH2-OH (этанол – этиловый спирт)
C2H5OH+3O2(горение) =3H2O+2CO2 (этанол – вода и углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу сахарозы. Опишите применение этого вещества в быту и промышленности.
С12Н22О11
Сахароза находит многочисленное применение и в первую очередь как пищевой продукт — сахар. Она также служит в качестве исходного вещества в различных ферментационных процессах получения этилового спирта, глицерина, лимонной кислоты. Применяется также для изготовления лекарств.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы веществ Д и 3.
А алканы, пентан
Б многоатомные спирты, глицерин
В алкены, бутен-1
Г спирты, метанол
Д альдегиды, этаналь
Е сл.эфиры, этилэтаноат (этилацетат)
Ж высшие карбоновые кислоты, стеариновая кислота
З алканы, пропен
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
С2Н5ОН→ CH3COH→ СН3СООН→ CH3COONa.
Укажите условия протекания реакций. Назовите все вещества в цепочке.
CH3-CHО + KMnO4 + H2SO4 = CH3-COOH + MnSO4+ K2SO4 + H2O (ацетальдегид – уксусная кислота)
CH3COOH + NaOH → CH3COONa (ацетат натрия)+ H2O
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу муравьиного альдегида. Опишите применение этого вещества в быту и промышленности.
СН2О метаналь, применяется в качестве дубителя в кожевенном производстве и дубления желатина при производстве кинофотоплёнки. Из-за сильного дубящего эффекта формальдегид является также сильным антисептиком, это свойство формалина используется в медицине (формидрон и подобные препараты) и для консервации биологических материалов (создание анатомических и других препаратов). Водный раствор формальдегида (метандиол), стабилизированный карбамидом, — КФК — является одним из важнейших источников формальдегида и карбамида в производстве карбамидоформальдегидных, меламинокарбамидоформальдегидных смол и для обработки карбамида против слеживаемости; применяется в деревообрабатывающей и мебельной промышленности для производства фанеры, ДСП и т. д.
Основная часть формальдегида идёт на изготовление полимеров-реактопластов (фенолформальдегидные, карбамидформальдегидные и меламинформальдегидные смолы), он широко используется также в промышленном органическом синтезе (пентаэритрит, триметилолпропан и т. д.). В пищевой промышленности зарегистрирован под кодом E240. Допускается применение формальдегида в качестве консерванта в количестве до 0,1 % в составе косметических средств, предназначенных для гигиены полости рта, и до 0,2 % в прочих косметических препаратах.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ Б и Ж.
А спирты, метанол
Б алканы, пропан. Гомологи:
В аминокислоты, глицин (аминоуксусная кислота)
Г арены, бензол
Д алкены, пропен
Е дисахариды, сахароза
Ж альдегиды, этаналь
З карбоновые кислоты, уксусная кислота
Гомологи:
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СН4→ С02→ С6Н1206 → СН3—СН2—ОН→ СН2=СН2.
Назовите все вещества в цепочке. Укажите условия проведения реакций.
CH4+2O2(горение)=CO2+2H2O (метан – углекислый газ)
6CO2 + 6H2O hν, хлорофилл → C6H12O6 + 6O2 (углекислый газ и вода – глюкоза и кислород)
C6H12O6 дрожжи → 2C2H5OH + 2CO2↑(глюкоза – этанол)
CH3CH2OH ⇄ CH2=CH2 + H2O (При сильном нагревании этанола с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия – дегидратация, обр.этилена).
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу глицерина. Опишите применение этого вещества в быту и промышленности.
HOCH2-СH(OH)-CH2OH
Глицерин широко используется в кожевенной, текстильной промышленности при отделке кож и тканей и в других областях народного хозяйства. Сорбит (шестиатомный спирт) используется как заменитель сахара для больных диабетом. Глицерин находит широкое применение в косметике, пищевой промышленности, фармакологии, производстве взрывчатых веществ. Чистый нитроглицерин взрывается даже при слабом ударе; он служит сырьем для получения бездымных порохов и динамита ― взрывчатого вещества, которое в отличие от нитроглицерина можно безопасно бросать. Динамит был изобретен Нобелем, который основал известную всему миру Нобелевскую премию за выдающиеся научные достижения в области физики, химии, медицины и экономики. Нитроглицерин токсичен, но в малых количествах служит лекарством, так как расширяет сердечные сосуды и тем самым улучшает кровоснабжение сердечной мышцы.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ А и Г.
А алкины, ацетилен
Гомологи:
Пропин
Б алканы, метан
В спирты, этанол
Г альдегиды, метаналь
Гомологи:
Этаналь
Д сл.эфиры, метилэтаноат(метилацетат)
Е алкены, этилен
Ж углеводы, глюкоза
З карбоновые кислоты, муравьиная (метановая) кислота.
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку следующих превращений:
Укажите условия протекания реакций. Назовите все вещества в цепочке.
CH3-CHО + KMnO4 + H2SO4 = CH3-COOH + MnSO4+ K2SO4 + H2O (ацетальдегид – уксусная кислота)
CH3-COOH + Cl2 (Уф-облучение) = HCl + CH2Cl-COOH
CH2Cl-COOH + NH3 (газ) = HCl + CH2(NH2)-COOH (глицин, или аминоуксусная кислота)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу глюкозы. Опишите применение этого вещества в быту и промышленности.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
C6H12O6 + 6O2 → 6H2O + 6CO2 + 2800 кДж
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ Е и 3.
А алканы, этан
Б алкины, ацетилен
В многатомные спирты, этиленгликоль
Г карбоновые кислоты, уксусная кислота
Д алкены, этилен
Е спирты, этанол
Гомологи:
Метанол
Ж полиолефины, полиэтилен
З алканы, бутан.
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку следующих превращений:
С6Н12О6 → С2Н5ОН→ С2Н4→ С2Н2 → СО2.
Назовите все вещества в цепочке. Укажите условия протекания реакций.
C6H12O6 дрожжи → 2C2H5OH + 2CO2↑(глюкоза – этанол и углекислый газ)
CH3CH2OH ⇄ CH2=CH2 + H2O (При сильном нагревании этанола с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия – дегидратация, обр.этилена)
C2H4 -> (t, Ni) -> C2H2 + H2 (этилен – ацетилен)
2СН ≡ СН + 5О2 горение→ 4СО2 + 2Н2О (ацетилен – углекислый газ)
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу крахмала. Опишите применение этого вещества в быту и промышленности.
В пищевой промышленности крахмал используется для получения глюкозы, патоки, этанола, в текстильной — для обработки тканей, в бумажной — в качестве наполнителя. Кроме того, крахмал входит в состав большинства колбас, майонеза, кетчупа и пр. В мире наибольшее применение крахмал нашёл в целлюлозно-бумажной промышленности, насчитывая миллионы метрических тонн ежегодно. Модифицированный крахмал является основным компонентом клея для обоев. Применяется в фармацевтической промышленности в качестве наполнителя таблетированных форм лекарственных препаратов, некоторых лекарственных капсул, декстраны (декстрины) используются для приготовления ряда инфузионных растворов для внутривенных вливаний (гемодез, полиглюкин, реополиглюкин и т. д.).
Крахмал используется для накрахмаливания предметов одежды: воротников, халатов и т. д. Крахмальный клейстер применяется для приклеивания обоев, изготовления папье-маше. Иногда крахмал используется в качестве присыпок.
ЗАДАНИЕ 1
Даны вещества:
К какому классу соединений принадлежит каждое из этих веществ?
Назовите все вещества.
Напишите структурные формулы двух гомологов для веществ А и Г.
А алканы, пентан
Гомологи:
Б многоатомные спирты, глицерин
В алкены, бутен-1
Г спирты, метанол
Гомологи:
Д альдегиды, этаналь
Е сл.эфиры, этилацетат
Ж карбоновые кислоты, стеариновая кислота
З алкены, пропен
ЗАДАНИЕ 2
Запишите уравнения реакций, с помощью которых можно осуществить цепочку превращений:
СаС2→ С2Н2→ С2Н4→ С2Н5ОН → С02.
Назовите все вещества в цепочке. Укажите условия протекания реакций.
CaC2 + 2H2O → Ca(OH)2 + C2H2 (карбид кальция – ацетилен)
СН≡СН + Н2 (платина, темпер.)→СН2=СН2 (ацетилен – этилен)
CH2=CH2 + H2O (H2SO4)→ C2H5OH (этилен – этанол)
C2H5OH + 3O2→2CO2+3 H2O горение этанола
ЗАДАНИЕ 3 (дополнительное)
Напишите формулу уксусной кислоты. Опишите применение этого вещества в быту и в промышленности.
70-80 % водный раствор уксусной кислоты называют уксусной эссенцией, а 3-9 % — уксусом. Водные растворы уксусной кислоты широко используются в пищевой промышленности (пищевая добавка E260) и бытовой кулинарии, а также в консервировании.
Уксусную кислоту применяют для получения лекарственных и душистых веществ, как растворитель (например, в производстве ацетилцеллюлозы, ацетона). Она используется в книгопечатании и крашении
Уксусная кислота используется как реакционная среда для проведения окисления различных органических веществ. В лабораторных условиях это, например, окисление органических сульфидов пероксидом водорода, в промышленности — окисление пара-ксилола кислородом воздуха в терефталевую кислоту.
Поскольку пары уксусной кислоты обладают резким раздражающим запахом, возможно её применение в медицинских целях в качестве замены нашатырного спирта для выведения больного из обморочного состояния.
Пары уксусной кислоты раздражают слизистые оболочки верхних дыхательных путей.Опасными считаются растворы, в которых концентрация кислоты превышает 30 %. Концентрированная уксусная кислота способна вызывать химические ожоги. Токсикологические свойства уксусной кислоты не зависят от способа, которым она была получена. Смертельная доза составляет примерно 20 мл.
🎦 Видео
Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Как решать Диофантовы уравнения ★ 9x+13y=-1 ★ Решите уравнение в целых числахСкачать

Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Установление эмпирической и молек. формул по массовым долям элем., входящих в состав в-ва. 10 класс.Скачать