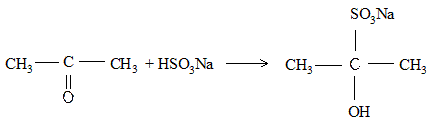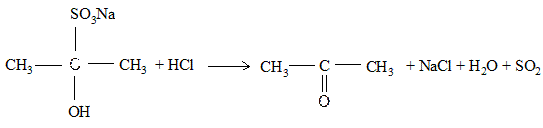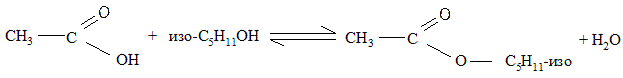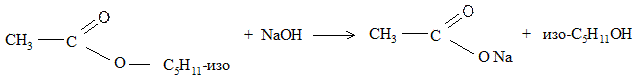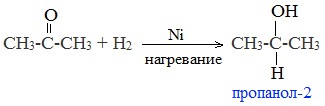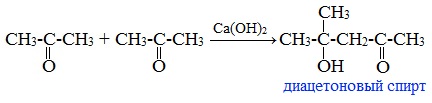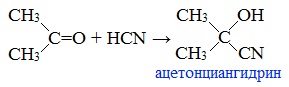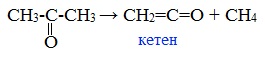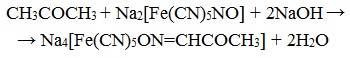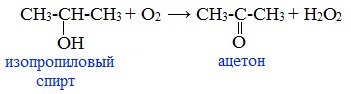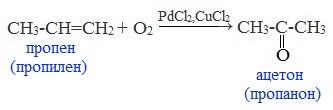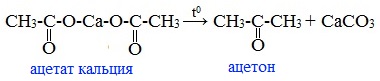Реактивы, материалы и приборы: ацетон, насыщенный раствор гидросульфита натрия, 2 Н раствор соляной кислоты, предметное стекло, запаянный капилляр, микроскоп.
На предметное стекло наносят 2 капли насыщенного раствора гидросульфита натрия, добавляют 1 каплю ацетона и размешивают концом запаянного капилляра. Вскоре начинают выпадать кристаллы гидросульфитного соединения ацетона. Предметное стекло переносят под микроскоп и рассматривают кристаллы. Кристаллы гидросульфитного соединения представляют собой четырехугольники неправильной формы.
Альдегиды и алифатические метилкетоны реагируют с гидросульфитом натрия с образованием кристаллических гидросульфитных соединений, которые являются натриевыми солями оксисульфокислот.
К полученным кристаллам добавляют 1 каплю соляной кислоты — осадок растворяется и выделяются исходные карбонильные соединения.
Выводы:
Вопросы для самоконтроля:
1. Напишите уравнение реакции пентандиона-2,4 с 1 и 2 молями фенилгидразина.
2. Объясните, почему самым активным в карбонильных соединениях является α-атом водорода. Напишите уравнение реакции пропаналя с бромом.
3. Предложите реакцию, которая легко позволяет отличить альдегид от кетона.
ЛАБОРАТОРНАЯ РАБОТА №9
КАЧЕСТВЕННЫЙ ФУНКЦИОНАЛЬНЫЙ АНАЛИЗ
Карбоксильная группа
Общая постановка задачи: освоить методику определения карбоксильной группы в органических соединениях с помощью химических реакций.
Оборудование и реактивы:
2. Насыщенный водный раствор гидрокарбоната натрия
3. 5%-ный водный раствор щелочи (NaOH)
4. Концентрированные водные растворы нитрата свинца (II) или нитрата серебра
5. Растворы карбоновых кислот (муравьиной и уксусной) – 10%-ный и 50%-ный
6. Универсальная индикаторная бумага
Задание 1. Взаимодействие карбоновой кислоты с гидрокарбонатом натрия.
Наблюдения записывают в виде уравнений реакций:
Задание 2. Определение кислотности карбоновых кислот.
Наблюдения записывают в виде уравнений реакций и значений рН испытуемых кислот:
Задание 3. Получение нерастворимых солей свинца или серебра.
Обратите внимание, что при выполнении реакции по получению нерастворимых солей карбоновых кислот не следует наливать слишком много щёлочи. Рекомендуется брать разбавленную щёлочь и добавлять её по каплям, поскольку щёлочь может образовывать нерастворимые осадки с нитратом свинца или серебра.
Наблюдения записывают в виде уравнений реакций:
Задание 4. Растворимость в воде различных кислот.
Реактивы: муравьиная, уксусная, масляная, щавелевая, стеариновая кислоты.
3 капли или несколько кристалликов каждой из кислот взбалтывают в пробирке с 5 каплями воды. Если кислота не растворяется, пробирку нагревают.
Горячие растворы охлаждают и отмечают выделение кристаллов некоторых плохо растворимых кислот.
Задание 5. Образование и гидролиз сложного эфира.
Реактивы, материалы и приборы: изоамиловый спирт, ледяная уксусная кислота, серная кислота (плотность 1,84), 2н раствор серной кислоты, насыщенный раствор хлорида натрия, концентрированный раствор гидроксида натрия, водяная баня, пипетка.
Смешивают в двух пробирках по 5 капель уксусной кислоты и изоамилового спирта. В одну пробирку осторожно приливают 1 каплю концентрированной серной кислоты. Встряхнув пробирки, помещают их на 10 минут в горячую (но не кипящую) водяную баню.
Затем охлаждают обе пробирки в холодной воде и добавляют в каждую по 5 капель воды. Отмечают запах образовавшегося сложного эфира. Затем добавляют в каждую по 5 капель насыщенного раствора хлорида натрия и наблюдают изменение объема эфирного слоя.
Пипеткой осторожно снимают слой образовавшегося эфира и сливают по 2 капли эфира в 3 чистые пробирки. В эти пробирки добавляют по 4-5 капель воды и приливают в одну — 2 капли 2н серной кислоты, во вторую — 2 капли концентрированного раствора гидроксида натрия. Пробирки нагревают на водяной бане и отмечают различие в скорости исчезновения капель эфира и его запаха.
Гидролиз эфира быстрее происходит в присутствии щелочи, которая связывает образующуюся при гидролизе кислоту:
Задание 6. Растворимость и обменные реакции мыла.
Реактивы и материалы: мыло хозяйственное, 0,1 Н раствор хлорида кальция, 0,1 Н раствор ацетата свинца, 0,01 Н раствор сульфата меди.
В пробирку помещают около 10 мг твердого мыла, добавляют 10 капель воды и тщательно взбалтывают 1-2 минуты. Затем содержимое пробирки нагревают в пламени горелки. При нагревании мыло растворяется быстрее. Раствор мыла используют для обменных реакций. Для этого в 3 пробирки помещают по 3 капли раствора мыла и добавляют в одну пробирку 2 капли раствора хлорида кальция, в другую — 2 капли раствора ацетата свинца, в третью — 2 капли раствора сульфата меди.
Наблюдают выпадение осадков нерастворимых мыл.
Мыла — соли высших предельных и непредельных органических кислот.
Задание 7. Гидролиз мыла.
Реактивы и материалы: мыло, этиловый спирт, 1%-ный спиртовой раствор фенолфталеина.
В сухую пробирку помещают кусочек мыла, 4 капли спирта и энергично взбалтывают, затем добавляют 1 каплю фенолфталеина.
Окраска раствора не меняется. Затем к спиртовому раствору мыла добавляют по каплям воду. По мере прибавления воды появляется желтое окрашивание.
В результате гидролиза образуются малодиссоциированные карбоновые кислоты и едкий натр.
Выводы:
Вопросы для самоконтроля:
1. Объясните, почему при нанесении на индикаторную бумагу раствора бензойной кислоты окраска индикатора практически не меняется.
2. Объясните, чем отличается муравьиная кислота от остальных карбоновых кислот; подтвердите уравнениями реакций.
3. Объясните, как влияет длина углеродного скелета карбоновой кислоты на ее кислотные свойства.
4. Объясните, почему самым активным в карбоновых кислотах является α-атом водорода.
- ПРАКТИЧЕСКАЯ РАБОТА № 4 Альдегиды и кетоны.
- Напишите уравнение реакции взаимодействия ацетона с гидросульфитом натрия и наблюдения
- Физические свойства
- Токсичность ацетона
- Химические свойства
- Получение
- Применение
- Присоединение гидросульфита натрия
- Готовые работы на аналогичную тему
- Применение гидросульфитных производных карбонильных соединений
- Присоединение гидрид-аниона
- Присоединение галогенид-ионов
- 🎬 Видео
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

ПРАКТИЧЕСКАЯ РАБОТА № 4 Альдегиды и кетоны.
Обращаем Ваше внимание, что в соответствии с Федеральным законом N 273-ФЗ «Об образовании в Российской Федерации» в организациях, осуществляющих образовательную деятельность, организовывается обучение и воспитание обучающихся с ОВЗ как совместно с другими обучающимися, так и в отдельных классах или группах.
Рабочие листы и материалы для учителей и воспитателей
Более 2 500 дидактических материалов для школьного и домашнего обучения
311 лекций для учителей,
воспитателей и психологов
Получите свидетельство
о просмотре прямо сейчас!
Цель работы: 1. Получить уксусный альдегид.
2. Изучить химические свойства альдегидов и кетонов и объяснить, чем они обусловлены.
Оборудование и реактивы: пробирки, спиртовка, водяная баня, медная спираль, этиловый спирт, 5 % раствор К2 Cr 2О7, 20 % раствор серной кислоты, водный раствор формальдегида, свежеприготовленный аммиачный раствор оксида серебра ( I ), ацетон, раствор сульфата меди ( II ), раствор гидроксида натрия, свежеприготовленный концентрированный раствор гидросульфита натрия, фуксинсернистая кислота (для ее приготовления следует в 0,1-0,005 % водный раствор фуксина пропустить сернистый газ до обесцвечивания раствора. Сернистый газ получают нагреванием кусочков меди с концентрированной серной кислотой в круглодонной колбе. Полученный реактив хранят в хорошо закрытом сосуде в темноте. Чем меньший избыток сернистого газа соединится в реактиве, тем он чувствительнее).
ОПЫТ 1. Окисление этилового спирта оксидом меди ( II ).
Налейте в пробирку 3-4 мл этилового спирта, накалите медную спираль в пламени спиртовки так, чтобы медь покрылась черным налетом оксида меди ( II ), раскаленную спираль быстро опустите в пробирку со спиртом. Повторите эту операцию несколько раз. Обратите внимание на запах образующегося альдегида и на изменения, происходящие со спиралью.
Задания: 1. Напишите уравнения реакций окисления меди и окисления этилового спирта.
2. Запишите наблюдения.
ОПЫТ 2. Окисление этилового спирта хромовой смесью.
К 2 мл 5 % раствора К2 Cr 2О7 прилейте 1 мл 20 % раствора серной кислоты и 0,5 мл этилового спирта. Осторожно нагрейте на спиртовке полученную смесь. Что наблюдается? Какой ощущается запах?
Задания: 1. Напишите уравнение происходящей реакции.
2. Запишите наблюдения.
ОПЫТ 3. Взаимодействие формальдегида с аммиачным раствором оксида серебра ( I ) (реакция «серебряного зеркала»).
1 мл формальдегида налейте в чистую пробирку (вымытую щелочью, затем хромовой смесью и дистиллированной водой) и добавьте 1 мл свежеприготовленного аммиачного раствора оксида серебра. Смесь осторожно нагрейте на водяной бане. Что наблюдается? То же проделайте с ацетоном.
Задания: 1. Напишите уравнение реакции взаимодействия альдегида с аммиачным раствором оксида серебра и наблюдения изменений, происходящих в обеих пробирках.
2. Почему ацетон не вступил в реакцию окисления?
ОПЫТ 4. Окисление альдегидов свежеосажденным гидроксидом меди ( II ).
К 0,5 мл раствора сульфата меди ( II ) прилейте 1 мл раствора гидроксида натрия до образования осадка. Взболтайте и к полученной жидкости с осадком гидроксида меди ( II ) прилейте 5-10 капель формальдегида. Смесь нагрейте на водяной бане, наблюдая за изменением окраски. Аналогичную реакцию проведите с ацетоном.
Задание: Напишите уравнения реакций, происходящих в обеих пробирках, и соответствующие наблюдения.
ОПЫТ 5. Взаимодействие формальдегида с фуксинсернистой кислотой.
В пробирку поместите 0,5 мл раствора фуксинсернистой кислоты, добавьте 2-3 капли раствора формальдегида. Что наблюдается?
Запомните: фуксинсернистая кислота является чувствительным реактивом на альдегиды.
Задание: Запишите соответствующие наблюдения, уравнение реакции записывать не нужно.
ОПЫТ 6. Реакция ацетона с гидросульфитом натрия.
К 1-1,5 мл ацетона прибавьте, не взбалтывая, 1 мл концентрированного свежеприготовленного раствора гидросульфита натрия NaHSO 3 до образования осадка в виде кольца.
Задания: 1. Напишите уравнение реакции взаимодействия ацетона с гидросульфитом натрия и наблюдения.
2. Будут ли вступать в эту реакцию альдегиды?
Сделайте вывод о том, какие типы химических реакций характерны для альдегидов и кетонов, и объясните причины проявления ими данных свойств.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Напишите уравнение реакции взаимодействия ацетона с гидросульфитом натрия и наблюдения
Ацетон — простейший представитель насыщенных кетонов.
Физические свойства
Ацетон (пропанон-2, диметилкетон) СН3-СО-СН3 — летучая бесцветная жидкость с характерным запахом и температурой кипения 56 0 С.

Он хорошо растворяет многие органические вещества (жиры, смолы, ацетилцеллюлозу, воск, резину и др.), поэтому является незаменимым растворителем в быту и в лакокрасочной промышленности.
Ацетон встречается в организме человека. Он является промежуточным продуктом обмена веществ. Незначительное количество ацетона, образующееся в организме человека в результате метаболических реакций, выводится вместе с мочой. У больных диабетом следы ацетона можно обнаружить в выдыхаемом воздухе.
Один из простейших и в то же время важнейших из кетонов — ацетон — впервые выявлен в 1595 году немецким химиком Андреасом Либавием в процессе сухой перегонки ацетата свинца. Однако точно определить его природу и химический состав удалось только в 1832 году Жану-Батисту Дюма и Юстусу фон Либиху. До 1914 года ацетон получали практически исключительно коксованием древесины.
Токсичность ацетона
Ацетон обладает возбуждающим и наркотическим действием, поражает центральную нервную систему. Ацетон способен накапливаться в организме, т.к. медленно выводится из организма. Он может поступать в организм с вдыхаемым воздухом, а также через пищевой канал и кожу.
После поступления ацетона в кровь часть его переходит в головной мозг, селезенку, печень, поджелудочную железу, почки, легкие и сердце. Содержание ацетона в указанных органах несколько меньшее, чем в крови.
При вдыхании паров ацетона происходит кислородное голодание мозга. Поэтому, в помещениях, в которых происходит испарение ацетона, создается опасность отравления при вдыхании его паров.
Химические свойства
Ацетон является одним из наиболее реакционноспособных кетонов.
Ацетон, как и все кетоны, не дает реакции «серебряного зеркала», не полимеризуется. В этом его отличие от альдегидов.
1. Гидрирование (восстановление)
При тех же условиях, что и формальдегид, ацетон присоединят водород:
Водород присоединяется вследствие разрыва двойной связи карбонильной группы.
2. Взаимодействие с гидросульфитом натрия
Ацетон один из немногих кетонов образует бисульфитное соединение:
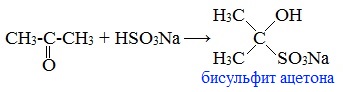
Под действием щелочей ацетон вступает в альдольную самоконденсацию, с образованием «ацетонового» (диацетонового) спирта:
4. Взаимодействие с синильной кислотой
Одной из наиболее важных реакций ацетона является присоединение к нему синильной кислоты с образованием ацетонциангидрина:
5. Пиролиз ацетона
При нагревании выше 500 0 C ацетон распадается на кетен и метан:
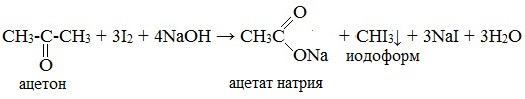
6. Галоформная реакция (иодоформная реакция, или проба Люголя)
Качественная реакция на ацетон!
При взаимодействии ацетона с избытком йода в щелочной среде образуется йодоформ – желтое вещество с характерным запахом:
Аналогичные реакции идут с хлором и бромом, но только реакция с йодом приводит к нерастворимому йодоформу.
7. Взаимодействие с нитропруссидом натрия
Качественная реакция на ацетон!
Ацетон с нитропруссидом натрия в щелочной среде дает интенсивно-красную окраску . При подкислении уксусной кислотой CH3COOH окраска переходит в красно-фиолетовую :
Йодоформная реакция и реакция с нитропруссидом натрия используются для обнаружения ацетона в моче при сахарном диабете.
Получение
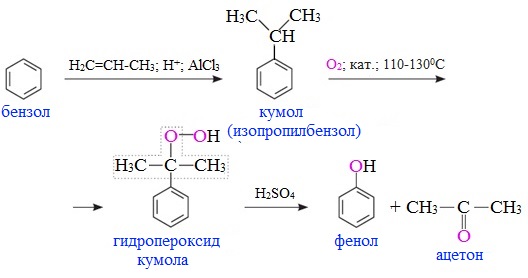
Ацетон получают в больших количествах различными методами: при сухой перегонке дерева, разложением ацетата кальция, окислением пропена, «кумольным» способом, окислением изопропилового спирта, гидратацией ацетилена водяным паром.
1.Кумольный способ
Данный способ получения фенола основан на окислении кумола (изопропилбензола). В качестве исходных продуктов используют бензол и пропилен.
Процесс протекает в три стадии. На первой стадии бензол алкилируется пропеном с получением кумола, на второй и третьей (реакция Удриса-Сергеева) полученный кумол окисляется кислородом воздуха до гидропероксида, который при действии серной кислоты разлагается на фенол и ацетон:
Окисление кумола — экономически выгодный метод, так как позволяет получить наряду с фенолом другой важный продукт — ацетон (на 1 кг фенола приходится 0,6 кг ацетона). В настоящее время этот метод наиболее широко используется в промышленности и позволяет производить более 80% синтетического фенола.
2. Окисление изопропилового спирта
Ацетон получают в больших количествах при окислении изопропилового спирта:
В качестве катализатора применяется медь, серебро, никель, платина и др. Воздух, насыщенный парами изопропилового спирта, пропускают над тонким слоем катализатора при температуре 400-650 0 С.
Если процесс окисления протекает в жидкой фазе, то, как побочный продукт образуется пероксид водорода:
3. Каталитическое окисление пропена кислородом воздуха
В промышленности ацетон получают прямым окислением пропена в жидкой фазе в присутствии катализатора — смеси PdCl2 и CuCl2 при температуре 100 0 C:
4. Брожение крахмала
Незначительное значение имеет метод брожения крахмала под действием бактерий с образованием ацетона и бутанола. Метод характеризуется малыми выходами.
5. Пиролиз ацетата кальция
Ацетон можно получить пиролизом ацетата кальция:
6. Гидратация ацетилена водяным паром
Реакция протекает при 400-460 0 С над катализатором, содержащим оксиды железа и марганца:
Применение
В качестве растворителя ацетон используется в производстве красок, лаков и олифы, резины, пластмасс, красителей, взрывчатых веществ, а также в фотографии.
Ацетон применяется в производство искусственного шелка и синтетической кожи, в производстве смазочных масел, бездымного пороха, кинопленки.
В химической промышленности ацетон является промежуточным химическим соединением при производстве многих химикатов, таких как кетен, уксусный ангидрид, бисфенол А, метилметакрилат, хлороформ, изофорон, йодоформ, витамин С.
Метилметакрилат применяется, главным образом, в виде листов пластика, порошков для литья и формовки, поверхностных покрытий, эмульсионных полимеров, волокон, чернил и пленок.
Метилметакрилат также применяется в производстве материалов, известных под названием плексигласа или люцита. Они используются в зубных протезах, твердых контактных линзах, и клеях.
Метилметакрилат – мономер для синтеза полиметилметакрилата («органическое сырье»).
Видео:Получение Йодоформа. Реакция Ацетона, Йода и Гидрооксида Натрия. Реакция C3H6O, I2 и NaOH.Скачать

Присоединение гидросульфита натрия
Вы будете перенаправлены на Автор24
К карбонильной группе в качестве нуклеофильной частицы могут такжк присоединятся гидросульфит-ионы в результате чего образуются $alpha$-оксипроизводные сульфокислот:
Атом серы имеет большую нуклеофильность, чем атом кислорода, и карбонильный электрофильный центр атакуется серой сульфит-иона $^$, который всегда присутствует в системе и является более активным по сравнению с гидросульфит-ионом $HSO_$:
Реакция присоединения гидросульфита общая как для альдегидов, так и для метилкетонов. Однако кетоны с более длинными радикалами, чем метильный, не могут присоединять гидросульфит-ионы из-за пространственного препятствия для нуклеофильных атак этим нуклеофилом. Присоединение гидросульфита по месту карбонильной группы, подобно многим реакциям, обратимый процесс, и для выхода целевого продукта присоединения следует использовать большой избыток 40%-го водного раствора гидросульфита:
В кислых или наоборот щелочных средах происходит обратная реакция, которая позволяет выделять карбонильные соединения при их идентификации:
Готовые работы на аналогичную тему
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Применение гидросульфитных производных карбонильных соединений
Так как гидросульфитные производные карбонильных соединений представляют собой кристаллические вещества, то реакцию присоединения гидросульфита к ним часто используют для выделения этих карбонильных соединений из реакционной смеси. Исходные вещества могут быть легко получены при обработке гидросульфитных производных кислотами или основаниями, или например, карбонатом натрия. Из-за этого гидросульфитные производные карбонильных соединений часто используют для так называемой «консервации» карбоксильной группы, чтобы предохранить её от окисления или альдольной конденсации. Гидросульфитные производные также применяют и для получения цианогидринов при взаимодействии их с цианидом калия:
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Присоединение гидрид-аниона
При применении соединений типа тетрагидроалюмината лития $LiAlH_4$ или тетрагидробората лития $LiBH_4$ ($N$-нуклеофилы) реакция присоединения происходит с перемещением гидридного аниона. В ней могут участвовать все четыре атома водорода аниона $[AlH_4]^-$:
К реакциям такого типа относят реакцию Меервейна-Понндорфа-Верлея (1926-1929 гг.) — cелективное восстановление карбонильных соединений с помощью триизопропилата алюминия в качестве донора гидрид-анионов:
В процессе восстановления образуется промежуточный комплекс между молекулами реагирующих компонентов, в котором происходит перемещение гидрид-иона от фрагмента изопропилового спирта к карбокатиону карбонильного соединения, который восстанавливается, с последующим расщеплением связи $O-A1$ и образованием молекулы спирта:
В процессе реакции одна изопропокси-группа триизопропилата алюминия окисляется до ацетона.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Присоединение галогенид-ионов
Прямого взаимодействия карбонильной группы с галогеном не происходит, но при воздействии сильных электрофилов вроде $PCl_5$ или $SF_4$, реакция проходит с начальной активацией карбонильной группы и последующей ее взаимодействием с галогенид-ионом:
Аналогично кетоны образуют геминальные галогенопроизводные:
Получи деньги за свои студенческие работы
Курсовые, рефераты или другие работы
Автор этой статьи Дата последнего обновления статьи: 24.02.2022
🎬 Видео
Взаимодействие металлов с кислотами. 8 класс.Скачать

8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Гидроксид натрия.Цветные реакции с едким натром.Получение щелочи и опыты.Сульфид,сульфит из натрия!Скачать

ЭКЗО- и ЭНДО- термические реакции. Химия – ПростоСкачать

Реакции металлов с кислородом и водой. 8 класс.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Уравнивание реакций горения углеводородовСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

Составление уравнений реакций горения. 11 класс.Скачать

Реакция нейтрализацииСкачать

Электролиз. 10 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

10.3. Альдегиды и кетоны: Химические свойства. ЕГЭ по химииСкачать