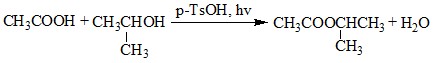Пропанол-2, изопропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение пропанола-2
- Водородные связи и физические свойства спиртов
- Изомерия пропанола-2
- Структурная изомерия
- Химические свойства пропанола-2
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование пропанола-2
- Получение пропанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- 3. Гидратация алкенов
- Acetyl
- Напишите уравнение реакции восстановления изопропилацетата
- Содержание
- Свойства [ править | править код ]
- Химические свойства [ править | править код ]
- Физические свойства [ править | править код ]
- Получение [ править | править код ]
- Применение [ править | править код ]
- Медицина [ править | править код ]
- Влияние на человека [ править | править код ]
- Наркотические свойства [ править | править код ]
- Реакция — окисление — изопропилового спирт
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Строение пропанола-2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому пропанол-2 очень хорошо растворим в воде. Молекулы пропанола-2 в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол-2 смешивается с водой в любых соотношениях.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Изомерия пропанола-2
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Структурная изомерия
Для пропанола-2 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Видео:Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.Скачать

Химические свойства пропанола-2
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-2
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-2 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-2 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-2 взаимодействует с калием с образованием изопропилата калия и водорода . |
2СН3–CH OH –CH3 + 2K → 2СН3–CHOK –CH 3 + H 2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, изопропилат калия разлагается водой: |
СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
Видео:Окислительно-восстановительные реакции. 1 часть. 10 класс.Скачать
2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-2 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-2 с аммиаком образуется изопропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, изопропанол реагирует с уксусной кислотой с образованием изопропилацетата (изопропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-2 с азотной кислотой образуется изопропилнитрат. |
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-2 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-2 при низкой температуре образуется диизопропиловый эфир: |
Видео:Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Вторичные спирты окисляются до кетонов.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
| Например, при окислении пропанола-2 образуется ацетон |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) вторичные спирты также окисляются до кетонов.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-2: |
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

5. Дегидрирование пропанола-2
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-2 образуется ацетон. |
Видео:Как уравнивать окислительно-восстановительные реакции?Скачать

Получение пропанола-1
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 2-хлорпропана с водным раствором гидроксида натрия образуется пропанол-2 |
СН3–CHCl –CH 3 + NaOH → СН3–CHOH–CH3 + NaCl
Видео:Разжижение ила на дне локальной канализации. Второе применение средства. Средство для выгребных ямСкачать

2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании кетонов образуются вторичные спирты.
| Например: при гидрировании ацетона образуется изопропанол |
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

3. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Видео:Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.Скачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Окислительно-восстановительные реакции - НЕОРГАНИКА | ЕГЭ химияСкачать  Напишите уравнение реакции восстановления изопропилацетатаИзопропи́ловый спирт (пропано́л-2, втор-пропанол, изопропано́л, диметилкарбино́л, сокр. ИПС — широко используемое сокращение) — органическое соединение, простейший вторичный одноатомный спирт алифатического ряда. Существует 1 изомер изопропанола — пропанол-1, обладающий прямой цепью. При нормальных условиях прозрачная, бесцветная жидкость с резким характерным запахом и мягким горьким вкусом, типичным для спиртов с короткой углеводородной цепью [2] . Как и все летучие спирты, огнеопасен. Токсичен (считается, что в 6 раз более этанола), требует осторожного обращения. Видео:Составление уравнений реакций. 2 часть. 9 класс.Скачать  СодержаниеВидео:Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  Свойства [ править | править код ]Химические свойства [ править | править код ]Рациональная химическая формула изопропилового спирта CH 3 CH ( OH ) CH 3 > Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. При дегидрировании, например ферментом алкогольдегидрогеназой в организме млекопитающего, превращается в ацетон [3] . Реагирует с сильными окислителями. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. Растворяет некоторые виды пластмасс и резины. Физические свойства [ править | править код ]Бесцветная жидкость с характерным спиртовым запахом, более резким и приятным, чем у этанола, по запаху их можно в некоторых случаях отличить. Коэффициент преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода . Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К) . Удельная теплота сгорания 34,1 МДж/кг . Пар хорошо смешивается с воздухом, в диапазоне взрывоопасных концентраций образует взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C. Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях. С водой образует азеотропную смесь 87,9%-го изопропилового спирта с температурой кипения 80,2 °C. Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение [4] :
Видео:25. Схема реакции и химическое уравнениеСкачать  Получение [ править | править код ]Применяются два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена [5] [6] . Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена (CH3)2CHOSO2OH + H2O -> (CH3)2CHOH>>>»> CH 3 CH = CH 2 + H 2 SO 4 ⟶ ( CH 3 ) 2 CHOSO 2 OH + H 2 O ⟶ ( CH 3 ) 2 CHOH (CH3)2CHOH>>> Сырьем может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата ( CH 3 ) 2 CHOSO 2 OH >> Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора — (в скобках указаны условия процессов): ортофосфорной кислоты H 3 PO 4 >> Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами [3] . Современный способ гидрирования ацетона водородом: C H 3 C O C H 3 + H 2 → k a t C H 3 C H ( O H ) C H 3 COCH_ +H_ >CH_ CH(OH)CH_ > > Гидрирование ацетона в паровой фазе в присутствии твёрдого медно-никельхромитного катализатора [7] [8] . В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск) [9] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск) [8] [10] . Видео:ЩЁЛОЧЬ. Из чего делают мыло. Что такое ресомация. Можно ли щёлочь удержать в руке. Опасность щёлочи.Скачать  Применение [ править | править код ]Изопропиловый спирт используется в качестве заменителя этилового спирта в медицине (в последнее время очень активно, так как не уступает по антисептической активности этанолу), в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей (стеклоомывающих в основном, а также антифризов), медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ промышленности. В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине благодаря своей относительно низкой токсичности [11] . 75%-й водный раствор диметилкарбинола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивая более высокую эффективность и лучшее обеззараживание [12] . Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита [13] . Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу. Изопропиловый спирт также используют как исходное сырье для синтеза: По причине особого государственного регулирования этанола изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав: Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители). Часто используется при сварке оптических волокон для очистки волокна перед скалыванием. Медицина [ править | править код ]70%-й изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток. Видео:Окислительно-восстановительные реакции. Практическое занятие. Видеоурок 40. Химия 9 классСкачать  Влияние на человека [ править | править код ]Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест — 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает [14] . Изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях. Изопропанол горюч. При горении даёт яркое пламя, полностью разлагается на простые составляющие — воду и углекислый газ. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр. Испарение изопропанола из емкости в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей [15] . Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко [2] . Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах порядка 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие. При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл. Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов [2] . Наркотические свойства [ править | править код ]Изопропиловый спирт обладает наркотическим действием [14] , наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола [16] . Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов, вызывает состояние глубокого наркоза и смерть [15] . При длительном воздействии больших концентраций паров в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающем ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко. Изопропиловый эфир уксусной кислоты обладает приятным эфирно-фруктовым запахом, применяется в кондитерском производстве (для получения пищевых ароматических эссенций), является идентичным натуральному пищевым ароматизатором и зарегистрирован как вкусоароматическое химическое вещество для производства пищевых ароматизаторов [5, 6]. Находит применение в качестве растворителя эфиров целлюлозы, жиров, многих синтетических полимеров, мастик, используется в производстве лакокрасочных изделий и т.д. [11, 13]. ПДК изопропилацетата 200 мг/м3 [11]. Цель исследования. Получают изопропилацетат реакцией этерификации уксусной кислоты изопропиловым спиртом в присутствии серной кислоты ( 13% от общей массы реагирующих веществ) при температуре 1400С в течении 2 ч, выход продукта при этом составляет 70% [8, 12]. Имеется способ получения изопропилацетата реагированием уксусной кислоты пропеном в присутствии сульфокатионитного катализатора КУ-2ФПП при температуре 1200С и молярном соотношении уксусная кислота: пропен = 1,2:1, при этом конверсия пропена составляет 75% [7]. Недостатками перечисленных способов получения изопропилацетата являются длительность процесса, применение высокой температуры и невысокий выход продукта. Микроволновая активация органических реакций является динамично развивающимся методом в органическом синтезе, в отличие от классического конвекционного нагревания микроволновое облучение проводится в значительно короткое время [4]. Нами ранее были опубликованы работы по синтезу сложных эфиров карбоновых кислот в условиях сверхвысокочастотного облучения [1, 3]. Также нами ранее были получены сложные эфиры реакцией карбонилирования олефинов моноксидом углерода и спиртами в присутствии фосфиновых комплексов переходных металлов [9, 10, 14]. Способ получения изопропилацетата, предлагаемый в данной работе, позволяет сократить продолжительность реакции в сотни раз, что экономит затраты на электро- или тепловую энергию и соответственно включает производство изопропилацетата в область «зеленой» химии. Ранее нами был проведен синтез изопропилацетата в условиях микроволнового облучения в присутствии серной кислоты [2]. При тех условиях оптимальным являлся: соотношение уксусная кислота: изопропанол – 1:1, продолжительность 3 мин, соотношение катализатора (конц. серная кислота) от общей массы реагирующих веществ 1%, мощность облучения 450 Вт, при этих условиях выход целевого продукта составил 97,49 %. При применении в качестве катализатора п-толуолсульфокислоту продолжительность процесса сокращается в 6 раз по сравнению с использованием серной кислоты. Материалы и методы исследования Синтез изопропилацетата осуществляли прямой этерификацией уксусной кислоты изопропанолом при микроволновом облучении на бытовой СВЧ-печи. При проведении опытов в качестве катализатора использовали п-толуолсульфокислоту. В качестве исходных реагентов использовали ледяную уксусную кислоту и изопропиловый спирт. Продукт реакции идентифицирован на хромато-масс спектрометре Agilent 7890A/5975C (США) и ИК-спектрометре IR-Prestige 21 фирмы Shimadzu (Япония). Условия хроматографирования: газовый хроматограф 7890А с масс-селективным детектором 5975С фирмы Agilent; подвижная фаза (газ носитель) – гелий; температура испарителя 1000С, сброс потока (Split) 500:1; температура термостата колонки, начало 400С (1 мин), подъем температуры 50С в минуту, конец 1000С, при этой температуре удерживается 1 мин, общее время анализа 14 мин; режим ионизации масс-детектора методом электронного удара. Капиллярная хроматографическая колонка HP-5MS, длина колонки 30 м, внутренний диаметр 0,25 мм, неподвижная фаза диметилполисилоксан. Результаты исследования и их обсуждение Нами были проведены серия опытов для определения оптимальных условий проведения процесса, т.е. влияние на выход продукта мощности облучения, продолжительности процесса, соотношения катализатора от общей массы реагирующих веществ и соотношений реагирующих веществ. Найдено, что оптимальным соотношением реагирующих веществ является молярное соотношение уксусная кислота: изопропанол – 1:1, продолжительность 0,5 мин, соотношение катализатора от общей массы реагирующих веществ 1%, мощность облучения 900 Вт, при этих условиях выход целевого продукта составляет практически 100 % (Таблица). Нахождение оптимальных условий проведения процесса Молярное соотношение реагирующих веществ Мощность облучения, Вт Катализатор, % от общ. массы реагирующих веществ Видео:Окислительно восстановительные реакции | Химия 8 класс #52 | ИнфоурокСкачать  Реакция — окисление — изопропилового спиртИзучение влияния органических продуктов реакции окисления изопропилового спирта — ацетона и уксусной кислоты на эту реакцию показало, что ацетон на скорость процесса и на выход перекиси водорода не влияет. Уксусная же кислота, не влияя на выход перекиси водорода, оказывает тормозящее действие на процесс окисления изопропилового спирта. При содержании уксусной кислоты в исходном спирте — 3 0 % реакция окисления при 115 протекает примерно вдвое медленнее, чем в отсутствие уксусной кислоты. [16] Методом ингибирования исследован механизм реакции окисления изопропилового спирта и подтвержден радикально-цепной характер этой реакции. [17] Разработка полярографического метода определения продуктов реакции окисления изопропилового спирта с целью автоматизации процесса, Отч. [18] К числу неизученных вопросов механизма реакции окисления изопропилового спирта прежде всего следует отнести механизм образования самих перекисных соединений. [19] Процесс получения перекиси водорода основан на реакции окисления изопропилового спирта кислородсодержащим газом в жидкой фазе в четыре стадии. Установка отличается простотой аппаратурного оформления, удобством обслуживания. [20] Как видно из приведенных данных, реакция окисления изопропилового спирта имеет высокий температурный коэффициент, равный приблизительно двум. [22] На основании полученных данных может быть предложена следующая схема механизма реакции окисления изопропилового спирта . [23] Из приведенных данных видно, что ацетон не оказывает влияния на скорость реакции окисления изопропилового спирта и выход образующейся перекиси водорода. [25] В присутствии изопропилмеркаптана не происходит полного подавления активности р-фталоцианина меди, ускоряющего реакцию окисления изопропилового спирта в ацетон при 350 С. [26] Позже эти исследования были развиты в работах Денисова и Соляникова 9, изучавших реакцию окисления изопропилового спирта при температуре 99 5 — 130 и давлении 10 — 15 атм. Ими рассмотрены элементарные стадии процесса окисления изопропилового спирта, в частности реакции зарождения цепи, и определено отношение константы скорости продолжения цепи к корню квадратному из константы скорости обрыва цепей. [27] На основании полученных данных можно сделать заключение, что бромистый водород является сильным инициатором для реакции окисления изопропилового спирта . Эффективность его, как инициатора, проявляется в том, что он значительно ускоряет окисление изопропилового спирта, доводя суммарную скорость образования продуктов реакции ( ацетона и уксусной кислоты) до значительных величин. Однако нестабильность перекиси водорода в присутствии бромистого водорода и более глубокое окисление изопропилового спирта до уксусной кислоты делает этот инициатор непригодным для использования его при получении перекиси водорода из изопропилового спирта. [29] Из табл. 4 видно, что С14 ( р-излучение) оказывает заметное инициирующее действие на реакцию окисления изопропилового спирта . Необходимо отметить, что при этом выход перекиси водорода относительно высок, что свидетельствует о стабильности перекиси водорода в неводных средах при воздействии р-активности. [30] |












 и является похожей на ацетон и подобные ему соединения, представляет собой разветвленную цепь с графической формулой .
и является похожей на ацетон и подобные ему соединения, представляет собой разветвленную цепь с графической формулой .