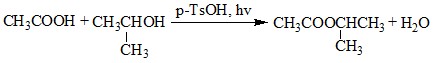Пропанол-2, изопропиловый спирт CH3CH2CH2OH – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
- Строение пропанола-2
- Водородные связи и физические свойства спиртов
- Изомерия пропанола-2
- Структурная изомерия
- Химические свойства пропанола-2
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.1. Внутримолекулярная дегидратация
- 3.2. Межмолекулярная дегидратация
- 4. Окисление спиртов
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение спиртов
- 5. Дегидрирование пропанола-2
- Получение пропанола-1
- 1. Щелочной гидролиз галогеналканов
- 2. Гидрирование карбонильных соединений
- 3. Гидратация алкенов
- Acetyl
- Напишите уравнение реакции восстановления изопропилацетата
- Содержание
- Свойства [ править | править код ]
- Химические свойства [ править | править код ]
- Физические свойства [ править | править код ]
- Получение [ править | править код ]
- Применение [ править | править код ]
- Медицина [ править | править код ]
- Влияние на человека [ править | править код ]
- Наркотические свойства [ править | править код ]
- Реакция — окисление — изопропилового спирт
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Строение пропанола-2
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства спиртов
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому спирты – жидкости с относительно высокой температурой кипения (температура кипения пропанола +92 о С).
Водородные связи образуются не только между молекулами спиртов, но и между молекулами спиртов и воды. Поэтому пропанол-2 очень хорошо растворим в воде. Молекулы пропанола-2 в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Пропанол-2 смешивается с водой в любых соотношениях.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Изомерия пропанола-2
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Структурная изомерия
Для пропанола-2 характерна структурная изомерия – изомерия положения гидроксильной группы и межклассовая изомерия.
Структурные изомеры — это соединения с одинаковым составом, которые отличаются порядком связывания атомов в молекуле, т.е. строением молекул.
Межклассовые изомеры — это вещества разных классов с различным строением, но одинаковым составом. Спирты являются межклассовыми изомерами с простыми эфирами. Общая формула и спиртов, и простых эфиров — CnH2n+2О.
| Например. Межклассовые изомеры с общей формулой С3Н8О пропиловый спирт СН3–CH2–CH2–OH и метилэтиловый эфир CH3–O–CH2–CH3 |
| Пропиловый спирт | Метилэтиловый эфир |
| СН3–CH2–CH2–OH | CH3–O–CH2–CH3 |
Изомеры с различным положением группы ОН отличаются положением гидроксильной группы в молекуле. Такая изомерия характерна для спиртов, которые содержат три или больше атомов углерода.
| Например. Пропанол-1 и пропанол-2 |
| Пропанол-1 | Пропанол-2 |
 |  |
Видео:Окислительно-восстановительные реакции. Видеоурок по химии 9 классСкачать

Химические свойства пропанола-2
Спирты – органические вещества, молекулы которых содержат, помимо углеводородной цепи, одну или несколько гидроксильных групп ОН.
Химические реакции гидроксисоединений идут с разрывом одной из связей: либо С–ОН с отщеплением группы ОН, либо связи О–Н с отщеплением водорода. Это реакции замещения, либо реакции отщепления (элиминирования).
Свойства спиртов определяются строением связей С–О–Н. Связи С–О и О–Н — ковалентные полярные. При этом на атоме водорода образуется частичный положительный заряд δ+, на атоме углерода также частичный положительный заряд δ+, а на атоме кислорода — частичный отрицательный заряд δ–.
Такие связи разрываются по ионному механизму. Разрыв связи О–Н с отрывом иона Н + соответствует кислотным свойствам гидроксисоединения. Разрыв связи С–О соответствует основным свойствам и реакциям нуклеофильного замещения.
С разрывом связи О–Н идут реакции окисления, а с разрывом связи С–О — реакции восстановления.
Таким образом, для спиртов характерны следующие свойства:
|
1. Кислотные свойства пропанола-2
| Спирты – неэлектролиты, в водном растворе не диссоциируют на ионы; кислотные свойства у них выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
При взаимодействии спиртов с растворами щелочей реакция практически не идет, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому пропанол-2 не взаимодействует с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Пропанол-2 взаимодействует с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, пропанол-2 взаимодействует с калием с образованием изопропилата калия и водорода . |
2СН3–CH OH –CH3 + 2K → 2СН3–CHOK –CH 3 + H 2
Алкоголяты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, изопропилат калия разлагается водой: |
СН3–CHOK –CH 3 + H2O → СН3–CHOH–CH3 + KOH
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии спиртов с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, пропанол-2 реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии пропанола-2 с аммиаком образуется изопропиламин. |
2.3. Этерификация (образование сложных эфиров)
Cпирты вступают в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, изопропанол реагирует с уксусной кислотой с образованием изопропилацетата (изопропилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, при взаимодействии пропанола-2 с азотной кислотой образуется изопропилнитрат. |
Видео:Окислительно-восстановительные реакции в щелочноной среде. Упрощенный подход.Скачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от спиртов отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.1. Внутримолекулярная дегидратация
При высокой температуре происходит внутримолекулярная дегидратация и образуется соответствующий алкен.
| Например, из пропанола-2 под действием концентрированной серной кислоты при высокой температуре образуется пропилен: |
3.2. Межмолекулярная дегидратация
При низкой температуре происходит межмолекулярная дегидратация: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации пропанола-2 при низкой температуре образуется диизопропиловый эфир: |
Видео:Окислительно-восстановительные реакции в кислой среде. Продвинутый подход.Скачать

4. Окисление спиртов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Вторичные спирты окисляются в кетоны: в торичные спирты → кетоны |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
4.1. Окисление оксидом меди (II)
Cпирты можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Вторичные спирты окисляются до кетонов.
| Например, пропанол-2 окисляется оксидом меди (II) при нагревании до ацетона |
4.2. Окисление кислородом в присутствии катализатора
Cпирты можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.).
| Например, при окислении пропанола-2 образуется ацетон |
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) вторичные спирты также окисляются до кетонов.
| При нагревании первичного спирта с перманганатом или дихроматом калия в кислой среде может образоваться также альдегид, если его сразу удаляют из реакционной смеси. |
| Например, при взаимодействии изопропанола с перманганатом калия в серной кислоте образуется ацетон |
4.4. Горение спиртов
Образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания пропанола-2: |
Видео:Окислительно-восстановительные реакции. 1 часть. 10 класс.Скачать
5. Дегидрирование пропанола-2
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании первичных спиртов образуются альдегиды.
| Например, при дегидрировании пропанола-2 образуется ацетон. |
Видео:Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.Скачать

Получение пропанола-1
Видео:Как уравнивать окислительно-восстановительные реакции?Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании 2-хлорпропана с водным раствором гидроксида натрия образуется пропанол-2 |
СН3–CHCl –CH 3 + NaOH → СН3–CHOH–CH3 + NaCl
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

2. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам протекает при нагревании в присутствии катализатора. При гидрировании кетонов образуются вторичные спирты.
| Например: при гидрировании ацетона образуется изопропанол |
Видео:Уравнивание органических ОВР за 12 минут | ХИМИЯ ЕГЭ | СОТКАСкачать

3. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Для несимметричных алкенов реакция идёт преимущественно по правилу Марковникова.
Видео:Разжижение ила на дне локальной канализации. Второе применение средства. Средство для выгребных ямСкачать

Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: 8(906)72 3-11-5 2 Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Этим вы поможете сделать сайт лучше. К сожалению, регистрация на сайте пока недоступна. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Здесь вы можете выбрать параметры отображения органических соединений. Видео:Составление уравнений реакций. 2 часть. 9 класс.Скачать  Напишите уравнение реакции восстановления изопропилацетатаИзопропи́ловый спирт (пропано́л-2, втор-пропанол, изопропано́л, диметилкарбино́л, сокр. ИПС — широко используемое сокращение) — органическое соединение, простейший вторичный одноатомный спирт алифатического ряда. Существует 1 изомер изопропанола — пропанол-1, обладающий прямой цепью. При нормальных условиях прозрачная, бесцветная жидкость с резким характерным запахом и мягким горьким вкусом, типичным для спиртов с короткой углеводородной цепью [2] . Как и все летучие спирты, огнеопасен. Токсичен (считается, что в 6 раз более этанола), требует осторожного обращения. Видео:25. Схема реакции и химическое уравнениеСкачать  СодержаниеВидео:Реакции окисления, нуклеофильного присоединения альдегидов и кетонов. 11 класс.Скачать  Свойства [ править | править код ]Химические свойства [ править | править код ]Рациональная химическая формула изопропилового спирта CH 3 CH ( OH ) CH 3 > Изопропанол обладает всеми свойствами вторичных спиртов жирного ряда, образует простые и сложные эфиры. С ароматическими соединениями изопропиловый спирт конденсируется с образованием производных, таких как изопропилбензол и изопропилтолуол. При дегидрировании, например ферментом алкогольдегидрогеназой в организме млекопитающего, превращается в ацетон [3] . Реагирует с сильными окислителями. В изопропаноле хорошо растворяются многие эфирные масла, алкалоиды, некоторые синтетические смолы и другие химические соединения. Растворяет некоторые виды пластмасс и резины. Физические свойства [ править | править код ]Бесцветная жидкость с характерным спиртовым запахом, более резким и приятным, чем у этанола, по запаху их можно в некоторых случаях отличить. Коэффициент преломления nD = 1,3776 при 20 °C. Динамическая вязкость при стандартных условиях 2,43 мПа·с — немного более вязкий, чем вода . Молярная теплоёмкость (ст. усл.) — 155,2 Дж/(моль·К) . Удельная теплота сгорания 34,1 МДж/кг . Пар хорошо смешивается с воздухом, в диапазоне взрывоопасных концентраций образует взрывчатые смеси. Давление насыщенного пара при 20 °C — 4,4 кПа. Относительная плотность пара по воздуху — 2,1, относительная плотность смеси насыщенный пар/воздух — 1,05 при 20 °C. Растворим в ацетоне, хорошо растворим в бензоле, с остальными растворителями (вода, органические) смешивается в любых соотношениях. С водой образует азеотропную смесь 87,9%-го изопропилового спирта с температурой кипения 80,2 °C. Зависимость температуры замерзания смеси изопропилового спирта с водой от концентрации изопропилового спирта в смеси представлена в таблице, при замерзании концентрированных растворов наблюдается переохлаждение [4] :
Видео:Окислительно-восстановительные реакции - НЕОРГАНИКА | ЕГЭ химияСкачать  Получение [ править | править код ]Применяются два метода промышленного производства изопропанола — гидрирование ацетона и гидратация пропилена [5] [6] . Основным способом получения изопропанола в российской промышленности является сернокислотная гидратация пропилена (CH3)2CHOSO2OH + H2O -> (CH3)2CHOH>>>»> CH 3 CH = CH 2 + H 2 SO 4 ⟶ ( CH 3 ) 2 CHOSO 2 OH + H 2 O ⟶ ( CH 3 ) 2 CHOH (CH3)2CHOH>>> Сырьем может служить, в том числе кроме пропилена, пропан-пропиленовая фракция с содержанием пропилена 30—90 % (фракция получаемая при пиролизе и крекинге нефти). Сейчас начинают чаще использовать чистый пропилен, так как в этом случае процесс можно вести при невысоких давлениях, при этом существенно снижается образование побочных продуктов реакции — полимеров и ацетона. На первой стадии процесса образуется сернокислотный экстракт, содержащий равновесную смесь изопропилового спирта, изопропилсульфата ( CH 3 ) 2 CHOSO 2 OH >> Прямую гидратацию пропилена осуществляют в основном в присутствии катализатора — (в скобках указаны условия процессов): ортофосфорной кислоты H 3 PO 4 >> Изопропиловый спирт получают также окислением алканов воздухом, а также и другими способами [3] . Современный способ гидрирования ацетона водородом: C H 3 C O C H 3 + H 2 → k a t C H 3 C H ( O H ) C H 3 COCH_ +H_ >CH_ CH(OH)CH_ > > Гидрирование ацетона в паровой фазе в присутствии твёрдого медно-никельхромитного катализатора [7] [8] . В России изопропанол производят из пропилена на ЗАО «Завод синтетического спирта» (г. Орск) [9] и методом гидрирования ацетона водородом — ООО «Синтез Ацетон», (г. Дзержинск) [8] [10] . Видео:ЩЁЛОЧЬ. Из чего делают мыло. Что такое ресомация. Можно ли щёлочь удержать в руке. Опасность щёлочи.Скачать  Применение [ править | править код ]Изопропиловый спирт используется в качестве заменителя этилового спирта в медицине (в последнее время очень активно, так как не уступает по антисептической активности этанолу), в косметике, парфюмерии, бытовой химии, жидкостей для автомобилей (стеклоомывающих в основном, а также антифризов), медицинских целях, в средствах для очистки стёкол, оргтехники и как растворитель органических веществ промышленности. В развитых странах изопропанол широко используется в товарах личной гигиены и в медицине благодаря своей относительно низкой токсичности [11] . 75%-й водный раствор диметилкарбинола используется как дезинфицирующее средство для рук. Вода способствует проникновению сквозь клеточные мембраны бактерий, таким образом обеспечивая более высокую эффективность и лучшее обеззараживание [12] . Изопропиловый спирт также используется в медицине в качестве вспомогательного компонента профилактического средства от наружного отита [13] . Эффективен при лечении дерматита протиранием пораженных участков кожи, с малым вредным влиянием на кожу. Изопропиловый спирт также используют как исходное сырье для синтеза: По причине особого государственного регулирования этанола изопропиловый спирт часто является его заменителем во многих областях его применения. Так, изопропанол входит в состав: Изопропиловый спирт применяется в промышленности, при резании алюминия, токарных, фрезерных и прочих работах. В смеси с маслом позволяет значительно повысить производительность работы. Изопропиловый спирт применяется как референс-стандарт в газовой хроматографии (например, при испытании лекарственных средств на остаточные органические растворители). Часто используется при сварке оптических волокон для очистки волокна перед скалыванием. Медицина [ править | править код ]70%-й изопропиловый спирт применяется вместо этилового спирта в качестве антисептика для пропитки медицинских салфеток. Видео:Окислительно-восстановительные реакции. Практическое занятие. Видеоурок 40. Химия 9 классСкачать  Влияние на человека [ править | править код ]Предельно допустимая концентрация (ПДК) паров изопропанола в воздухе рабочей зоны составляет 10 мг/м³ (ГОСТ 9805-84), в атмосферном воздухе населенных мест — 0,6 мг/м³ (ГН 2.1.6.1338-03). Не накапливается в организме, то есть кумулятивными свойствами не обладает [14] . Изопропиловый спирт значительно менее летуч, чем, например, этанол, и для достижения больших концентраций его паров необходима значительно большая площадь разлива и испарения. Благодаря этому свойству изопропиловый спирт заменяет этиловый в парфюмерии, дезинфицирующих составах, стеклоомывателях и незамерзающих жидкостях. Изопропанол горюч. При горении даёт яркое пламя, полностью разлагается на простые составляющие — воду и углекислый газ. При горении с достаточным избытком воздуха изопропанол не выделяет вредных веществ, копоти и пр. Испарение изопропанола из емкости в помещении более 30 м³ при температуре 30 °C и ниже не вызывает негативных реакций у людей [15] . Отравления изопропанолом случайны и в основном происходят с детьми младше 6 лет. Летальный исход от отравления изопропанолом происходит крайне редко [2] . Небольшие дозы изопропанола, как правило, не вызывают значительных расстройств. Серьёзное токсическое воздействие на здорового взрослого человека при пероральном употреблении может быть достигнуто при дозах порядка 50 мл и более. Изопропанол при приеме внутрь метаболизируется в печени под действием алкогольдегидрогеназы в ацетон, что обусловливает его токсическое действие. При приеме внутрь вызывает опьянение, сходное с алкогольным. Хотя токсичность изопропанола примерно в 3,5 раза выше, чем у этанола, его опьяняющее действие также выше, но уже в 10 раз. По этой причине смертельные отравления изопропанолом, в сравнении с отравлениями от этилового спирта, случаются реже, так как человек впадает в алкогольный транс гораздо раньше, чем сможет самостоятельно принять смертельную дозу изопропанола, если только не выпил единовременно от 500 мл. Биологический полураспад изопропилового спирта в организме человека составляет от 2,5 до 8 часов [2] . Наркотические свойства [ править | править код ]Изопропиловый спирт обладает наркотическим действием [14] , наркотический эффект от приёма изопропанола почти в 2 раза превышает аналогичный эффект этанола [16] . Концентрация 12 промилле в организме человека, воздействующая в течение 4 часов, вызывает состояние глубокого наркоза и смерть [15] . При длительном воздействии больших концентраций паров в воздухе вызывает головную боль, оказывает раздражающее воздействие на глаза и дыхательные пути. Для достижения данного эффекта человеку потребуется находиться в течение длительного времени в непроветриваемом помещении с большой площадью разлива изопропанола. Может оказывать угнетающее действие на центральную нервную систему. Длительное вдыхание воздуха с концентрацией, значительно превышающем ПДК, может вызвать потерю сознания. Тяжёлое отравление изопропиловым спиртом происходит редко. Изопропиловый эфир уксусной кислоты обладает приятным эфирно-фруктовым запахом, применяется в кондитерском производстве (для получения пищевых ароматических эссенций), является идентичным натуральному пищевым ароматизатором и зарегистрирован как вкусоароматическое химическое вещество для производства пищевых ароматизаторов [5, 6]. Находит применение в качестве растворителя эфиров целлюлозы, жиров, многих синтетических полимеров, мастик, используется в производстве лакокрасочных изделий и т.д. [11, 13]. ПДК изопропилацетата 200 мг/м3 [11]. Цель исследования. Получают изопропилацетат реакцией этерификации уксусной кислоты изопропиловым спиртом в присутствии серной кислоты ( 13% от общей массы реагирующих веществ) при температуре 1400С в течении 2 ч, выход продукта при этом составляет 70% [8, 12]. Имеется способ получения изопропилацетата реагированием уксусной кислоты пропеном в присутствии сульфокатионитного катализатора КУ-2ФПП при температуре 1200С и молярном соотношении уксусная кислота: пропен = 1,2:1, при этом конверсия пропена составляет 75% [7]. Недостатками перечисленных способов получения изопропилацетата являются длительность процесса, применение высокой температуры и невысокий выход продукта. Микроволновая активация органических реакций является динамично развивающимся методом в органическом синтезе, в отличие от классического конвекционного нагревания микроволновое облучение проводится в значительно короткое время [4]. Нами ранее были опубликованы работы по синтезу сложных эфиров карбоновых кислот в условиях сверхвысокочастотного облучения [1, 3]. Также нами ранее были получены сложные эфиры реакцией карбонилирования олефинов моноксидом углерода и спиртами в присутствии фосфиновых комплексов переходных металлов [9, 10, 14]. Способ получения изопропилацетата, предлагаемый в данной работе, позволяет сократить продолжительность реакции в сотни раз, что экономит затраты на электро- или тепловую энергию и соответственно включает производство изопропилацетата в область «зеленой» химии. Ранее нами был проведен синтез изопропилацетата в условиях микроволнового облучения в присутствии серной кислоты [2]. При тех условиях оптимальным являлся: соотношение уксусная кислота: изопропанол – 1:1, продолжительность 3 мин, соотношение катализатора (конц. серная кислота) от общей массы реагирующих веществ 1%, мощность облучения 450 Вт, при этих условиях выход целевого продукта составил 97,49 %. При применении в качестве катализатора п-толуолсульфокислоту продолжительность процесса сокращается в 6 раз по сравнению с использованием серной кислоты. Материалы и методы исследования Синтез изопропилацетата осуществляли прямой этерификацией уксусной кислоты изопропанолом при микроволновом облучении на бытовой СВЧ-печи. При проведении опытов в качестве катализатора использовали п-толуолсульфокислоту. В качестве исходных реагентов использовали ледяную уксусную кислоту и изопропиловый спирт. Продукт реакции идентифицирован на хромато-масс спектрометре Agilent 7890A/5975C (США) и ИК-спектрометре IR-Prestige 21 фирмы Shimadzu (Япония). Условия хроматографирования: газовый хроматограф 7890А с масс-селективным детектором 5975С фирмы Agilent; подвижная фаза (газ носитель) – гелий; температура испарителя 1000С, сброс потока (Split) 500:1; температура термостата колонки, начало 400С (1 мин), подъем температуры 50С в минуту, конец 1000С, при этой температуре удерживается 1 мин, общее время анализа 14 мин; режим ионизации масс-детектора методом электронного удара. Капиллярная хроматографическая колонка HP-5MS, длина колонки 30 м, внутренний диаметр 0,25 мм, неподвижная фаза диметилполисилоксан. Результаты исследования и их обсуждение Нами были проведены серия опытов для определения оптимальных условий проведения процесса, т.е. влияние на выход продукта мощности облучения, продолжительности процесса, соотношения катализатора от общей массы реагирующих веществ и соотношений реагирующих веществ. Найдено, что оптимальным соотношением реагирующих веществ является молярное соотношение уксусная кислота: изопропанол – 1:1, продолжительность 0,5 мин, соотношение катализатора от общей массы реагирующих веществ 1%, мощность облучения 900 Вт, при этих условиях выход целевого продукта составляет практически 100 % (Таблица). Нахождение оптимальных условий проведения процесса Молярное соотношение реагирующих веществ Мощность облучения, Вт Катализатор, % от общ. массы реагирующих веществ Видео:Окислительно восстановительные реакции | Химия 8 класс #52 | ИнфоурокСкачать  Реакция — окисление — изопропилового спиртИзучение влияния органических продуктов реакции окисления изопропилового спирта — ацетона и уксусной кислоты на эту реакцию показало, что ацетон на скорость процесса и на выход перекиси водорода не влияет. Уксусная же кислота, не влияя на выход перекиси водорода, оказывает тормозящее действие на процесс окисления изопропилового спирта. При содержании уксусной кислоты в исходном спирте — 3 0 % реакция окисления при 115 протекает примерно вдвое медленнее, чем в отсутствие уксусной кислоты. [16] Методом ингибирования исследован механизм реакции окисления изопропилового спирта и подтвержден радикально-цепной характер этой реакции. [17] Разработка полярографического метода определения продуктов реакции окисления изопропилового спирта с целью автоматизации процесса, Отч. [18] К числу неизученных вопросов механизма реакции окисления изопропилового спирта прежде всего следует отнести механизм образования самих перекисных соединений. [19] Процесс получения перекиси водорода основан на реакции окисления изопропилового спирта кислородсодержащим газом в жидкой фазе в четыре стадии. Установка отличается простотой аппаратурного оформления, удобством обслуживания. [20] Как видно из приведенных данных, реакция окисления изопропилового спирта имеет высокий температурный коэффициент, равный приблизительно двум. [22] На основании полученных данных может быть предложена следующая схема механизма реакции окисления изопропилового спирта . [23] Из приведенных данных видно, что ацетон не оказывает влияния на скорость реакции окисления изопропилового спирта и выход образующейся перекиси водорода. [25] В присутствии изопропилмеркаптана не происходит полного подавления активности р-фталоцианина меди, ускоряющего реакцию окисления изопропилового спирта в ацетон при 350 С. [26] Позже эти исследования были развиты в работах Денисова и Соляникова 9, изучавших реакцию окисления изопропилового спирта при температуре 99 5 — 130 и давлении 10 — 15 атм. Ими рассмотрены элементарные стадии процесса окисления изопропилового спирта, в частности реакции зарождения цепи, и определено отношение константы скорости продолжения цепи к корню квадратному из константы скорости обрыва цепей. [27] На основании полученных данных можно сделать заключение, что бромистый водород является сильным инициатором для реакции окисления изопропилового спирта . Эффективность его, как инициатора, проявляется в том, что он значительно ускоряет окисление изопропилового спирта, доводя суммарную скорость образования продуктов реакции ( ацетона и уксусной кислоты) до значительных величин. Однако нестабильность перекиси водорода в присутствии бромистого водорода и более глубокое окисление изопропилового спирта до уксусной кислоты делает этот инициатор непригодным для использования его при получении перекиси водорода из изопропилового спирта. [29] Из табл. 4 видно, что С14 ( р-излучение) оказывает заметное инициирующее действие на реакцию окисления изопропилового спирта . Необходимо отметить, что при этом выход перекиси водорода относительно высок, что свидетельствует о стабильности перекиси водорода в неводных средах при воздействии р-активности. [30] |












 и является похожей на ацетон и подобные ему соединения, представляет собой разветвленную цепь с графической формулой .
и является похожей на ацетон и подобные ему соединения, представляет собой разветвленную цепь с графической формулой .