Аминокислоты – гетерофункциональные соединения, содержащие карбоксильную и аминогруппы. По взаимному расположению функциональных групп различают a -, b -, g — и т.д. аминокислоты. Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при взаимодействии альдегида с HCN и NH3 c последующим гидролизом его в аминокислоту. В качестве реагента применяют смесь NaCN и NH4Cl.
Метод применим для синтеза только a -аминокислот.
3) Алкилирование N-фталимидмалонового эфира
4) Присоединение аммиака к a , b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
Аминокислоты дают реакции, характерные для карбоксильной и аминогрупп, и, кроме того, проявляют специфические свойства, которые определяются наличием двух функциональных групп и их взаимным расположением.
2.1. Кислотно-основные свойства
Аминокислоты содержат кислотный и основный центры и являются амфотерными соединениями. В кристаллическом состоянии они существуют в виде внутренних солей (биполярных ионов), которые образуются в результате внутримолекулярного переноса протона от более слабого основного центра (СОО — ) к более сильному основному центру (NH2).
Ионное строение аминокислот подтверждается их физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с высокими температурами плавления. Они нерастворимы в неполярных органических растворителях и растворимы в воде. Их молекулы обладают большими дипольными моментами.
Форма существования аминокислот в водных растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и существуют преимущественно в виде катионов. В щелочной среде биполярный ион отдает протон и превращается в анион.
При некотором значении рН, строго определенном для каждой аминокислоты, она существует преимущественно в виде биполярного иона. Это значение рН называют изоэлектрической точкой (рI). В изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей растворимостью в воде. Катионная форма аминокислоты содержит два кислотных центра (COOH и NH3 + ) и характеризуется двумя константами диссоциации рКа1 и рКа2. Значение рI определяется по уравнению:
2.2. Реакции по аминогруппе
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам взаимодействуют с азотистой кислотой с выделением азота. При этом происходит замещение аминогруппы на гидроксильную.
Реакция используется для количественного определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и арилирование
При взаимодействии аминокислот с избытком алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом (ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в активированном ароматическом кольце.
Реакция используется для установления аминокислотной последовательности в пептидах.
Аминокислоты взаимодействуют с ангидридами и хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно, гидролизуются в жестких условиях. При разработке методов синтеза пептидов были найдены защитные группы, которые легко удаляются путем гидролиза или гидрогенолиза.
трет-Бутоксикарбонильная защита (БОК-защита).
Легкость снятия защиты обусловлена устойчивостью бензил- и трет-бутил-катионов, которые образуются в качестве интермедиатов.
2.3. Реакции по карбоксильной группе
При сухой перегонке в присутствии гидроксида бария аминокислоты декарбоксилируются с образованием аминов.
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры – легко летучие соединения и могут быть разделены путем перегонки или газожидкостной хроматографии, что используется для анализа и разделения смесей аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и ангидридов
При действии на защищенные по аминогруппе аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной группы при нуклеофильном замещении. Чаще для этой цели получают смешанные ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в синтезе пептидов.
2.4. Специфические реакции аминокислот
Реакции с одновременным участием карбоксильной и аминогрупп идут, как правило, с образованием продуктов, содержащих термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
a -Аминокислоты образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr и др.).
Отношение аминокислот к нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины.
b -Аминокислоты при нагревании переходят a , b -непредельные кислоты.
g — и d -Аминокислот претерпевают внутримолекулярное ацилирование с образованием циклических амидов – лактамов.
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное дезаминирование и декарбоксилирование с образованием альдегида и окрашенного продукта конденсации.
Реакция используется для количественного анализа аминокислот методом фотометрии.
3.1. Строение и классификация
Природные аминокислоты отвечают общей формуле RCH(NH2)COOH и отличаются строением радикала R. Формулы и тривиальные названия важнейших аминокислот приведены в таблице. Для биологического функционирования аминокислот в составе белков определяющим является полярность радикала R. По этому признаку аминокислоты разделяют на следующие основные группы (см. таблицу).
Таблица47.1. Важнейшие a -аминокислоты RCH(NH2)COOH
Аминокислоты, содержащие неполярный радикал R
Аминокислоты, содержащие полярный неионогенный радикал R
Аминокислоты, содержащие полярный положительно заряженный радикал R
Аминокислоты, содержащие полярный отрицательно заряженный радикал R
Аминокислоты, содержащие неполярный радикал R. Такие группы располагаются внутри молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не способные к ионизации в водной среде (спиртовый гидроксил, амидная группа). Такие группы могут располагаться как внутри, так и на поверхности молекулы белка. Они участвуют в образовании водородных связей с другими полярными группами.
Аминокислоты, содержащие радикал R, способный к ионизации в водной среде с образованием положительно или отрицательно заряженных групп. Такие аминокислоты содержат в боковом радикале дополнительный основный или кислотный центр, который в водном растворе может соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот располагаются, как правило, на поверхности молекулы и обуславливают электростатические взаимодействия.
Все природные a -аминокислоты (кроме глицина) являются хиральными соединениями. По конфигурации хирального центра в положении 2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к L-ряду.
Большинство аминокислот содержат один хиральный центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин, гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют (кроме цистина) 4 стереоизомера, из которых только один встречается в составе белков.
Так, из 4-х стереоизомеров треонина в природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только одного вида стереоизомеров имеет важное значение для формирования их пространственной структуры и обеспечения биологической активности.
a -Аминокислоты, полученные синтетическим путем, представляют рацемические смеси, которые необходимо разделять. Наиболее предпочтительным является ферментативный способ разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные производные только L- a -аминокислот. Ферментативное расщепление проводят по следующей схеме.
Сначала рацемическую аминокислоту ацилируют уксусным ангидридом:
Затем рацемическую смесь ацетильных производных подвергают ферментативной обработке. При этом гидролизуется ацетильное производное только L-аминокислоты:
Полученная после ферментативного смесь легко разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные свойства.
По кислотно-основным свойствам аминокислоты разделяют на три группы.
Нейтральные аминокислоты не содержат в радикале R дополнительных кислотных или основных центров, способных к ионизации в водной среде. В кислой среде они существуют в виде однозарядного катиона и являются двухосновными кислотами по Бренстеду. Как видно на примере аланина, изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале 5,5 – 6,3.
Основные аминокислоты содержат в радикале R дополнительный основный центр. К ним относятся лизин, гистидин и аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере лизина, лежит в области рН выше 7.
Кислые аминокислоты содержат в радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области рН много ниже 7.
Тирозин и цистеин содержат в боковых радикалах слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при физиологическом значении рН (
7) ни одна аминокислота не находится в изоэлектрической точке. В организме все аминокислоты ионизированы, что обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах используется для разделения аминокислот методом электрофореза и ионообменной хроматографии. При данном значении рН разные аминокислоты могут иметь разный по величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной хроматографии используют катионообменные смолы (сульфированный полистирол). Процесс ведут в кислой среде, когда аминокислоты находятся катионной форме.
Скорость продвижения аминокислот по хроматографической колонке зависит от силы их электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно связываются со смолой основные аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами, особенно ароматическими. Таким образом, порядок элюирования аминокислот следующий. Легче других элюируются кислые аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами. Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками.
Формально пептиды можно рассматривать как продукты поликонденсации аминокислот.
Аминокислотные остатки в пептиде связаны амидными (пептидными) связями. Один конец цепи, на котором находится аминокислота со свободной аминогруппой, называют N-концом. Другой конец, на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с N-конца.
Название пептида строят на основе тривиальных названий, входящих в его состав аминокислотных остатков, которые перечисляют, начиная с N-конца. При этом в названиях всех аминокислот за исключением С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения пептидов используют трехбуквенные обозначения входящих в его состав аминокислот.
Пептид характеризуется аминокислотным составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть установлен путем полного гидролиза пептида (расщепления до аминокислот) с последующим качественным и количественным анализом образовавшихся аминокислот методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот. Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н. HCl.
Одному и тому же аминокислотному составу отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено 2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val Ala-Val-Glu
Таким образом, для полной характеристики пептида необходимо знать его аминокислотный состав и аминокислотную последовательность.
4.2. Определение аминокислотной последовательности
Для определения аминокислотной последовательности используют комбинацию двух методов: определение концевых аминокислот и частичный гидролиз.
Определение N-концевых аминокислот.
Метод Сегнера. Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде. При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ) производного.
Преимущество этого метода состоит в том, что при отщеплении N-концевой аминокислоты пептид не разрушается и операцию по отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе – секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления, идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с образованием более коротких цепей. Частичный гидролиз проводят с помощью ферментов, которые гидролизуют пептидные связи избирательно, например, только с N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы). Существуют ферменты, расщепляющие пептидные связи только между определенными аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные фрагменты, которые перекрываются по составляющим их аминокислотным остаткам. Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного пептида. Рассмотрим простейший пример установления структуры трипептида. Частичный гидролиз по двум разным направлениям трипептида неизвестного строения дает продукты представленные на схеме.
Единственный трипептид, структура которого не противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная задача, которая требует комбинации различных методов.
Синтез пептида с заданной аминокислотной последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза дипептида из 2-х разных аминокислот возможно образование 4-х разных продуктов.
В настоящее время разработана стратегия синтеза пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза дипептида включает следующие стадии:
- защита аминогруппы N-концевой аминокислоты;
- активация карбоксильной группы N-концевой аминокислоты;
- конденсация модифицированных аминокислот
- снятие защитных групп
Таким образом, последовательно присоединяя аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень длителен, трудоемок и дает низкий выход конечного продукта. Основные потери связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее время твердофазный синтез пептидов. На первой стадии защищенная по аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе (полистироле, модифицированном введением групп –CH2Cl). После снятия защиты проводят ацилирование аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая содержит активированную карбоксильную и защищенную аминогруппу. После снятия защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с носителя действием бромистоводородной кислоты. Твердофазный синтез автоматизирован и проводится с помощью приборов – автоматических синтезаторов.
Методом твердофазного синтеза получено большое количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных остатка).
Видео:ЩЕЛОЧНОЙ ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВСкачать
Лекция № 16. Аминокислоты. Пептиды
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
- Методы получения.
- Химические свойства.
- Аминокислоты, входящие в состав белков.
- Пептиды
Аминокислоты – гетерофункциональные соединения, содержащие
карбоксильную и аминогруппы. По взаимному расположению функциональных групп
различают a -, b -, g — и т.д. аминокислоты.
Аминокислоты, содержащие аминогруппу на конце цепи, называют w -аминокислотами.
1. Методы получения
!) Аммонолиз галогензамещенных кислот.
Метод используется для синтеза a -аминокислот из доступных a -галогензамещенных кислот.
2) Метод Штеккера- Зелинского
Включает стадии образования аминонитрила при
взаимодействии альдегида с HCN и NH 3 c последующим гидролизом его в аминокислоту. В качестве
реагента применяют смесь NaCN и NH 4Cl.
Метод применим для синтеза только a -аминокислот.
3) Восстановительное аминирование
оксокислот
4) Присоединение аммиака к a , b -непредельным карбоновым кислотам.
Метод применим для синтеза b -аминокислот.
5) Из оксимов циклических кетонов
перегруппировкой Бекмана.
Метод используется для синтеза w -аминокислот.
2. Химические
свойства
Аминокислоты дают реакции, характерные для карбоксильной
и аминогрупп, и, кроме того, проявляют специфические свойства, которые
определяются наличием двух функциональных групп и их взаимным
расположением.
2.1. Кислотно-основные
свойства
Аминокислоты содержат кислотный и основный
центры и являются амфотерными соединениями. В кристаллическом состоянии они
существуют в виде внутренних солей (биполярных ионов), которые образуются в
результате внутримолекулярного переноса протона от более слабого основного
центра (СОО — ) к более сильному
основному центру (NH 2).
Ионное строение аминокислот подтверждается их
физическими свойствами. Аминокислоты – нелетучие кристаллические вещества с
высокими температурами плавления. Они нерастворимы в неполярных органических
растворителях и растворимы в воде. Их молекулы обладают большими дипольными
моментами.
Форма существования аминокислот в водных
растворах зависит от рН. В кислых растворах аминокислоты присоединяют протон и
существуют преимущественно в виде катионов. В щелочной среде биполярный ион
отдает протон и превращается в анион.
При некотором значении рН, строго определенном
для каждой аминокислоты, она существует преимущественно в виде биполярного иона.
Это значение рН называют изоэлектрической точкой ( рI ). В
изоэлектрической точке аминокислота не имеет заряда и обладает наименьшей
растворимостью в воде. Катионная форма аминокислоты содержит два кислотных
центра (COOH и NH 3 + ) и
характеризуется двумя константами диссоциации рКа1 и рКа2.
Значение рI определяется по уравнению:
2.2. Реакции по
аминогруппе
Аминокислоты содержат первичную аминогруппу и подобно первичным аминам
взаимодействуют с азотистой кислотой с выделением азота. При этом происходит
замещение аминогруппы на гидроксильную.
Реакция используется для количественного
определения аминокислот по объему выделившегося азота (метод Ван-Слайка).
Алкилирование и
арилирование
При взаимодействии аминокислот с избытком
алкилгалогенида происходит исчерпывающее алкилирование аминогруппы и образуются
внутренние соли.
Аминокислоты арилируются 2,4-динитрофторбензолом
(ДНФБ) в щелочной среде. Реакция протекает как нуклеофильное замещение в
активированном ароматическом кольце.
Реакция используется для установления
аминокислотной последовательности в пептидах.
Аминокислоты взаимодействуют с ангидридами и
хлорангидридами с образованием N-ацильных производных.
Реакция используется для защиты аминогруппы в
синтезе пептидов. Такая защита должна легко сниматься, а амиды, как известно,
гидролизуются в жестких условиях. При разработке методов синтеза пептидов были
найдены защитные группы, которые легко удаляются путем гидролиза или
гидрогенолиза.
трет -Бутоксикарбонильная защита
(БОК-защита).
Легкость снятия защиты обусловлена устойчивостью
бензил- и трет-бутил-катионов, которые образуются в качестве
интермедиатов.
2.3. Реакции по карбоксильной
группе
При сухой перегонке в присутствии гидроксида
бария аминокислоты декарбоксилируются с образованием аминов.
Аминокислоты взаимодействуют со спиртами в присутствии газообразного HCl как
катализатора с образованием сложных эфиров.
В отличие от самих аминокислот, их сложные эфиры
– легко летучие соединения и могут быть разделены путем перегонки или
газожидкостной хроматографии, что используется для анализа и разделения смесей
аминокислот, полученных при гидролизе белков.
Получение галогенангидридов и
ангидридов
При действии на защищенные по аминогруппе
аминокислоты галогенидов фосфора или серы образуются хлорангидриды.
Реакция используется для активации карбоксильной
группы при нуклеофильном замещении. Чаще для этой цели получают смешанные
ангидриды, которые являются более селективными ацилирующими реагентами.
Реакция используется для активации аминогруппы в
синтезе пептидов.
2.4. Специфические реакции
аминокислот
Реакции с одновременным участием карбоксильной и
аминогрупп идут, как правило, с образованием продуктов, содержащих
термодинамически устойчивые 5-ти- и 6-тичленные гетероциклы.
a -Аминокислоты
образуют прочные хелатные комплексы с ионами переходных металлов (Cu, Ni, Co, Cr
и др.).
Отношение аминокислот к
нагреванию
Превращения аминокислот при нагревании зависят от взаимного расположения
карбоксильной и аминогруппы и определяются возможностью образования
термодинамически стабильных 5-ти- 6-тичленных циклов
a -Аминокислоты
вступают в реакцию межмолекулярного самоацилирования. При этом образуются
циклические амиды – дикетопиперазины.
b -Аминокислоты при
нагревании переходят a , b -непредельные кислоты.
g — и d -Аминокислот претерпевают
внутримолекулярное ацилирование с образованием циклических амидов – лактамов .
При взаимодействии a -аминокислот с трикетоном – нингидрином происходит одновременное окислительное
дезаминирование и декарбоксилирование с образованием альдегида и окрашенного
продукта конденсации.
Реакция используется для количественного анализа
аминокислот методом фотометрии.
Природные аминокислоты отвечают общей формуле RCH(NH2 )COOH и отличаются строением радикала R. Формулы и
тривиальные названия важнейших аминокислот приведены в таблице. Для
биологического функционирования аминокислот в составе белков определяющим
является полярность радикала R. По этому признаку аминокислоты разделяют на
следующие основные группы (см. таблицу).
Таблица. Важнейшие a -аминокислоты
RCH(NH2)COOH
| Формула | Название | Обозначение | pI |
| Аминокислоты, содержащие неполярный радикал R | |||
 | Глицин | Gly | 5,97 |
 | Аланин | Ala | 6,0 |
 | Валин | Val | 5,96 |
 | Лейцин | Leu | 5,98 |
 | Изолейцин | Ile | 6,02 |
 | Фенилаланин | Phe | 5,48 |
 | Триптофан | Trp | 5,89 |
 | Пролин | Pro | 6,30 |
 | Метионин | Met | 5,74 |
 | Цистин | (Cys)2 | 5,0 |
| Аминокислоты, содержащие полярный неионогенный радикал R | |||
 | Серин | Ser | 5,68 |
 | Треонин | 5,60 | |
 | Гидроксипролин | Hyp | 5,8 |
 | Аспаргин | Asn | 5,41 |
 | Глутамин | Gln | 5,65 |
| Аминокислоты, содержащие полярный положительно заряженный радикал R | |||
 | Лизин | Lys | 9,74 |
 | 5-Гидроксилизин | 9,15 | |
 | Аргинин | Arg | 10,76 |
 | Гистидин | His | 7,59 |
| Аминокислоты, содержащие полярный отрицательно заряженный радикал R | |||
 | Аспаргиновая кислота | Asp | 2,77 |
 | Глутаминовая кислота | Gly | 3,22 |
 | Тирозин | Tyr | 5,66 |
 | Цистеин | Cys | 5,07 |
Аминокислоты, содержащие неполярный радикал
R. Такие группы располагаются внутри
молекулы белка и обуславливают гидрофобные взаимодействия.
Аминокислоты, содержащие полярный
неионогенный радикал R. Аминокислоты этого типа имеют в составе бокового радикала полярные группы, не
способные к ионизации в водной среде (спиртовый гидроксил, амидная группа).
Такие группы могут располагаться как внутри, так и на поверхности молекулы
белка. Они участвуют в образовании водородных связей с другими полярными
группами.
Аминокислоты, содержащие радикал R, способный
к ионизации в водной среде с образованием положительно или отрицательно
заряженных групп. Такие аминокислоты содержат в боковом радикале
дополнительный основный или кислотный центр, который в водном растворе может
соответственно присоединять или отдавать протон.
В белках ионогенные группы этих аминокислот
располагаются, как правило, на поверхности молекулы и обуславливают
электростатические взаимодействия.
Все природные a -аминокислоты (кроме глицина)
являются хиральными соединениями. По конфигурации хирального центра в положении
2 аминокислоты относят D- или L-ряду.
Природные аминокислоты относятся к
L-ряду.
Большинство аминокислот содержат один хиральный
центр и имеют два стереоизомера. Аминокислоты изолейцин, треонин,
гидроксипролин, 5-гидроксилизин и цистин содержат два хиральных центра и имеют
(кроме цистина) 4 стереоизомера, из которых только один встречается в составе
белков.
Так, из 4-х стереоизомеров треонина в
природе встречается только (2S,3R)-2-амино-3-гидроксибутановая кислота.
Использование для построения белков только
одного вида стереоизомеров имеет важное значение для формирования их
пространственной структуры и обеспечения биологической активности.
a -Аминокислоты,
полученные синтетическим путем, представляют рацемические смеси, которые
необходимо разделять. Наиболее предпочтительным является ферментативный способ
разделения с помощью ферментов ацилаз, способных гидролизовать N-ацетильные
производные только L- a -аминокислот. Ферментативное расщепление проводят по
следующей схеме.
Сначала рацемическую аминокислоту ацилируют
уксусным ангидридом:
Затем рацемическую смесь ацетильных производных
подвергают ферментативной обработке. При этом гидролизуется ацетильное
производное только L-аминокислоты:
Полученная после ферментативного смесь легко
разделяется, так как свободная L-аминокислота растворяется и в кислотах, и в
щелочах, а ацилированная – только в щелочах.
3.3. Кислотно-основные
свойства.
По кислотно-основным свойствам аминокислоты
разделяют на три группы.
Нейтральные аминокислоты не содержат в
радикале R дополнительных кислотных или основных центров, способных к ионизации
в водной среде. В кислой среде они существуют в виде однозарядного катиона и
являются двухосновными кислотами по Бренстеду. Как видно на примере аланина,
изоэлектрическая точка у нейтральных аминокислот не равна 7, а лежит в интервале
5,5 – 6,3.
Основные аминокислоты содержат в
радикале R дополнительный основный центр. К ним относятся лизин, гистидин и
аргинин. В кислой среде они существуют в виде дикатиона и являются трехосновными
кислотами. Изоэлектрическая точка основных аминокислот, как видно на примере
лизина, лежит в области рН выше 7.
Кислые аминокислоты содержат в
радикале R дополнительный кислотный центр. К ним относятся аспаргиновая и
глутаминовая кислоты. В кислой среде они существуют в виде катиона и являются
трехосновными кислотами. Изоэлектрическая точка этих аминокислот лежит в области
рН много ниже 7.
Тирозин и цистеин содержат в боковых радикалах
слабые кислотные центры, способные к ионизации при высоких значениях рН.
Важное значение имеет тот факт, что при
физиологическом значении рН (
7) ни одна аминокислота не находится в
изоэлектрической точке. В организме все аминокислоты ионизированы, что
обеспечивает им хорошую растворимость в воде.
Различие в кислотно-основных свойствах
используется для разделения аминокислот методом электрофореза и ионообменной
хроматографии. При данном значении рН разные аминокислоты могут иметь разный по
величине и знаку электрический заряд. Например, при рН6 лизин имеет заряд +1 и
движется к катоду, аспаргиновая кислота имеет заряд –1 и перемещается к аноду, а
аланин находится в изоэлектрической точке и не перемещается в электрическом поле. Таким образом при рН6 они могут быть
разделены с помощью электрофореза.
Для разделения аминокислот методом ионообменной
хроматографии используют катионообменные смолы (сульфированный полистирол).
Процесс ведут в кислой среде, когда аминокислоты находятся катионной
форме.
Скорость продвижения аминокислот по
хроматографической колонке зависит от силы их электростатических и гидрофобных
взаимодействий со смолой. Наиболее прочно связываются со смолой основные
аминокислоты, имеющие наибольший положительный заряд, наименее прочно – кислые
аминокислоты. Наибольшим гидрофобным связыванием со смолой обладают аминокислоты
с неполярными боковыми радикалами, особенно ароматическими. Таким образом,
порядок элюирования аминокислот следующий. Легче других элюируются кислые
аминокислоты (Asp и Glu), следом за ними идут аминокислоты, содержащие полярные
неионогенные группы (Ser, Thr, Asn, Gln), затем из колонки вымываются
аминокислоты с неполярными боковыми радикалами (Phe, Trp, Ile и др.) и в
последнюю очередь элюируются основные аминокислоты (His, Lys, Arg).
Восстановительное аминирование – метод
синтеза a -аминокислот из a -оксокислот при участии кофермента НАД Н в качестве
восстанавливающего реагента.
Трасаминирование – основной
путь биосинтеза аминокислот. При трансаминировании происходит взаимообмен двух
функциональных групп – аминной и карбонильной между аминокислотой и кетокилотой.
При этом нужная для организма аминокислота 1 синтезируется из аминокислоты 2,
имеющейся в клетках в избыточном коичестве. Реакция осуществляется при участии
ферментов трансаминаз и кофермента пиридоксальфосфата.
Содержащий альдегидную группу пиридоксальфосфат
служит переносчиком аминогруппы в виде основания Шиффа.
Аминокислоты декарбоксилируются под действием
ферментов декарбоксилаз при участи кофермента пиридоксальфосфата. При этом
образуются биогенные амины.
Биогенные амины обладают ярко выраженной
биологической активностью. Важнейшими из них являются — коламин (предшественник
в синтезе холина и нейромедиатора ацетилхолина), гистамин (обеспечивает
аллергические реакции организма), g -аминомасляная кислота (нейромедиатор), адреналин
(гормон надпочечников, нейромедиатор)
Неокислительное дезаминирование происходит путем
отщепления аммиака под действием ферментов с образованием a , b -непредельных кислот.
Окислительное дезаминирование происходит
при участии ферментов оксидаз и кофермента НАД + , который выступает в качестве окислителя. В результате
выделяется аммиак и образуется соответствующая кетокислота.
С помощью реакций дезаминирования снижается
избыток аминокислот в организме.
Петиды – это полиамиды, построенные из a -аминокислот. По числу аминокислотных остатков в
молекуле пептида различают дипептиды, трипептиды, тетрапептиды и т.д.
Пептиды, содержащие до 10 аминокислотных остатков, называют олигопептидами, более 10 аминокислотных остатков – полипептидами.
Природные полипептиды, включающие более 100 аминокислотных остатков, называют белками .
Формально пептиды можно рассматривать как продукты поликонденсации
аминокислот.
Аминокислотные остатки в пептиде связаны
амидными (пептидными) связями. Один конец цепи, на котором находится
аминокислота со свободной аминогруппой, называют N-концом. Другой конец,
на котором находится аминокислота со свободной карбоксильной группой, называют С-концом. Пептиды принято записывать и называть, начиная с
N-конца.
Название пептида строят на основе тривиальных
названий, входящих в его состав аминокислотных остатков, которые перечисляют,
начиная с N-конца. При этом в названиях всех аминокислот за исключением
С-концевой суффикс “ин” заменяют на суффикс “ил”. Для сокращенного обозначения
пептидов используют трехбуквенные обозначения входящих в его состав
аминокислот.
Пептид характеризуется аминокислотным
составом и аминокислотной последовательностью.
Аминокислотный состав пептида может быть
установлен путем полного гидролиза пептида (расщепления до аминокислот) с
последующим качественным и количественным анализом образовавшихся аминокислот
методом ионобменной хроматографии или ГЖХ-анализом сложных эфиров аминокислот.
Полный гидролиз пептидов проводят в кислой среде при кипячении их с 6н.
HCl.
Одному и тому же аминокислотному составу
отвечает несколько пептидов. Так, из 2-х разных аминокислот может быть построено
2 дипептида, из трех разных аминокислот – 6 трипептидов, из n разных аминокислот
n! пептидов одинакового состава. Например, составу Gly:Ala:Val=1:1:1 отвечают
следующие 6 трипептидов.
Gly-Ala-Val Gly- Val-Ala Val-Gly-Ala Val-Ala-Gly Ala-Gly-Val
Ala-Val-Glu
Таким образом, для полной характеристики пептида
необходимо знать его аминокислотный состав и аминокислотную
последовательность.
4.2. Определение аминокислотной
последовательности
Для определения аминокислотной
последовательности используют комбинацию двух методов: определение концевых
аминокислот и частичный гидролиз .
Определение N-концевых
аминокислот.
Метод Сегнера . Пептид обрабатывают 2,4-динитрофтробензолом (ДНФБ), а
затем полностью гидролизуют. Из гидролизата выделяют и идентифицируют
ДНФ-производное N-концевой аминокислоты.
Метод Эдмана состоит во
взаимодействии N-концевой аминокислоты с фенилизотиоцианатом в щелочной среде.
При дальнейшей обработке слабой кислотой без нагревания происходит отщепление от
цепи “меченой” концевой аминокислоты в виде фенилгидантоинового (ФТГ)
производного.
Преимущество этого метода состоит в том, что при
отщеплении N-концевой аминокислоты пептид не разрушается и операцию по
отщеплению можно повторять. Метод Эдмана используют в автоматическом приборе –
секвенаторе, с помощью которого можно осуществить 40 – 50 стадий отщепления,
идентифицируя полученные на каждой стадии ФТГ-производные методом газожидкостной
хроматографии.
Частичный гидролиз полипептидов
При частичном гидролизе пептиды расщепляются с
образованием более коротких цепей. Частичный гидролиз проводят с помощью
ферментов, которые гидролизуют пептидные связи избирательно, например, только с
N-конца (аминопептидазы) или только с С-конца (карбоксипептидазы).
Существуют ферменты, расщепляющие пептидные связи только между определенными
аминокислотами. Меняя условия гидролиза, можно разбить пептид на различные
фрагменты, которые перекрываются по составляющим их аминокислотным остаткам.
Анализ продуктов частичного гидролиза позволяет воссоздать структуру исходного
пептида. Рассмотрим простейший пример установления структуры трипептида.
Частичный гидролиз по двум разным направлениям трипептида неизвестного строения
дает продукты представленные на схеме.
Единственный трипептид, структура которого не
противоречит продуктам частичного гидролиза – Gly-Ala-Phe.
Установление аминокислотной последовательности
пептидов, содержащих несколько десятков аминокислотных остатков, – более сложная
задача, которая требует комбинации различных методов.
Синтез пептида с заданной аминокислотной
последовательностью – чрезвычайно сложная задача. В простейшем случае синтеза
дипептида из 2-х разных аминокислот возможно образование 4-х разных
продуктов.
В настоящее время разработана стратегия синтеза
пептидов, основанная на использовании методов активации и защиты функциональных групп на соответствующих этапах синтеза. Процесс синтеза
дипептида включает следующие стадии:
- защита аминогруппы N-концевой
аминокислоты; - активация карбоксильной группы N-концевой
аминокислоты; - конденсация модифицированных
аминокислот - снятие защитных групп
Таким образом, последовательно присоединяя
аминокислоты, шаг за шагом наращивают цепь полипептида. Такой синтез очень
длителен, трудоемок и дает низкий выход конечного продукта. Основные потери
связаны с необходимостью выделения и очистки продуктов на каждой стадии.
Этих недостатков лишен используемый в настоящее
время твердофазный синтез пептидов. На первой стадии защищенная по
аминогруппе С-концевая аминокислота закрепляется на твердом полимерном носителе
(полистироле, модифицированном введением групп –CH 2 Cl). После снятия защиты проводят ацилирование
аминогруппы закрепленной на носителе аминокислоты другой аминокислотой, которая
содержит активированную карбоксильную и защищенную аминогруппу. После снятия
защиты проводят следующую стадию ацилирования. Отмывание продукта от примесей
проводят прямо на носителе и лишь после окончания синтеза полипептид снимают с
носителя действием бромистоводородной кислоты. Твердофазный синтез
автоматизирован и проводится с помощью приборов – автоматических
синтезаторов.
;
Методом твердофазного синтеза получено большое
количество пептидов, содержащих 50 и более аминокислотных остатков, в том числе
инсулин (51 аминокислотный остаток) и рибонуклеаза (124 аминокислотных
остатка).
Видео:Определение pI (изоэлектрической точки) пептидов. Биохимия.Скачать

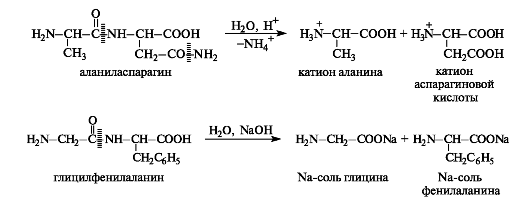
Кислотный и щелочной гидролиз пептидов.
Специфичность пептидов и белков определяется двумя важнейшими характеристиками — аминокислотным составом и аминокислотной последовательностью. Аминокислотный состав пептидов и белков — это природа и количественное соотношение входящих в них α-аминокислот. Аминокислотный состав устанавливается путем анализа пептидных и белковых гидролизатов в основном хроматографическими методами. В настоящее время такой анализ осуществляется с помощью аминокислотных анализаторов.
Амидные связи способны гидролизоваться как в кислой, так и щелочной среде. Пептиды и белки гидролизуются с образованием либо более коротких цепей — это так называемый частичный гидролиз, либо смеси аминокислот (в ионной форме) — полный гидролиз. Гидролиз пептидов может происходить в кислой или щелочной среде, а также под действием ферментов. Ферментативный гидролиз важен тем, что протекает селективно, т.е. позволяет расщеплять строго определенные участки пептидной цепи.
Обычно гидролиз осуществляют в кислой среде, так как в условиях щелочного гидролиза многие аминокислоты неустойчивы. Следует отметить, что гидролизу подвергаются также амидные группы аспарагина и глутамина.
Первичную структуру пептидов и белков определяют путем последовательного отщепления аминокислот с какого-либо конца цепи и их идентификации.
💡 Видео
Задача на определение формулы трипептида. Биохимия.Скачать

Совместный гидролиз в реакциях ионного обмена: за что?! | Химия ЕГЭ | УмскулСкачать

Образование пептидов. Запись структурной формулы пептидаСкачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Кислотный и щелочной гидролиз бинарных соединений | Химия ЕГЭ 2023 | УмскулСкачать

13.3. Сложные эфиры: Химические свойстваСкачать

Степень гидролиза и как её рассчитатьСкачать

ГИДРОЛИЗ СЛОЖНЫХ ЭФИРОВ И ПЕПТИДОВСкачать

Пептиды. Метод Эдмана.Скачать
Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Щелочной гидролиз дибутилфталата (Alkaline hydrolysis of dibutyl phthalate)Скачать

Опыты по химии. Цветные реакции белка: биуретовая; ксантопротеиноваяСкачать

Решение задач на пластинки | Решение задач по химии | Химия ЕГЭ, ЦТ, ЦЭСкачать

Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Реакции диспропорционирования | Химия ЕГЭСкачать

Окислительно-восстановительные реакции в нейтральной среде. Продвинутый подход.Скачать

Биохимия | Синтез жиров и фосфолипидовСкачать