Химия | 10 — 11 классы
Как из Метанола получить Диметиловый эфир.
Нагревание метанола в присутствии серной кислоты при температуре 120 — 140 градусов ведет к межмолекулярной дегидратации с образованием диметилового эфира.
- Осуществить превращения : а)ацетат натрия — метан — хлорметан — метанол — диметиловый эфир?
- Составьте уравнения реакций, с помощью которых можно осуществить следущие превращения : метан→метаналь→метанол→диметиловый эфир→углекислый газ?
- С какой парой веществ реагирует пропановая кислота а) метанол и магний ; б) диметиловый эфир и медь ; в) гидроксид натрия и азот ; г) соляная кислота и магний?
- Изомерами являются бензол и толуол ; пропанол и пропановая кислота ; этанол и диметиловый эфир ; этанол и фенол?
- Написать цепочку превращений метан — ацетилен — этаналь — этилен — этанол — диметиловый эфир спасибо заранее?
- Составьте уравнения реакций, с помощью которых из метанола можно получить : а)диметиловый эфир б)натрий — метилат в)метиловый эфир уксусной кислоты Пожалуйсто?
- Как получить из метилового эфира уксусной кислоты метанол?
- Почему диметиловый эфир и этиловый спирт, имеющие одинаковую формулу C2H60 обладают различными свойствами?
- Из 48 граммов метилового спирта было получено 27, 6 граммов диметилового эфира?
- Определите массу уксусно — метилового эфира который получится при взаимодействии 60Г уксусной кислоты и 64Г метанола?
- Метанол: химические свойства и получение
- Строение метанола
- Водородные связи и физические свойства метанола
- Изомерия метанола
- Химические свойства метанола
- 1.1. Взаимодействие с раствором щелочей
- 1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
- 2. Реакции замещения группы ОН
- 2.1. Взаимодействие с галогеноводородами
- 2.2. Взаимодействие с аммиаком
- 2.3. Этерификация (образование сложных эфиров)
- 2.4. Взаимодействие с кислотами-гидроксидами
- 3. Реакции замещения группы ОН
- 3.2. Межмолекулярная дегидратация
- 4. Окисление метанола
- 4.1. Окисление оксидом меди (II)
- 4.2. Окисление кислородом в присутствии катализатора
- 4.3. Жесткое окисление
- 4.4. Горение метанола
- 5. Дегидрирование спиртов
- Получение метанола
- 1. Щелочной гидролиз галогеналканов
- 2. Гидратация алкенов
- 3. Гидрирование карбонильных соединений
- 4. Промышленное получение метанола из «синтез-газа»
- Получение диметилового эфира из синтез-газа на базе метанольного производства (стр. 1 )
Видео:Простые эфиры. Получение. Все 4 реакции ЕГЭ.Скачать

Осуществить превращения : а)ацетат натрия — метан — хлорметан — метанол — диметиловый эфир?
Осуществить превращения : а)ацетат натрия — метан — хлорметан — метанол — диметиловый эфир.
Б)этилен — этанол — этаналь — этановая кислота — ацетат натрия.
В)крахмал — — этанол — — этилен — — 1, 2 — дихлорэтан — — этиленгликоль.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Составьте уравнения реакций, с помощью которых можно осуществить следущие превращения : метан→метаналь→метанол→диметиловый эфир→углекислый газ?
Составьте уравнения реакций, с помощью которых можно осуществить следущие превращения : метан→метаналь→метанол→диметиловый эфир→углекислый газ.
Видео:Объемные отношения газов при химических реакциях. 8 класс.Скачать

С какой парой веществ реагирует пропановая кислота а) метанол и магний ; б) диметиловый эфир и медь ; в) гидроксид натрия и азот ; г) соляная кислота и магний?
С какой парой веществ реагирует пропановая кислота а) метанол и магний ; б) диметиловый эфир и медь ; в) гидроксид натрия и азот ; г) соляная кислота и магний.
Видео:Синтез диэтилового эфираСкачать

Изомерами являются бензол и толуол ; пропанол и пропановая кислота ; этанол и диметиловый эфир ; этанол и фенол?
Изомерами являются бензол и толуол ; пропанол и пропановая кислота ; этанол и диметиловый эфир ; этанол и фенол.
Видео:25. Схема реакции и химическое уравнениеСкачать

Написать цепочку превращений метан — ацетилен — этаналь — этилен — этанол — диметиловый эфир спасибо заранее?
Написать цепочку превращений метан — ацетилен — этаналь — этилен — этанол — диметиловый эфир спасибо заранее.
Видео:Габриелян О. С. 8 класс §30 "Реакции разложения".Скачать

Составьте уравнения реакций, с помощью которых из метанола можно получить : а)диметиловый эфир б)натрий — метилат в)метиловый эфир уксусной кислоты Пожалуйсто?
Составьте уравнения реакций, с помощью которых из метанола можно получить : а)диметиловый эфир б)натрий — метилат в)метиловый эфир уксусной кислоты Пожалуйсто.
Видео:Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

Как получить из метилового эфира уксусной кислоты метанол?
Как получить из метилового эфира уксусной кислоты метанол.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Почему диметиловый эфир и этиловый спирт, имеющие одинаковую формулу C2H60 обладают различными свойствами?
Почему диметиловый эфир и этиловый спирт, имеющие одинаковую формулу C2H60 обладают различными свойствами?
Видео:7 класс. Химия. Реакция нейтрализацииСкачать

Из 48 граммов метилового спирта было получено 27, 6 граммов диметилового эфира?
Из 48 граммов метилового спирта было получено 27, 6 граммов диметилового эфира.
Сколько это составляет по сравнению с теоретически возможным?
Видео:Реакции присоединения | Химия 10 класс | УмскулСкачать

Определите массу уксусно — метилового эфира который получится при взаимодействии 60Г уксусной кислоты и 64Г метанола?
Определите массу уксусно — метилового эфира который получится при взаимодействии 60Г уксусной кислоты и 64Г метанола.
Вы открыли страницу вопроса Как из Метанола получить Диметиловый эфир?. Он относится к категории Химия. Уровень сложности вопроса – для учащихся 10 — 11 классов. Удобный и простой интерфейс сайта поможет найти максимально исчерпывающие ответы по интересующей теме. Чтобы получить наиболее развернутый ответ, можно просмотреть другие, похожие вопросы в категории Химия, воспользовавшись поисковой системой, или ознакомиться с ответами других пользователей. Для расширения границ поиска создайте новый вопрос, используя ключевые слова. Введите его в строку, нажав кнопку вверху.
Видео:8-9 класс. Реакции ионного обмена (практика)Скачать

Метанол: химические свойства и получение
Метанол CH3OH, метиловый спирт – это органическое вещество, предельный одноатомный спирт .
Общая формула предельных нециклических одноатомных спиртов: CnH2n+2O.
Видео:Типичные реакции оснований | Химия 8 класс #46 | ИнфоурокСкачать

Строение метанола
В молекулах спиртов, помимо связей С–С и С–Н, присутствуют ковалентные полярные химические связи О–Н и С–О.
| Электроотрицательность кислорода (ЭО = 3,5) больше электроотрицательности водорода (ЭО = 2,1) и углерода (ЭО = 2,4). |
Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
| Атом кислорода в спиртах находится в состоянии sp 3 -гибридизации. |
В образовании химических связей с атомами C и H участвуют две 2sp 3 -гибридные орбитали, а еще две 2sp 3 -гибридные орбитали заняты неподеленными электронными парами атома кислорода.
Поэтому валентный угол C–О–H близок к тетраэдрическому и составляет почти 108 о .
Водородные связи и физические свойства метанола
Спирты образуют межмолекулярные водородные связи. Водородные связи вызывают притяжение и ассоциацию молекул спиртов:
Поэтому метанол – жидкость с относительно высокой температурой кипения (температура кипения метанола +64,5 о С).
Водородные связи образуются не только между молекулами метанола, но и между молекулами метанола и воды. Поэтому метанол очень хорошо растворимы в воде. Молекулы метанола в воде гидратируются:
| Чем больше углеводородный радикал, тем меньше растворимость спирта в воде. Чем больше ОН-групп в спирте, тем больше растворимость в воде. |
Метанол смешивается с водой в любых соотношениях.
Видео:Реакции ионного обмена. 9 класс.Скачать

Изомерия метанола
Для метанола не характерно наличие структурных изомеров – ни изомеров углеродного скелета, ни изомеров положения гидроксильной группы, ни межклассовых изомеров.
Видео:Реакция нейтрализации этоСкачать

Химические свойства метанола
Метанол – органическое вещество, молекула которого содержит, помимо углеводородной цепи, одну группу ОН.
1. Кислотные свойства метанола
| Метанол – неэлектролит, в водном растворе не диссоциирует на ионы; кислотные свойства у него выражены слабее, чем у воды. |
1.1. Взаимодействие с раствором щелочей
Метанол с растворами щелочей практически не реагирует, т. к. образующиеся алкоголяты почти полностью гидролизуются водой.
Равновесие в этой реакции так сильно сдвинуто влево, что прямая реакция не идет. Поэтому метанол не взаимодействуют с растворами щелочей.
1.2. Взаимодействие с металлами (щелочными и щелочноземельными)
Метанол взаимодействуют с активными металлами (щелочными и щелочноземельными). При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты.
| Например, метанол взаимодействует с калием с образованием метилата калия и водорода . |
Метилаты под действием воды полностью гидролизуются с выделением спирта и гидроксида металла.
| Например, метилат калия разлагается водой: |
CH3OK + H2O → CH3-OH + KOH
Видео:Все реакции разложения в неорганике | Химия ЕГЭ 2022 | УмскулСкачать

2. Реакции замещения группы ОН
2.1. Взаимодействие с галогеноводородами
При взаимодействии метанола с галогеноводородами группа ОН замещается на галоген и образуется галогеналкан.
| Например, метанол реагирует с бромоводородом. |
2.2. Взаимодействие с аммиаком
Гидроксогруппу спиртов можно заместить на аминогруппу при нагревании спирта с аммиаком на катализаторе.
| Например, при взаимодействии метанола с аммиаком образуется метиламин. |
2.3. Этерификация (образование сложных эфиров)
Метанол вступает в реакции с карбоновыми кислотами, образуя сложные эфиры.
| Например, метанол реагирует с уксусной кислотой с образованием метилацетата (метилового эфира уксусной кислоты): |
2.4. Взаимодействие с кислотами-гидроксидами
Спирты взаимодействуют и с неорганическими кислотами, например, азотной или серной.
| Например, метанол взаимодействует с азотной кислотой : |
Видео:ХИМИКИ И ФИЗИКИ НАМ ВРУТ. ФАЛЬСИФИКАЦИЯ ТАБЛИЦЫ МЕНДЕЛЕЕВА. ПОЧЕМУ ИЗ ТАБЛИЦЫ ИЗЪЯЛИ ЭЛЕМЕНТ ЭФИРСкачать

3. Реакции замещения группы ОН
В присутствии концентрированной серной кислоты от метанола отщепляется вода. Процесс дегидратации протекает по двум возможным направлениям: внутримолекулярная дегидратация и межмолекулярная дегидратация.
3.2. Межмолекулярная дегидратация
При низкой температуре (меньше 140 о С) происходит межмолекулярная дегидратация по механизму нуклеофильного замещения: ОН-группа в одной молекуле спирта замещается на группу OR другой молекулы. Продуктом реакции является простой эфир.
| Например, при дегидратации метанола при температуре до 140 о С образуется диметиловый эфир: |
Видео:Определение порядка реакции методом подбора кинетического уравненияСкачать

4. Окисление метанола
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на каталитическое, мягкое и жесткое.
| Метанол окисляется сначала в формальдегид, затем в углекислый газ: Метанол → формальдегид → углекислый газ |
Типичные окислители — оксид меди (II), перманганат калия KMnO4, K2Cr2O7, кислород в присутствии катализатора.
Легкость окисления спиртов уменьшается в ряду:
метанол
4.1. Окисление оксидом меди (II)
Метанол можно окислить оксидом меди (II) при нагревании. При этом медь восстанавливается до простого вещества. Метанол окисляется до метаналя.
| Например, метанол окисляется оксидом меди до муравьиного альдегида |
4.2. Окисление кислородом в присутствии катализатора
Метанол можно окислить кислородом в присутствии катализатора (медь, оксид хрома (III) и др.). Метанол окисляется до метаналя.
4.3. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) метанол окисляется до углекислого газа.
| Спирт/ Окислитель | KMnO4, кислая среда | KMnO4, H2O, t |
| Метанол СН3-ОН | CO2 | K2CO3 |
| Например, при взаимодействии метанола с перманганатом калия в серной кислоте образуется углекислый газ |
4.4. Горение метанола
При сгорании спиртов образуются углекислый газ и вода и выделяется большое количество теплоты.
| Например, уравнение сгорания метанола: |
Видео:Занятие 4. "Энергетический профиль химической реакции".Скачать
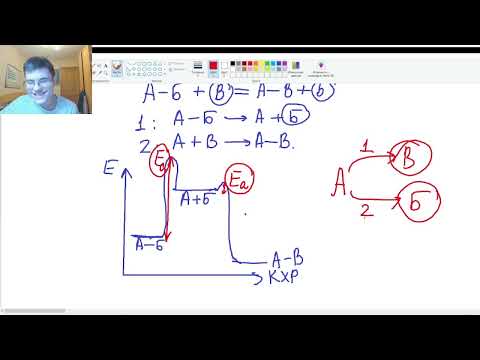
5. Дегидрирование спиртов
При нагревании спиртов в присутствии медного катализатора протекает реакция дегидрирования. При дегидрировании метанола образуется альдегид.
Видео:Получение МЕТАНОЛАСкачать

Получение метанола
Видео:Решение задач по уравнениям параллельно протекающих реакций. 2 часть. 11 класс.Скачать

1. Щелочной гидролиз галогеналканов
При взаимодействии галогеналканов с водным раствором щелочей образуются спирты. Атом галогена в галогеналкане замещается на гидроксогруппу.
| Например, при нагревании хлорметана с водным раствором гидроксида натрия образуется метанол |
2. Гидратация алкенов
Гидратация (присоединение воды) алкенов протекает в присутствии минеральных кислот. При присоединении воды к алкенам образуются спирты.
Однако получить метанол гидратацией алкенов нельзя.
3. Гидрирование карбонильных соединений
Присоединение водорода к альдегидам и кетонам протекает при нагревании в присутствии катализатора. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, а из формальдегида образуется метанол.
| Например, при гидрировании формальдегида образуется метанол |
CH2=O + H2 → CH3-OH
4. Промышленное получение метанола из «синтез-газа»
Каталитический синтез метанола из монооксида углерода и водорода при 300-400°С и давления 500 атм в присутствии смеси оксидов цинка, хрома и др.
Сырьем для синтеза метанола служит «синтез-газ» (смесь CO и H2), обогащенный водородом:
Получение диметилового эфира из синтез-газа на базе метанольного производства (стр. 1 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 |
На правах рукописи
ЛЯХИН Дмитрий Владимирович
ПОЛУЧЕНИЕ ДИМЕТИЛОВОГО ЭФИРА ИЗ СИНТЕЗ-ГАЗА
НА БАЗЕ МЕТАНОЛЬНОГО ПРОИЗВОДСТВА
Специальность 05. 17. 01
Технология неорганических веществ
диссертации на соискание учёной степени
кандидата технических наук
Работа выполнена в Государственном образовательном учреждении
высшего профессионального образования Ивановский государственный химико-технологический университет на кафедре «Технология неорганических веществ»
и в акционерная компании «Азот»
доктор технических наук, профессор
доктор технических наук, профессор
доктор технических наук, профессор
Южно-Российский государственный технический университет (Новочеркасский политехнический институт)
– Катализатор», г. Новомосковск
Защита состоится 9 февраля 2009 г. в 10 час. на заседании Совета по защите докторских и кандидатских диссертаций Д. 212.063.02 при Государственном образовательном учреждении высшего профессионального образования Ивановский государственный химико-технологический университет по адресу:
153000, г. Иваново, пр. Энгельса, 7, ауд. Г — 205.
С диссертацией можно ознакомиться в библиотеке ГОУ ВПО ИГХТУ г. Иваново, пр. Энгельса, 10.
Автореферат диссертации разослан 23 декабря 2008 г.
Совета по защите докторских и кандидатских диссертаций, д. т.н., ст. н.с.
Общая характеристика работы
Актуальность темы диссертации. Синтез-газ (оксиды углерода и водород) является исходным сырьём для ценных химических продуктов, в том числе метанола. Технология синтетического метанола хорошо отработана, а его производство получило значительное распространение из-за широкого использования метилового спирта в промышленности. В последнее время становится актуальным получение и использование диметилового эфира (ДМЭ), производство которого может быть основано или на реакции дегидратации метанола, или на прямом получении его из синтез-газа.
ДМЭ позволяет решить приобретающие все большую остроту ряд проблем ухудшения окружающей среды, включающие атмосферное загрязнение и истощение ресурсов. ДМЭ относится к хладагентам, обладающим нулевым значением потенциала озоноразрушения (ODP). Использование ДМЭ в качестве моторного топлива позволяет радикально улучшить качество выхлопа дизельных двигателей с уменьшением выброса вредных компонентов. ДМЭ, в качестве полупродукта, легко превращается в бензин, характеризующийся улучшенными экологическими характеристиками (преобладание разветвленных углеводородов) и минимальным содержанием нежелательных примесей.
В настоящее время, как в России, так и за рубежом имеются разработки технологии прямого получения ДМЭ из синтез-газа, минуя стадию синтеза и очистки метанола, что является наиболее прогрессивным и экономичным решением. Для получения ДМЭ возможно использовать оборудование метанольного производства, имеющего близкую технологию, что позволяет существенно снизить капитальные затраты на новое строительство. В тоже время, практический опыт эксплуатации промышленных установок синтеза ДМЭ почти отсутствует. Нет готовых технических решений и хорошо отработанных технологий. Серийный выпуск промышленного катализатора синтеза ДМЭ не налажен, также как и отсутствует опыт его эксплуатации. Кроме того, необходима разработка технологии выделения и очистки ДМЭ. Отсутствуют разработки методов анализа состава ДМЭ, полученного по промышленной технологии из синтез-газа. Поэтому работы, направленные на усовершенствование технологической схемы получения ДМЭ из синтез-газа на базе метанольного производства и последующей его очистки является актуальными.
Цель работы. На основе изучения процессов каталитического синтеза и выделения чистого ДМЭ разработать мероприятия, позволяющие улучшить технологию получения диметилового эфира из синтез-газа. Для решения поставленной задачи необходимо:
1. Исследовать свойства различных каталитических систем, в том числе гибридных катализаторов, в процессе дегидратации метанола и прямого синтеза ДМЭ из синтез-газа;
2. Идентифицировать параметры кинетического уравнения каталитической реакции дегидратации метанола;
3. Разработать математическую модель каталитического процесса получения ДМЭ и провести численное моделирование для промышленного реактора с целью выбора рациональных режимов работы;
4. Провести промышленные испытания катализатора прямого синтеза ДМЭ из синтез-газа;
5. Исследовать процесс выделения и очистки ДМЭ в промышленных условиях и разработать мероприятия по усовершенствованию данной технологии;
6. Разработать методику выполнения измерений состава ДМЭ для контроля качества продукта.
Научная новизна работы заключается в том, что, научный подход к решению производственной задачи получения диметилового эфира использован на основных стадиях действующего метанольного производства:
— исследованы нанесённые катализаторы и их комбинации с промышленным катализатором синтеза метанола, обеспечивающие получение диметилового эфира из метанола и синтез-газа;
— методом математического моделирования установлены рациональные режимы эксплуатации и способы загрузки катализаторов в реактор для получения метанола и диметилового эфира;
— на основании теоретических расчетов и экспериментальных данных по состоянию гетерогенной системы «жидкий диметиловый эфир – диоксид углерода» предложены технические решения по улучшению технологической схемы ректификации для получения чистого ДМЭ.
Практическая значимость работы
— Проведена апробация процесса совместного получения метанола и диметилового эфира на действующем оборудовании метанольного производства, установлены режимы его промышленного получения из синтез-газа и направления усовершенствования технологии.
— Усовершенствована технологическая схема ректификации метанола-сырца с выделением чистого ДМЭ, что позволило снизить содержание примесей в продукте и сократить его потери со сдувками.
— Разработана методика анализа диметилового эфира, которая включена в технические условия на ДМЭ: ТУ 2434-059-05761643-2001 «Эфир диметиловый жидкий», аттестована в соответствии с требованиями ГОСТ Р 8.563-96 и зарегистрирована в ФГУП «ВНИИМС».
Достоверность результатов основывается на применении современных методов исследования, воспроизводимостью данных в пределах заданной точности анализа и проверкой адекватности моделей по результатам промышленных испытаний гибридного катализатора и системы разделения продуктов синтеза.
Личный вклад автора заключается:
— в проведении экспериментальных исследований по изучению активности нанесённых и гибридных катализаторов в процессах получения ДМЭ;
— в постановке и решению технической задачи по математическому моделированию процесса синтеза ДМЭ в реакторе;
— в разработке программы и участии в проведении промышленных испытаний бифункционального катализатора получения ДМЭ, анализе и обобщении результатов обследования промышленного агрегата синтеза ДМЭ;
— в расчёте процесса и разработке технических решений по совершенствованию технологической схемы ректификации;
— в постановке задачи и участии в разработке методики анализа жидкого ДМЭ.
Апробация работы. Основные положения и результаты работы докладывались и обсуждались на следующих конференциях:
II Украинской научно-технической конференции по катализу, Северодонецк, 2000г., Всероссийской научно-технической конференции по технологии неорганических веществ, Казань, 2001г., Международной научной конференции «Математические методы в технике и технологии», Казань, 2005г., V международной научно-технической конференции по катализу «Укркатализ – V», Киев, 2006г., VI Российской конференции «Научные основы приготовления и технологии катализаторов», г. Туапсе, 2008г.
Публикации. По теме диссертации опубликовано 10 печатных работ из них 3 статьи в периодических научных изданиях и 7 тезисов докладов на научно-технических конференциях.
Структура и объём диссертации. Диссертация состоит из введения, 6 глав, выводов, списка использованной литературы из 106 наименований и приложений. Работа изложена на 156 страницах, содержит 41 рисунок и 31 таблицу.
Во введении обосновывается актуальность темы диссертации, формулируются цели и задачи исследования, научная новизна и практическая значимость работы.
В первой главе приводится литературный обзор. Рассматриваются различные каталитические системы в процессе дегидратации метанола с получением ДМЭ, а также синтеза ДМЭ или совместного синтеза метанола и ДМЭ в процессах гидрирования СО и СО2, при этом образование ДМЭ происходит на сложных катализаторах, включающих кислотные центры, образованные оксидом алюминия и другими модифицированными носителями. Рассмотрены различные схемы получения метилформиата. Представлены результаты исследования различных каталитических систем в процессе дегидрирования метанола с образованием метилформиата. Описаны результаты исследований по изучению оксидных и серебросодержащих каталитических систем в процессах переработки метанола в формальдегид. Представлены предлагаемые исследователями механизмы процессов получения ДМЭ как дегидратацией метанола, так и его синтезом из СО-содержащего газа. Описан механизм бифункционального катализа ДМЭ из синтез-газа. Также рассмотрен механизм получения метилформиата и формальдегида из метанола. Рассмотрены технологические схемы и условия проведения процесса получения и выделения ДМЭ.



















