Цель: провести экспериментально реакцию окисления одноатомных насыщенных спиртов.
Оборудование и реактивы: штатив с пробирками, щипцы, спиртовка, медная проволока, скрученная на конце в спираль; этанол.
1. Налейте в пробирку примерно 1 см 3 этанола и поставьте ее в штатив.
2. Прокалите в пламени спиртовки конец медной проволоки, скрученной в спираль, пока медь не покроется слоем оксида, и опустите горячую проволочную спираль в пробирку с этанолом.
3. Повторите 5—6 раз операцию прокаливания медной спирали и внесения ее в пробирку со спиртом. Убедитесь по запаху, что в пробирке появилось новое вещество. Результаты исследования, наблюдения, запишите в таблицу:
4. Составьте уравнения реакций окисления меди и окисления спирта.
а) (При каких условиях происходит окисление этанола?):
Окисление этанола происходит при повышенной температуре.
б) (К какому классу органических соединений относится основной продукт проведенной реакции?):
Продукт реакции (этаналь) относится к альдегиде.
- Лабораторный опыт 6. Окисление спирта в альдегид. ГДЗ Химия 10-11 класс Цветков.
- Написать уравнение реакции происходящей при накаливании меди
- Методические указания для студентов по выполнению лабораторных работ по химии (стр. 4 )
- Лабораторная работа №8
- Окисление спирта в альдегид, окисление альдегида.
- Свойства уксусной кислоты.
- Лабораторная работа №9
- Прокаливание медной проволоки и взаимодействие с серной кислотой. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 1.
- Оксид меди 2, химическая формула и свойства
- CuO (II)
- Химическая формула: CuO
- Реакция CuO NaOH
- Опыт №3. Окисление этилового спирта оксидом меди (II)
- 🌟 Видео
Видео:Окисление этанола оксидом меди (II). Опыт 3Скачать

Лабораторный опыт 6. Окисление спирта в альдегид. ГДЗ Химия 10-11 класс Цветков.
Какие тут подсказки?
1. На конце медной проволоки сделайте 5-6 витков спирали.
2. Налейте в пробирку не более 1 мл этилового спирта, накалите медную спираль в пламени горелки, чтобы медь покрылась черным налетом оксида, и быстро опустите спираль в пробирку со спиртом. Повторите эту операцию несколько раз. Обратите внимание на запах образующегося альдегида и на изменения, происходящие со спиралью.
3. Составьте уравнения реакций окисления меди при накаливании и окисления спирта в альдегид оксидом меди (II).
Видео:Опыты по химии. Окисление спирта в альдегидСкачать

Написать уравнение реакции происходящей при накаливании меди
Видео:Окисление этилового спирта оксидом меди(II)Скачать

Методические указания для студентов по выполнению лабораторных работ по химии (стр. 4 )
 | Из за большого объема этот материал размещен на нескольких страницах: 1 2 3 4 5 |
Выньте газоотводную трубку из раствора, поверните отверстием вверх. Подожгите выделяющийся газ. Прекратите нагревание, потушите спиртовку.
1. Напишите уравнение реакции получения этилена.
2. Напишите уравнения реакций взаимодействия этилена с йодной водой и с раствором перманганата калия.
Почему йодная вода и раствор перманганата калия обесцветились?
3. Назовите получающиеся продукты реакций.
4. Как горит этилен, напишите уравнение реакции горения этилена.
5. На основании проведенных опытов сделайте вывод о принадлежности этилена к определенному классу углеводородов.
Опыт №2 Получение ацетилена и его свойства
Реактивы: карбид кальция — СаС2, вода, йодная вода, раствор перманганата калия, газоотводная трубка.
2.1 . Получение ацетилена.
Выполнение опыта: В пробирку поместите несколько кусочков карбида кальция, прилейте воды, предварительно укрепив пробирку в штативе, закройте пробкой с газоотводной трубкой.
Свойства ацетилена. Доказательство его непредельности.
Выполнение опыта: Опустите конец газоотводной трубки в пробирку с йодной водой, затем в пробирку с раствором перманганата калия до обесцвечивания их содержимого.
Подожгите ацетилен. Обратите внимание на пламя.
1.Напишите уравнение реакции получения ацетилена карбидным способом.
2. Напишите уравнение реакции взаимодействия ацетилена с йодной водой в две стадии. Назовите продукты реакции.
3. Почему йодная вода и раствор перманганата калия обесцветились?
4. Сравните процесс горения ацетилена с этиленом, напишите уравнение реакций горения ацетилена.
5. Сделайте вывод о свойствах ацетилена, отметив характерные признаки.
Назовите лабораторные способы получения этилена и ацетилена. Сравните этилен и ацетилен по свойствам, по строению. Объясните сходство свойств этих веществ. Чем его можно объяснить? Почему этилен и ацетилен относят к ненасыщенным углеводородам?
Видео:Окисление этилового спирта марганцовкойСкачать

Лабораторная работа №8
Видео:Окислительно-восстановительные реакции. 1 часть. 9 класс.Скачать

Окисление спирта в альдегид, окисление альдегида.
Видео:8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Свойства уксусной кислоты.
Изучение свойств спиртов, альдегидов, кислот.
Пояснение к работе:
Спирты, альдегиды и кислоты относится к кислородосодержащим органическим соединениям. Эти классы веществ связаны генетической связью, то есть из спирта можно получить альдегид, а из альдегида – кислоту. Но каждый класс веществ обладает характерными свойствами.
В ходе выполнения работы вы должны знать: как окислить спирт, альдегид, какие вещества при этом получатся; какие свойства проявляют кислоты; уметь записывать уравнения происходящих реакций и называть вещества;
Задание: Осуществить опыты в соответствии с инструкцией. Составить отчет о проделанной работе.
Опыт №1 Окисление спирта в альдегид
Реактивы: спиртовка, тигельные щипцы, медная проволока, этиловый спирт С2 Н5ОН.
Выполнение опыта: Окисление оксидом меди (прокаленной медной спиралью) этилового спирта. Поместить в пробирку четыре капли этилового спирта и погрузить в неё прокаленную медную проволочку, покрытую налетом оксида меди. Черная поверхность спирали становиться золотистой, вследствие восстановления оксида меди и появляется запах альдегида. Опыт можно повторить несколько раз. Записать наблюдения.
Задание: Написать уравнение реакции, происходящей при накаливании меди (её окисление).
Написать уравнение реакции окисления этилового спирта оксидом меди с использованием структурных формул органических веществ. Назвать полученное вещество.
Опыт №2 Окисление альдегида
Реактивы: спиртовка, аммиачный раствор оксида серебра, растворы сульфата меди CuSO4 и гидроксида натрия, формалин.
2.1 Окисление водного раствора формальдегида аммиачным раствором оксида серебра (реакция «серебряного зеркала»)
Выполнение опыта: В чистую пробирку поместить шесть капель аммиачного раствора оксида серебра, прибавить две-три капли формалина. Взболтать и осторожно нагреть смесь. Вращая пробирку в пламени спиртовки (лучше нагревать пробирку, держа в стакане с кипящей водой). Отметить образование блестящего зеркального налета на стенках пробирки.
2.2. Окисление водного раствора формальдегида гидроксидом меди II.
Внести в пробирку четыре капли раствора гидроксида натрияи две капли раствора сульфата медиII. К выпавшему осадку гидроксида меди II прибавить три-четыре капли формалина взболтать и нагреть. Наблюдать образование желтого осадка гидроксида меди I, переходящего в красный оксид меди I. Записать наблюдения.
Задание: Написать уравнения реакций взаимодействия муравьиного альдегида с оксидом серебра и гидроксидом меди II.
Опыт №3 Свойства уксусной кислоты
Реактивы: раствор уксусной кислоты, магний (или цинк), раствор лакмуса.
Выполнение опыта: Налить по пять — шесть капель раствора уксусной кислоты в две пробирки, в одну добавить три — четыре капли раствора лакмуса, в другую бросить немного магния (или цинка). Записать наблюдения.
Задание: Написать уравнение реакции уксусной кислоты с магнием, назвать продукт реакции.
Написать уравнение диссоциации уксусной кислоты на ионы. К каким электролитам по силе относится уксусная кислота?
Опыт №4 Получение уксуноэтилового эфира (этилацетата)
Реактивы: спиртовка, уксусная кислота, этиловый спирт, серная кислот, насыщенный раствор поваренной соли.
Выполнение опыта: внести в пробирку четыре-пять капель концентрированной уксусной кислоты и такое же количество этилового спирта. После этого добавить (осторожно!) в пробирку три капли серной кислоты и подогреть. Появляется запах эфира. Вылить смесь в неширокий стакан с насыщенным раствором поваренной соли. Отметить появление капель эфира на поверхности воды.
Задание: Написать уравнение реакции взаимодействия уксусной кислоты с этиловым спиртом, используя структурные формулы органических веществ. Указать роль серной кислоты в реакции этерификации.
Структурные формулы, названия, общие формулы спиртов, альдегидов, кислот, эфиров. Генетическая схема взаимосвязи спиртов, альдегидов, кислот, сложных эфиров.
Видео:Окисление спирта хромовой смесьюСкачать

Лабораторная работа №9
Свойства глюкозы, сахарозы, крахмала.
Цель работы: Изучение свойств углеводов.
Пояснение к работе: Глюкоза, сахароза и крахмал относят к углеводам (сахарам). Причем глюкоза – моносахарид, сахароза – дисахарид, а крахмал полисахарид. Ди — и полисахара состоят из остатков моносахаров, они также подвергаются гидролизу до молекул моносахаров.
В ходе работы вы должны: научиться различать моно-, ди — и полисахара по характерным реакциям; проводить реакции гидролиза; знать молекулярные, структурные формулы и записывать уравнения реакций происходящих процессов.
Задание: Осуществить опыты в соответствии с инструкцией. Составить отчет о проделанной работе.
Опыт №1 Свойства глюкозы
Реактивы: спиртовка, аммиачный раствор оксида серебра, 10 % — й раствор глюкозы, раствор гидроксида натрия, сульфата меди II.
Взаимодействие глюкозы с гидроксидом меди II.
Выполнение опыта: Поместить в пробирку шесть — восемь капель раствора глюкозы, пять – восемь капель раствора щелочи и две капли раствора сульфата меди II. Встряхнуть содержимое пробирки до растворения образовавшегося осадка и получения синего раствора. Нагреть жидкость в пробирке до кипения. Наблюдать переход синей окраски в зеленую, а затем появление желтого, кирпично-красного осадка.
1.2 Окисление глюкозы оксидом серебра
Выполнение опыта :Внести в пробирку пять-шесть капель аммиачного раствора оксида серебра и две – три капли раствора глюкозы. Взболтать и слегка подогреть содержимое пробирки до начала почернения смеси. На стенках пробирки выделяется серебро в виде блестящего налета.
1.Написать структурную формулу глюкозы.
2. Напишите уравнения соответствующих реакций.
Опыт №2 Гидролиз сахарозы
Реактивы: раствор сахарозы, гидроксид натрия, сульфат меди, раствор серной кислоты, спиртовка, спички пробиркодержатель.
Выполнение опыта: Получите в пробирке гидроксид меди II и прибавьте к нему раствор сахарозы, нагрейте. Происходят ли изменения?
Налейте в чистую пробирку два — три миллилитра раствора сахарозы, добавьте туда две — три капли серной кислоты и прокипятите смесь в течение 3 минут. Смесь нейтрализуйте щелочью.
Снова получите гидроксид меди II, добавьте к нему часть прокипяченной смеси и нагрейте. Отметьте изменения и дайте им объяснение.
Что происходит с сахарозой при кипячении в присутствии серной кислоты? Напишите уравнение происходящей реакции. О чем свидетельствует появление осадка с гидроксидом меди II после кипячения?
Опыт №3 Взаимодействие крахмала с йодом
Реактивы: вода, крахмальный клейстер, иодид калия, раствор йода.
Выполнение опыта: Налейте в две пробирки по два мл. крахмального клейстера. В одну пробирку добавьте немного раствора йода, в другую – раствор иодида калия.
Задание: Почему синее окрашивание появилось только в первой пробирке?
Опыт № 4 Гидролиз крахмала
Реактивы: клейстер, вода, раствор серной кислоты, гидроксид натрия, гидроксид меди II или сульфат меди II.
Выполнение опыта: В пробирку налейте два мл. крахмального клейстера, добавьте шесть мл. воды и осторожно прилейте один мл. раствора серной кислоты. Кипятите смесь в течение пяти минут, затем нейтрализуйте её раствором гидроксида натрия и добавьте немного гидроксида меди II или сульфата меди II. Содержимое нагреть.
Что происходит с крахмалом при его нагревании в присутствии серной кислоты? О чем свидетельствует появление осадка желтого и красного цвета? Напишите уравнения соответствующих реакций.
1. Линейная и циклическая форма глюкозы.
Качественные реакции на функциональные группы глюкозы. Качественные реакции на сахарозу и крахмал. Доказательство состава ди — и полисахаров из остатков молекул моносахаров.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Прокаливание медной проволоки и взаимодействие с серной кислотой. Химия. 8 класс. Габриелян. ГДЗ. Хим. практикум № 1. Практ. работа № 4. Опыт 1.
Проведите следующий опыт. Прокаливание медной проволоки и взаимодействие оксида меди (II) с серной кислотой.
Зажгите спиртовку (газовую горелку). Возьмите тигельными щипцами медную проволоку и внесите её в пламя. Через некоторое время выньте проволоку из пламени и счистите с неё образовавшийся чёрный налёт на лист бумаги. Опыт повторите несколько раз. Поместите полученный чёрный налёт в пробирку и прилейте в неё раствор серной кислоты. Подогрейте смесь. Что наблюдаете?
Образовалось ли новое вещество при накаливании меди? Запишите уравнение химической реакции и определите её тип по признаку числа и состава исходных веществ и продуктов реакции. Какие признаки химической реакции вы наблюдали? Образовалось ли новое вещество при взаимодействии оксида меди (II) с серной кислотой? Определите тип реакции по признаку числа и состава исходных веществ и продуктов реакции и запишите её уравнение.
Видео:Окислительно-восстановительные реакции с участием органических веществ. Лекция 1Скачать

Оксид меди 2, химическая формула и свойства
Оксиды — широко распространённый в природе тип соединений, который можно наблюдать даже в повседневной жизни, в быту. Примером могут служить песок, вода, ржавчина, известь, углекислый газ, ряд природных красителей. Руда многих ценных металлов по своей природе является оксидом, вследствие чего представляет большой интерес для научных и производственных исследований.
Соединение химических элементов с кислородом называют оксидами. Как правило, образуются они при накаливании каких-либо веществ на воздухе. Различают кислотные и основные оксиды. Металлы образуют основные оксиды, в то время как неметаллы — кислотные. За исключением оксидов хрома и марганца, которые также являются кислотными. В данной статье рассматривается представитель основных оксидов — CuO (II).
Видео:Окислительно-восстановительные реакции с участием органических веществ. Лекция 2Скачать

CuO (II)
Медь, нагреваясь на воздухе при температуре 400–500 °C, постепенно покрывается налётом чёрного цвета, который химики называют оксид двухвалентной меди, или CuO(II). Описанное явление представлено в следующем уравнении:
2 Cu + О 2 → 2 CuO
Термин «двухвалентный» указывает на способность атома вступать в реакцию взаимодействия с другими элементами посредством двух химических связей.
Интересный факт! Медь, находясь в различных соединениях, может быть с разной валентностью и другим цветом. Например: оксиды меди имеют ярко-красную (Cu2O) и коричнево-чёрную (CuO) окраску. А гидроксиды меди приобретают жёлтый (CuOH) и синий (Cu(OH)2) цвета. Классический пример явления, когда количество переходит в качество.
Cu2O ещё иногда называют закись, оксид меди (I), а CuO — окись, оксид меди (II). Существует также оксид меди (III) — Cu2O3.
В геологии оксид двухвалентной (или бивалентной) меди принято называть тенорит, другое его название — мелаконит. Название тенорит произошло от фамилии выдающегося итальянского профессора ботаники Michele Tenore, (1780—1861). Мелаконит считается синонимом названия тенорит и переводится на русский язык, как медная чернь либо чёрная медная руда. В том или ином случае речь идёт о кристаллическом минерале коричнево-чёрного цвета, разлагающемся при прокаливании и плавящемся только при избыточном давлении кислорода, в воде нерастворимом, и не реагирующем с ней.
Акцентируем основные параметры названного минерала.
Видео:Окисление этанола (тест на алкоголь)Скачать

Химическая формула: CuO
Молекула его состоит из атома Cu с молекулярной массой 64 а. е. м. и атома O, молекулярная масса 16 а. е. м., где а. е. м. — атомная единица массы, она же дальтон, 1 а. е. м. = 1,660 540 2(10) × 10 −27 кг = 1,660 540 2(10) × 10 –24 г. Соответственно молекулярная масса соединения равняется: 64 + 16 = 80 а. е. м.
Кристаллическая решётка: моноклинная сингония. Что обозначает такой тип осей симметрии кристалла, когда две оси пересекаются под косым углом и имеют различную длину, а третья ось расположена по отношению к ним под углом 90°.
Плотность – 6,51 г/см 3 . Для сопоставления, плотность чистого золота равна 19,32 г/см³, а плотность поваренной соли составляет 2,16 г /см 3 .
Плавится при температуре 1447 °C, под давлением кислорода.
Разлагается при накаливании до 1100 °C и преобразуется в оксид меди (I):
4CuO = 2Cu2O + O 2.
С водой не реагирует и не растворяется в ней.
Зато вступает в реакцию с водным раствором аммиака, с образованием гидроксида тетраамминмеди (II): CuO + 4NH3 + H2O = [Cu (NH3)4](OH) 2.
В кислотной среде образует сульфат и воду: CuO + H2SO4 = CuSO4 + H2O.
Реагируя со щёлочью, создаёт купрат: CuO + 2 NaOH → Na2CuO2 + H2O.
Видео:Метод электронного баланса. Окислительно-восстановительные реакции. 1 часть. 11 класс.Скачать
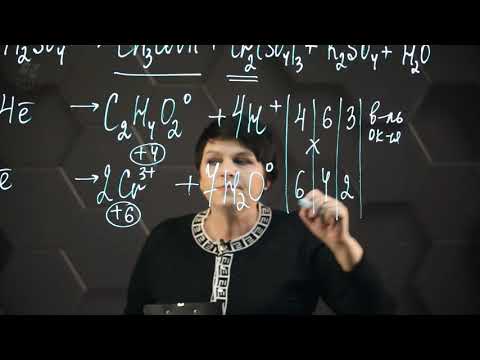
Реакция CuO NaOH
Образуется:
- путём прокаливания гидроксида меди (II) при температуре 200 °C: Cu(OH)2 = CuO + H2O;
- при окислении металлической меди на воздухе при температуре 400–500 °C: 2Cu + O2 = 2CuO;
- при высокотемпературной обработке малахита: (CuOH)₂CO₃ —> 2CuO + CO₂ + H₂O.
Восстанавливается до металлической меди —
- в реакции с водородом: CuO + H2 = Cu + H2O;
- с угарным газом (монооксид углерода): CuO + CO = Cu + CO2;
- с активным металлом: CuO + Mg = Cu + MgO.
Токсичен. По степени неблагоприятного воздействия на человеческий организм причисляется к веществам второго класса опасности. Вызывает раздражение слизистых оболочек глаз, кожных покровов, дыхательных путей и желудочно-кишечной системы. При взаимодействии с ним обязательно использование таких средств защиты, как резиновые перчатки, респираторы, защитные очки, спецодежду.
Вещество взрывоопасно и легко воспламеняется.
Применяется в промышленности, как минеральная составляющая комбикормов, в пиротехнике, при получении катализаторов химических реакций, как красящий пигмент для стекла, эмалей, керамики.
Окислительные свойства оксида меди (II) наиболее часто применяются в лабораторных исследованиях, когда необходим элементарный анализ, связанный с изучением органических материалов на предмет наличия в них водорода и углерода.
Немаловажно, что CuO (II) достаточно широко распространён в природе, как минерал тенерит, другими словами — это природное соединение руды, из которого можно получить медь.
Латинское наименование Cuprum и соответствующий ему символ Cu происходит от названия острова Кипр. Именно оттуда, через Средиземное море вывозили этот ценный металл древние римляне и греки.
Медь входит в число семи наиболее распространённых в мире металлов и состоит на службе у человека с древних времён. Однако в первозданном, металлическом состоянии встречается довольно редко. Это мягкий, легко поддающийся обработке металл, отличающийся высокой плотностью, очень качественный проводник тока и тепла. По электрической проводимости уступает только серебру, в то время как является более дешёвым материалом. Широко используется в виде проволоки и тонкого листового проката.
Химические соединения меди отличаются повышенной биологической активностью. В животных и растительных организмах они участвуют в процессах синтеза хлорофилла, поэтому считаются очень ценным компонентом в составе минеральных удобрений.
Необходима медь и в рационе человека. Недостаток её в организме может привести к различным заболеваниям крови.
Видео:окисление спирта хромовым ангидридомСкачать

Опыт №3. Окисление этилового спирта оксидом меди (II)
Налить в пробирку 1-2 мл этилового спирта и погрузить в него раскаленную
медную проволоку. Опыт повторяем несколько раз.
Запишите наблюдения: ________________________________________________________________________________________________________________________________________________________________________________________________________________________Составьте уравнение реакции ________________________________________________________________________
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________________________________Опыт №4.Растворение глицерина в воде.
Налейте в пробирку 1-2 мл глицерина и прилейте столько же воды, пробирку встряхните.
Вывод: ________________________________________________________________________________________________________________________________________________________________________________________________________________________Опыт №5.Взаимодействие глицерина с гидроксидом меди (II).
В пробирку налейте 1 мл 10%-ного раствора сульфата меди (II) и добавьте избыток 10%-ного раствора гидроксида натрия до образования голубого осадка гидроксида меди (II). К полученному осадку прилейте по каплям глицерин. Смесь взболтайте.
Запишите наблюдения: ________________________________________________________________________________________________________________________________________________Вывод:________________________________________________________________________________________________________________________________________________
1. Какие органические вещества называются спиртами?
2. Какие спирты называются одноатомными?
3. Какие спирты называются многоатомными?
4. В чем состоит сходство одноатомных и многоатомных спиртов?
5. В чем причина хорошей растворимости спиртов?
6. При помощи какой реакции, можно отличить одноатомные спирты от многоатомных?
Литература
Ю.М. Ерохин «Химия» Москва 2003г глава 24 стр. 307
Лабораторная работа №8 «Получение и свойства карбоновых кислот»
Цель: изучение свойств карбоновых кислот на примере уксусной кислоты.
Теория
Карбоновымикислотами называются органические вещества, молекулы которых содержат одну или несколько карбоксильных групп -СООН, соединенных с углеводородным радикалом: RСООН.
Среди кислот нет газообразных веществ, низшие представители ряда — это жидкости с острым запахом, хорошо растворимые в воде. С повышением молекулярной массы растворимость их в воде понижается.
Все карбоновые кислоты обладают кислотными свойствами и при диссоциации образуют ионы водорода.
Кислотные свойства карбоновых кислот выражены сильнее, чем у спиртов, но по сравнению с сильными неорганическими кислотами — это слабые кислоты (кроме муравьиной кислоты).
🌟 Видео
ЭТОТ метод поможет на уроках ХИМИИ / Химия 9 классСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Окислительно-восстановительные реакции. 3 часть. 9 класс.Скачать

Взаимодействие спиртов с металлическим натриемСкачать

10 класс § 44 "Химические свойства спиртов"Скачать

ДЕМО ЕГЭ 2020 химия (задания 11-18)Скачать

Окислительно-восстановительные реакции (ОВР). Что надо знать и как их решатьСкачать






