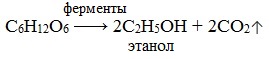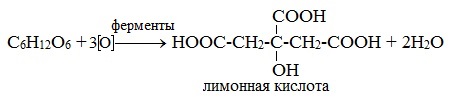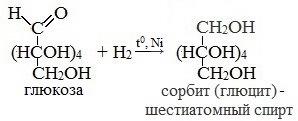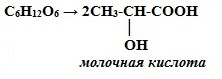Химические свойства глюкозы, как и других альдоз, обусловлены присутствием в ее молекуле: а)альдегидной группы; б) спиртовых гидроксилов; в) полуацетального (гликозидного) гидроксила.
- Специфические свойства
- Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
- Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
- Реакции с участием полуацетального гидроксила
- Реакции окисления
- Опыт 2. Реакции на карбонильные группы в моносахаридах
- Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, спиртовое брожение.
- 📽️ Видео
Специфические свойства
1. Брожение (ферментация) моносахаридов
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
1) Спиртовое брожение
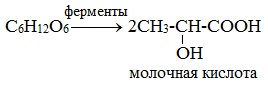
2) Молочнокислое брожение
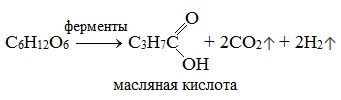
3) Маслянокислое брожение
4) Лимоннокислое брожение
Реакции с участием альдегидной группы глюкозы (свойства глюкозы как альдегида)
1. Восстановление (гидрирование) с образованием многоатомного спирта
В ходе этой реакции карбонильная группа восстанавливается и образуется новая спиртовая группа:
Cорбит содержится во многих ягодах и фруктах, особенно много сорбита в плодах рябины.
2. Окисление
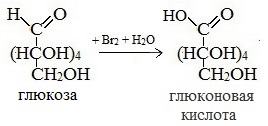
1) Окисление бромной водой
Качественные реакции на глюкозу как альдегид!
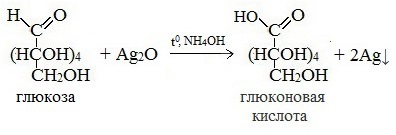
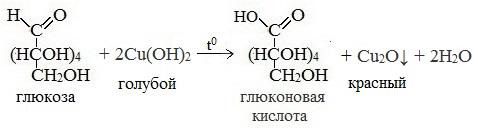
Протекающие в щелочной среде при нагревании реакции с аммиачным раствором Ag2O (реакция серебряного зеркала») и с гидроксидом меди (II) Cu (OH)2 приводят к образованию смеси продуктов окисления глюкозы.
2) Реакция серебряного зеркала
Соль этой кислоты – глюконат кальция – известное лекарственное средство.
Видеоопыт «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
3) Окисление гидроксидом меди (II)
В ходе этих реакций альдегидная группа – СНО окисляется до карбоксильной группы – СООН.
Реакции глюкозы с участием гидроксильных групп (свойства глюкозы как многоатомного спирта)
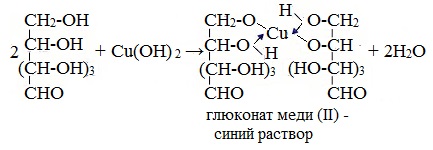
1. Взаимодействие с Cu (ОН)2 с образованием глюконата меди (II)
Качественная реакция на глюкозу как многоатомный спирт!
Подобно этиленгликолю и глицерину, глюкоза способна растворять гидроксид меди (II), образуя растворимое комплексное соединение синего цвета:
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет.
В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение.
Видеоопыт «Качественная реакция глюкозы с гидроксидом меди (II)»
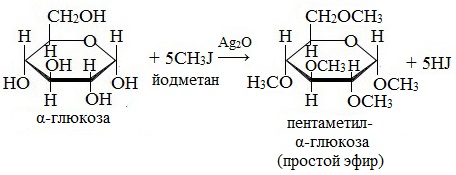
2. Взаимодействие с галогеналканами с образованием простых эфиров
Являясь многоатомным спиртом, глюкоза образует простые эфиры:
Реакция происходит в присутствии Ag2O для связывания выделяющегося при реакции НI.
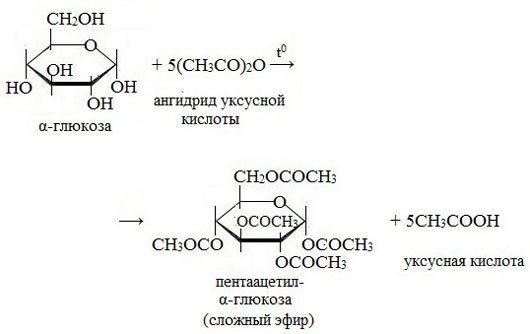
3. Взаимодействие с карбоновыми кислотами или их ангидридами с образованием сложных эфиров.
Например, с ангидридом уксусной кислоты:
Реакции с участием полуацетального гидроксила
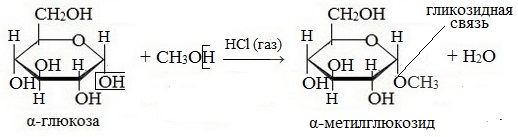
1. Взаимодействие со спиртами с образованием гликозидов
Гликозиды – это производные углеводов, у которых гликозидный гидроксил замещен на остаток какого-либо органического соединения.
Содержащийся в циклических формах глюкозы полуацетальный (гликозидный) гидроксил является очень реакционноспособным и легко замещается на остатки различных органических соединений.
В случае глюкозы гликозиды называются глюкозидами. Связь между углеводным остатком и остатком другого компонента называется гликозидной.
Гликозиды построены по типу простых эфиров.
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу:
В данных условиях в реакцию вступает только гликозидный гидроксил, спиртовые гидроксильные группы в реакции не участвуют.
Гликозиды играют чрезвычайно важную роль в растительном и животном мире. Существует огромное число природных гликозидов, в молекулах которых с атомом С (1) глюкозы остатки самых различных соединений.
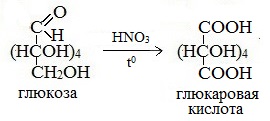
Реакции окисления
Более сильный окислитель – азотная кислота НNO3 – окисляет глюкозу до двухосновной глюкаровой (сахарной) кислоты:
В ходе этой реакции и альдегидная группа – СНО и первичная спиртовая группа — СН2ОН окисляются до карбоксильных – СООН.
Видеоопыт «Окисление глюкозы кислородом воздуха в присутствии метеленового голубого»
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Опыт 2. Реакции на карбонильные группы в моносахаридах
Реактивы: 1-процентный раствор глюкозы, 1-процентный раствор фруктозы, 2-процентный раствор глюкозы, 2-процентный раствор фруктозы, 10-процентный раствор глюкозы, 10-процентный раствор формальдегида, фуксинсернистая кислота, 5-процентный раствор сульфата меди, 10-процентный раствор гидроксида натрия, реактив Фелинга, бромная вода (насыщенная), 1-процентный раствор хлорида железа (III), 1-процентный раствор фенола, 1-процентный раствор нитрата серебра, 5-процентный раствор глюкозы, раствор уксуснокислого фенилгидразина.
Оборудование: водяные бани, термометры (100 0 С), микроскоп, пипетки, предметные и покровные стекла.
а) Реакции фуксинсернистой кислоты с формальдегидом и глюкозой. В две пробирки наливают по 1,5 мл раствора фуксинсернистой кислоты. В одну пробирку приливают 1,5 мл 10-процентного раствора формальдегида, в другую – 1,5 мл 10-процентного раствора глюкозы. Содержимое пробирок перемешивают. Через некоторое время в пробирке с формальдегидом появляется фиолетово-розовое окрашивание. Раствор, содержащий глюкозу, остается бесцветным.
Почему глюкоза (и другие моносахариды) не дает некоторых реакций на карбонильные группы? Например, она не реагирует с фуксинсернистой кислотой и с гидросульфитом натрия.
б) Окисление моносахаридов гидроксидом меди (II) в щелочной среде. В пробирке смешивают 3 мл 1-процентного раствора глюкозы и 1,5 мл 10-процентного раствора гидроксида натрия. Затем по каплям при встряхивании добавляют 5-процентный раствор сульфата меди до появления не исчезающей при встряхивании мути. Избыток гидроксида меди (II) мешает реакции, так как при нагревании он теряет воду и превращается в оксид меди СuО черного цвета. Если же гидроксида меди (II) слишком мало, то не связанная им глюкоза при нагревании осмоляется, продукты осмоления темного цвета также маскируют реакцию. Содержимое пробирки нагревают до начинающегося кипения так, чтобы нагревалась лишь верхняя часть раствора, а нижняя оставалась для контроля. В нагретой части раствора появляется желтый осадок гидроксида меди (I), вскоре переходящий в красный осадок оксида меди (I). Опыт повторяют, но вместо раствора глюкозы берут 1-процентный раствор фруктозы.
В условиях опыта одинаково легко окисляются гидроксидом меди (II) и альдозы (глюкоза), и кетозы (фруктоза). Объясняется это тем, что при нагревании с окислителем в щелочной среде углеродные цепи молекул моносахаридов расщепляются, при этом образуется смесь веществ, в том числе легко окисляющихся (формальдегид, муравьиная кислота и др.). Среди продуктов окисления глюкозы обнаружена также глюконовая (одноосновная) кислота.
Напишите уравнение реакции окисления глюкозы в глюконовую кислоту гидроксидом меди (II).
в) Окисление моносахаридов реактивом Фелинга. Наливают в две пробирки по 1,5-2 мл растворов моносахаридов: в одну пробирку – 1-процентный раствор глюкозы, в другую – 1-процентный раствор фруктозы. Затем в каждую пробирку добавляют равный объем реактива Фелинга, содержимое пробирок перемешивают и нагревают верхнюю часть раствора до начинающегося кипения. В верхней части жидкости в обеих пробирках появляется желтый осадок гидроксида меди (I), переходящий в красный осадок оксида меди (I), нижняя часть жидкости, которую не нагревали, остается синей.
Реактивом Фелинга пользоваться удобнее, чем гидроксидом меди (II), так как при нагревании смеси его с раствором моносахарида не происходит образования черного осадка оксида меди (II), маскирующего красный цвет осадка оксида меди (I). Реакция с фелинговой жидкостью протекает быстрее и более четко. Этой реакцией широко пользуются для качественного и количественного анализа моносахаридов и для отличия восстанавливающих дисахаридов от не восстанавливающих.
Что такое реактив Фелинга? Какое строение имеет этот реактив и как его готовят? Напишите уравнение реакции окисления глюкозы в глюконовую кислоту реактивом Фелинга.
г) Окисление моносахаридов аммиачным раствором оксида серебра (реакция серебряного зеркала). Сначала готовят аммиачный раствор гидроксида серебра из 4-5 мл 1-процентного раствора нитрата серебра. Аммиачный раствор гидроксида серебра делят пополам. К одной части его приливают 1,5 мл 1-процентного раствора глюкозы, к другой – 1,5 мл 1-процентного раствора фруктозы. Обе пробирки нагревают 5-10 мин в водяной бане, нагретой до 70-80°С. Металлическое серебро, в обеих пробирках, выделяется на стенках в виде зеркального налета. Во время нагревания пробирки нельзя встряхивать, иначе металлическое серебро выделится не на стенках пробирок, а в виде темного осадка. Чтобы получить хорошее зеркало, в пробирках предварительно кипятят 10-процентный раствор гидроксида натрия, затем их споласкивают дистиллированной водой.
При окислении моносахаридов в щелочной среде, как уже было сказано выше, получается смесь продуктов, образующихся при глубоком расщеплении их молекул. Среди продуктов окисления глюкозы найдена и альдоновая (одноосновная) глюконовая кислота. Напишите уравнения реакций: образование аммиачного раствора оксида серебра и окисление D-глюкозы до глюконовой кислоты аммиачным раствором оксида серебра.
д) Окисление моносахаридов бромной водой (тяга!). В две пробирки наливают по 3 мл бромной воды и добавляют по 0,5 мл 2-процентных растворов моносахаридов: в одну – глюкозу, в другую – фруктозу. Пробирки нагревают в кипящей водяной бане в течение 15 мин. Если бурая окраска брома за это время не исчезнет, реакционные смеси кипятят до обесцвечивания на пламени горелки (примерно 1 мин). После охлаждения к растворам добавляют по нескольку капель 1-процентного раствора хлорида железа (III), окрашенного фенолом в фиолетовый цвет. Сравнивают окраску растворов в обеих пробирках.
Напишите уравнение реакции окисления глюкозы бромом в глюконовую кислоту. Какой моносахарид – глюкоза или фруктоза – легче окисляется в условиях опыта?
е) Реакция замещения карбонильного кислорода в моносахаридах (получение озазонов). Смешивают в пробирке 2,5 мл 5-процещного раствора глюкозы и 2,5 мл раствора уксуснокислого фенилгидразина. Пробирку с реакционной смесью помещают на 20-30 мин в кипящую водяную баню. Выпадает осадок глюкозазона, при встряхивании и охлаждении реакционной смеси количество осадка увеличивается. Каплю жидкости с осадком переносят пипеткой на предметное стекло, накрывают его покровным стеклом и рассматривают форму кристаллов глюкозазона под микроскопом. Кристаллы имеют форму иголок, соединенных в снопы (рис. 10). Уксуснокислый фенилгидразин легко гидролизуется, так что в реакцию с глюкозой вступает свободный фенилгидразин.
Напишите уравнения следующих реакций: гидролиз уксуснокислого фенилгидразина, взаимодействие глюкозы с избытком фенилгидразина (три стадии). Какие гексозы дают такой же фенилозазон, как и глюкоза?
Видео:Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

Химические свойства глюкозы: окисление в глюконовую кислоту, восстановление в сорбит, спиртовое брожение.
I. Специфические свойства
Важнейшим свойством моносахаридов является их ферментативное брожение, т.е. распад молекул на осколки под действием различных ферментов. Брожение происходит в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
2. Молочнокислое брожение:
3. Маслянокислое брожение:
II. Свойства альдегидов
1. Реакция серебряного зеркала:
Видео «Качественная реакция глюкозы с аммиачным раствором оксида серебра (I)»
СH2OH(CHOH)4-COOH — глюконовая кислота
2. Окисление гидроксидом меди (II):
сорбит – шестиатомный спирт
III. Свойства многоатомных спиртов
1. Образование простых эфиров со спиртами
При действии метилового спирта в присутствии газообразного хлористого водорода атом водорода гликозидного гидроксила замещается на метильную группу.
 α — глюкоза α — глюкоза | + СH3ОН | HCl (газ) → |  | + H2О |
2. Качественная реакция многоатомных спиртов
Прильём к раствору глюкозы несколько капель раствора сульфата меди (II) и раствор щелочи. Осадка гидроксида меди не образуется. Раствор окрашивается в ярко-синий цвет. В данном случае глюкоза растворяет гидроксид меди (II) и ведет себя как многоатомный спирт, образуя комплексное соединение – ярко синего цвета.
«Качественная реакция глюкозы с гидроксидом меди (II)»
(глюкозат меди (II) – синий раствор)
Применение глюкозы на основе свойств.
Глюкоза является ценным питательным продуктом. В организме она подвергается сложным биохимическим превращениям в результате которых образуется диоксид углерода и вода, при это выделяется энергия согласно итоговому уравнению:
Так как глюкоза легко усваивается организмом, её используют в медицине в качестве укрепляющего лечебного средства при явлениях сердечной слабости, шоке, она входит в состав кровозаменяющих и противошоковых жидкостей. Широко применяют глюкозу в кондитерском деле (изготовление мармелада, карамели, пряников и т. д.), в текстильной промышленности в качестве восстановителя, в качестве исходного продукта при производстве аскорбиновых и глюконовых кислот, для синтеза ряда производных сахаров и т.д. Большое значение имеют процессы брожения глюкозы. Так, например, при квашении капусты, огурцов, молока происходит молочнокислое брожение глюкозы, так же как и при силосовании кормов. Если подвергаемая силосованию масса недостаточно уплотнена, то под влиянием проникшего воздуха происходит маслянокислое брожение и корм становится непригоден к применению. На практике используется также спиртовое брожение глюкозы, например при производстве пива.
📽️ Видео
Биохимия 8. Дихотомическое окисление глюкозы. ГлюконеогенезСкачать

ГлюкозаСкачать

Химия 10 класс (Урок№10 - Углеводы. Глюкоза. Олигосахариды. Сахароза.)Скачать

Реакция глюкозы с аммиачным раствором оксида серебраСкачать

Качественная реакция на глюкозу. Реакция глюкозы с гидроксидом меди (ll)Скачать

Реакция серебряного зеркала с глюкозой | Качественная реакция глюкозы на альдегидную группу |Скачать

Моносахариды. Глюкоза. 11 класс.Скачать

Свойства глюкозы. 11 класс.Скачать
Опыты по химии. Обнаружение глюкозы в виноградном соке и медеСкачать

Качественные реакции на глицерин, глюкозу и сахарозуСкачать

97. Глюкоза (структурные формулы)Скачать

Глюкоза строение, свойства, применение | Химия 10 класс #38 | ИнфоурокСкачать

Как определить продукты в окислительно-восстановительных реакциях. Ч.1. Введение.Скачать

Углеводы. Тема 33. Химические свойства глюкозыСкачать

10 класс Химические свойства, получение и применение глюкозыСкачать

Реакции кислот-окислителей со сложными веществами: как понять? | Химия ЕГЭ 2022 | УмскулСкачать

Биохимия: Глюконеогенез из жирных кислотСкачать

ЛЕКЦИЯ 5. МОНОСАХАРИДЫСкачать