- Золь гидроксида железа
- Формула и строение мицеллы карбоната кальция
- Строение мицеллы фосфата меди
- Напишите уравнение реакции образования гидрозоля С из веществ А и В
- Условие
- Решение
- Зарегистрируйся, чтобы продолжить изучение работы
- Решение задач «Напишите уравнение реакции образования гидрозоля С из веществ А и В.», Химия
- 🎬 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Золь гидроксида железа
Задача 136.
Почему золь гидроксида железа, полученный при гидролизе FeCl3, имеет вид прозрачного плотного чая, а этот же золь, полученный пептизацией, значительно светлее и немного каламутный?
Решение:
1. Получение золя гидроксида железа (III) при гидролизе
Золь гидроксида трехвалентного железа получают гидролизом хлорида железа(III). Гидролиз соли FeCl3 происходит по стадиям, причем скорость и степень гидролиза возрастают при повышении температуры и увеличении разведения:
Так как на каждой ступени гидролиза выделяется HCl, то равновесие на последней стадии сдвинуто влево, т.е. гидролиз не протекает до конца и в системе присутствуют как Fe(OH)3, так и Fe(OH)2Cl. Дигидрохлорид железа (III) при нагревании подвергается дегидратации:
Образующаяся соль FeOCl играет роль стабилизатора.
Уравнение реакции в общем виде:
Так как на каждой ступени гидролиза выделяется HCl, то равновесие на последней стадии сдвинуто влево, т.е. гидролиз не протекает до конца и в
системе присутствуют как Fe(OH)3, так и Fe(OH)2Cl. Дигидрохлорид железа(III) при нагревании подвергается дегидратации:
Образующаяся соль FeOCl играет роль стабилизатора.
Элементарная частица золя называется мицеллой.
В результате гидролиза FeCl3 образуется красно-коричневый золь гидроксида железа(III). Строение мицеллы полученного золя можно изобразить следующим образом:
<m[Fe(OH)3]·nFeO + · (n-x)Cl – > x+ · xCl – , где
m[Fe(OH)3] — агрегат; [Fe(OH)3]m · nFeO + — ядро; <m[Fe(OH)3]·nFeO + · (n-x)Cl – > x+ – коллоидная частица (гранула); nFeO + · (n-x)Cl – — адсорбционный слой;
xCl – — диффузный слой; FeO + — противоион; (n-x)Cl – противоионы адсорбционного слоя; xCl – — противоионы диффузного слоя.
2. Получение гидрозоля гидроксида железа (III) методом пептизации
Сначала приготовливается осадок гидроксида железа (III) по реакции FeCl3 и концентрированного раствора NH4OH. При этом образуется осадок гидроксида железа по уравнению:
Полученный осадок Fe(OH)3 отмывают от хлорида аммония и избытка аммиака дистиллированной водой. К промытому осадку приливают примерно 100 мл дистиллированной воды.
Далее к взмученному в дистиллированной воде осадку Fe(OH)3, в качестве пептизатора, вливают 2%-ный раствор FeCl3. Содержимое тщательно перемешивают и нагревают. При этом осадок Fe(OH)3 переходит в раствор, образуя высокодисперсный золь гидроксида железа.
Пептизатором осадка служит оксихлорид железа, образующийся в результате реакции:
Молекулы FeOCl в растворе диссоциируют на ионы FeO + и Cl – . Ионы FeO + , адсорбируясь на частицах Fe(OH3), сообщают им положительный заряд. Получается вишнево-красный золь Fe(OH)3. Нужно иметь, что гидролиз насыщенного раствора FeCl3 практически не идет.
Схема строения мицеллы образующегося гидрозоля гидроксида железа такая же, как и при гидролизе соли FeCl3:
<m[Fe(OH)3]·nFeO + · (n-x)Cl – > x+ · xCl –
Таким образом, золь гидроксида железа, полученный при гидролизе FeCl3, имеет вид прозрачного плотного чая (красно-коричневый), а тот же золь, но олученный пептизацией, значительно светлее (вишнево-красный) и немного каламутный. Это объясняется тем, что гидролизный золь, за счет присутствия в растворе примесей от гидролиза соли FeCl3 имеет более окрашенный коллоидный раствор, а тот же золь, но полученный методом пептизации, коллоидный раствор содержит меньше примесей за счет отсутствия гидролиза соли FeCl3.
1. химизм получения золя методом гидролиза:
Уравнение реакции в общем виде:
2. Метод пептизации:
Схема строения мицеллы образующегося гидрозоля гидроксида железа такая же, как и при гидролизе соли FeCl3 и при пептизации:
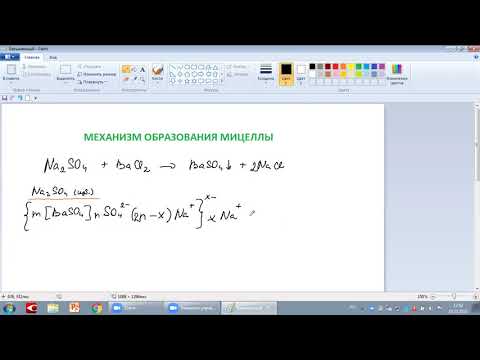
Формула и строение мицеллы карбоната кальция
Задача 137.
Какова формула и схема строения мицеллы, полученной при действии избытка Na2CO3 на CaCl2?
Решение:
Составление формулы мицеллы, полученной при взаимодействии хлорида кальция с избытком карбоната натрия:
mCaCO3 -зародыш(агрегат) — нерастворимое вещество, образовавееся в ходе реакции, где
m-коэффициент, указывающий число частиц вещества.
CaCl2-противоион(ПИ)
Диссоциация вещества, взятого в избытке:
n CO3 2– — потенциалопределяющие ионы, адсорбирующие на зародыше. Они составляют агрегат мицеллы [mCaCO3]·n CO3 2– .
Часть противоионов адсорбируется непосредственно на ядре и оставляет адсорбиционный слой противоионов, его обозначают в данном случае 2(n-x)Na +.
Ядро с с адсорбиционным слоем противоионов составляет гранулу мицеллы —
Гранула имеет заряд, знак которого определяется знаком заряда потенциалопределяющих ионов, в данном случае «2х-» —
[mCaCO3] · n CO3 2– · 2(n-x)Na+> 2х– .
Заряд гранулы нейтрализуется противоионами диффузного слоя, число которых составляет 2хNa + .
Схема строения мицеллы золя CacO3, полученного в избытке Na2CO3
Катионы Са 2+ будут связаны в агломерат (зародыш) и никак не могут быть противоионами для гранулы.
А вот катионов натрия Na + в растворе «море».
Поэтому мицелла будет иметь вид:
[mCaCO3]·n CO3 2– · 2(n-x)Na + > 2х– · xNa + .
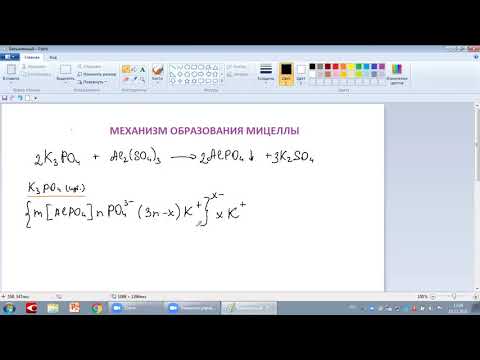
Строение мицеллы фосфата меди
Задача 138.
Составить из ядра формулу, а потом из формулы мицеллу. Ядро — Cu3(PО4)2.
Решение:
Получение гидрозоля Cu3(PО4)2 возможно при реакции:
Такое ядро могут иметь 3 разных мицеллы.
Рассмотрим случай, если в избытке Na3PO4, значит, в качестве потенциалопределяющих ионов, т.е. ионов, входящих в его состав и находящиеся в растворе в избытке, выступают PO4 3– .
Далее, к ядру притягиваются противоположно заряженные ионы – противоионы, которые компенсируют заряд твердой фазы и образуют адсорбционный слой. Противоионами будут служить, ионы, содержащиеся в растворе, но не входящие в состав агрегата – Na + .
Формула мицеллы золя будет выглядеть следующим образом:
Из чего следует:
m[Cu3(PO4)2] — ядро мицеллы;
m[Cu3(PO4)2]·nPO4 3– — агрегат (плюс потенциалопределяющие ионы);
<m[Cu3(PO4)2]·nPO4 3– · 3(n-x)Na + ] 3x– — гранула.
3(n-x)Na + — адбсорбционный слой ионов;
3xNa + — диффузионный слой ионов.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Напишите уравнение реакции образования гидрозоля С из веществ А и В
- Реферат.Справочник
- Решенные задачи по химии
- Напишите уравнение реакции образования гидрозоля С из веществ А и В
Условие
Согласно своему варианту: 1. Напишите уравнение реакции образования гидрозоля С из веществ А и В. 2. Напишите формулу мицеллы образовавшегося гидрозоля С при условии, что вещество А взято в избытке. Укажите знак заряда коллоидной частицы. 3. Укажите электролит-коагулятор, обладающий меньшим порогом коагуляции. 16 CdCl2 H2S CdS (NH4)2SO4, Ca(NO3)2, Al(NO3)3
Решение
1. Рассмотрим образование мицеллы золя сульфида кадмия при избытке хлорида кадмия:
CdCl2 (изб) + H2S = CdS + 2 HCl
Так как хлорид кадмия взят в избытке, следовательно, раствор CdCl2 будет являться электролитом-стабилизатором, ионы которого образуют ДЭС:
CdCl2 → Cd2+ + 2Cl-
По правилу Фаянса-Панета-Пескова ионы Cd2+ будут являться потенциалопределяющими ионами, тогда ионы 2Cl-– противоионами.
2 . Тогда формула мицеллы золя запишется следующим образом:
m[Cd] · n Cd2+ · 2(n-x)Cl- 2x+ 2x Cl-
3
Зарегистрируйся, чтобы продолжить изучение работы
. Тогда формула мицеллы золя запишется следующим образом:
m[Cd] · n Cd2+ · 2(n-x)Cl- 2x+ 2x Cl-
3
Оплатите решение задач или закажите уникальную работу на похожую тему
Видео:СТРОЕНИЕ МИЦЕЛЛЫ - урок 1Скачать

Решение задач «Напишите уравнение реакции образования гидрозоля С из веществ А и В.»,
Химия
Напишите уравнение реакции образования гидрозоля С из веществ А и В.
ID (номер) заказа
Напишите уравнение реакции образования гидрозоля Ag2S из веществ (NH4)2S и AgNO3. Напишите формулу мицеллы образовавшегося гидрозоля Ag2S при условии, что вещество (NH4)2S взято в избытке. Укажите знак заряда коллоидной частицы.
Закажите подобную или любую другую работу недорого



Вы работаете с экспертами напрямую,
не переплачивая посредникам, поэтому
наши цены в 2-3 раза ниже

Последние размещенные задания
Тема: совершенствование маркетинговой деятельности промышленного.
Срок сдачи к 20 мая
Онлайн-помощь, Турбины и аэс
Срок сдачи к 22 апр.
Разработка компьютерной сети на предприятии Алроса
Курсовая, Организация сетей
Срок сдачи к 25 апр.
Решить 20 заданий по аглебре
Решение задач, Алгебра
Срок сдачи к 28 апр.
Нужно произвести расчёты по формулам
Курсовая, производственно -техническая инфраструктура предприятий автосервиса
Срок сдачи к 28 апр.
Решение задач, Геодезия
Срок сдачи к 25 апр.
Все готово нужно только оформить
Диплом, Горное Дело
Срок сдачи к 24 апр.
Задачи по Административному судопроизводству.
Решение задач, Юриспруденция
Срок сдачи к 23 апр.
Анализ степени обновления, выбытия ,прироста и изношенности основных фондов
Решение задач, анализ финансово-хозяйственной деятельности
Срок сдачи к 25 апр.
Срок сдачи к 25 апр.
чертежи вариант 11
Чертеж, Компьтерная графика
Срок сдачи к 25 апр.
Только задачи 8го 11 и 15 вариант в практических и.
Срок сдачи к 25 апр.
Срок сдачи к 25 апр.
Сделать любой номер
Решение задач, техническая механика
Срок сдачи к 22 апр.
Анализ произведения е. гришковец «рубашка» тема «сон»
Контрольная, Отечественная литература
Срок сдачи к 24 апр.
Помогите решить задачу по метрологии надо желательно часа за.
Решение задач, Метрология, стандартизация и сертификация
Срок сдачи к 22 апр.
Анализ движения Основных Фондов
Решение задач, анализ финансово-хозяйственной деятельности
Срок сдачи к 25 апр.
Динамика и устойчивость
Срок сдачи к 27 апр.
































обратились к нам
за последний год
работают с нашим сервисом
заданий и консультаций
заданий и консультаций
выполнено и сдано
за прошедший год

Сайт бесплатно разошлёт задание экспертам.
А эксперты предложат цены. Это удобнее, чем
искать кого-то в Интернете
Отклик экспертов с первых минут
С нами работают более 15 000 проверенных экспертов с высшим образованием. Вы можете выбрать исполнителя уже через 15 минут после публикации заказа. Срок исполнения — от 1 часа
Цены ниже в 2-3 раза
Вы работаете с экспертами напрямую, поэтому цены
ниже, чем в агентствах
Доработки и консультации
– бесплатны
Доработки и консультации в рамках задания бесплатны
и выполняются в максимально короткие сроки
Гарантия возврата денег
Если эксперт не справится — мы вернем 100% стоимости
На связи 7 дней в неделю
Вы всегда можете к нам обратиться — и в выходные,
и в праздники
Эксперт получил деньги за заказ, а работу не выполнил?
Только не у нас!
Деньги хранятся на вашем балансе во время работы
над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем
возврат полной уплаченой суммы








С вами будут работать лучшие эксперты.
Они знают и понимают, как важно доводить
работу до конца

С нами с 2018 года
index_pa ge.blocks.executors.help 9 495 Сдано работ: 9 495
Рейтинг: 101 745
Среднее 4,86 из 5

С нами с 2017 года
index_pa ge.blocks.executors.help 12 601 Сдано работ: 12 601
Рейтинг: 101 380
Среднее 4,94 из 5

С нами с 2019 года
Помог студентам: 2 945 Сдано работ: 2 945
Рейтинг: 34 782
Среднее 4,84 из 5

С нами с 2018 года
Помог студентам: 2 480 Сдано работ: 2 480
Рейтинг: 17 511
Среднее 4,87 из 5


1. Сколько стоит помощь?
Цена, как известно, зависит от объёма, сложности и срочности. Особенностью «Всё сдал!» является то, что все заказчики работают со экспертами напрямую (без посредников). Поэтому цены в 2-3 раза ниже.

Специалистам под силу выполнить как срочный заказ, так и сложный, требующий существенных временных затрат. Для каждой работы определяются оптимальные сроки. Например, помощь с курсовой работой – 5-7 дней. Сообщите нам ваши сроки, и мы выполним работу не позднее указанной даты. P.S.: наши эксперты всегда стараются выполнить работу раньше срока.

3. Выполняете ли вы срочные заказы?
Да, у нас большой опыт выполнения срочных заказов.

4. Если потребуется доработка или дополнительная консультация, это бесплатно?
Да, доработки и консультации в рамках заказа бесплатны, и выполняются в максимально короткие сроки.

5. Я разместил заказ. Могу ли я не платить, если меня не устроит стоимость?
Да, конечно — оценка стоимости бесплатна и ни к чему вас не обязывает.

6. Каким способом можно произвести оплату?
Работу можно оплатить множеством способом: картой Visa / MasterCard, с баланса мобильного, в терминале, в салонах Евросеть / Связной, через Сбербанк и т.д.

7. Предоставляете ли вы гарантии на услуги?
На все виды услуг мы даем гарантию. Если эксперт не справится — мы вернём 100% суммы.

8. Какой у вас режим работы?
Мы принимаем заявки 7 дней в неделю, 24 часа в сутки.
🎬 Видео
8 класс. ОВР. Окислительно-восстановительные реакции.Скачать

Комплексные соединения. 1 часть. 11 класс.Скачать

25. Схема реакции и химическое уравнениеСкачать

Окислительно-восстановительные реакции в кислой среде. Упрощенный подход.Скачать

Реакции ионного обмена. 9 класс.Скачать

Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

СТРОЕНИЕ МИЦЕЛЛЫ - урок 2Скачать
Реакции ионного обмена. 9 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Схема строения мицеллыСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

СТРОЕНИЕ МИЦЕЛЛЫ - урок 4Скачать
Расчет выхода продукта от теоретически возможного. 10 класс.Скачать

Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Реакция на результаты ЕГЭ 2022 по русскому языкуСкачать




















