Для удаления аммиака из организма используется включение его в состав мочевины в печени и выведение ее с мочой, и удаление почками в виде аммонийных солей.
Однако, так как аммиак является чрезвычайно токсичным соединением, то предварительно в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки. – синтез глутаминовой кислоты и глутамина, синтез аспарагина:
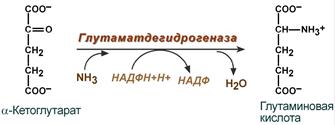
- синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
- Напишите уравнение реакции образования аспарагина
- Физические свойства
- Биологическая роль
- Природные источники
- Лекарственные препараты, содержащие аминокислоты (аспарагиновую кислоту и аспарагин)
- Аспарагиновая кислота: структурная формула, функции, синтез
- Аспарагиновая кислота: структурная формула
- Аспарагин: структурная формула
- Функции аспарагиновой кислоты
- Синтез аспарагиновой кислоты и фермент АСТ
- Синтез аспарагина
- Функции аспарагиновой кислоты: синтез
- Функции аспарагиновой кислоты: энергия
- Функции аспарагиновой кислоты: переаминирование
- Обезвреживание аммиака
- 💥 Видео
Реакция синтеза глутаминовой кислоты
- синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите уравнение реакции образования аспарагина
Аспарагин не является незаминимой аминокислотой и способен синтезироваться основными метаболическими путями в организме человека.
Аспарагин играет в организме важную роль, он служит сырьем для производства аспарагиновой кислоты.
По своей химической формуле аспарагин очень близок к глутамину, отличаясь от последнего лишь одной группой –СН2.
По химическим свойствам он проявляет ряд особенностей (коричневая окраска продукта реакции с нингидридом, существование в кристаллах только в виде гидратов и т.д.
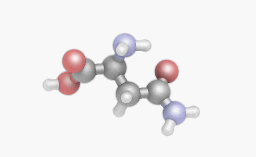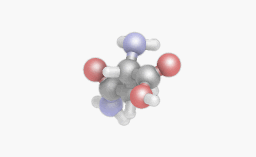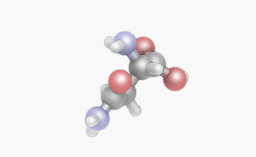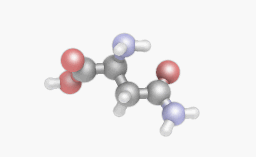
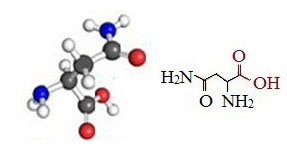
Аспарагин — 4-амид-2-аминобутандиовая или γ-амид-α-аминоянтарная кислота).
Аспарагин (Асн, Asn, N) ) — это моноамид аспаргиновой кислоты, химическая формула HOOC-CH (NH2) -CH2-CONH2. В нем гидроксильная группа заменена аминогруппой.
В 1806г. Луи Никола Воклен и Пьер Жан Робике впервые выделили из спаржи – аспарагин, однако присутствие его в белках было доказано позже (1932 г.).
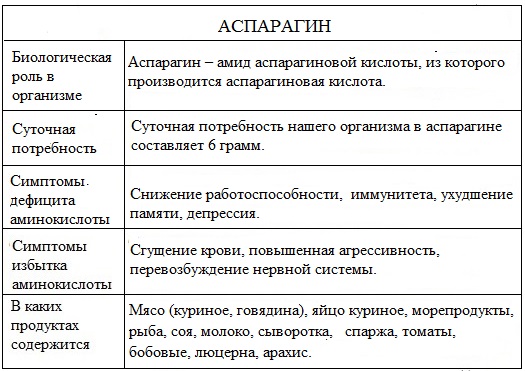
Суточная потребность нашего организма в аспарагине составляет 6 грамм.
Физические свойства
Аспарагин – белое кристаллическое вещество, растворим в воде, не растворим в органических растворителях, имеет сладкий вкус. Температура плавления 220 0 С (с разл.) Аспарагин легко образует внутреннюю соль — бетаин. У молекулы аспарагина отсутствуют внутримолекулярные водородные связи.
Биологическая роль
Одним из способов обезвреживания аммиака является дезаминирование амидов аминокислоты (аспарагина). Образование аспарагина является важным вспомогательным путем связывания аммиака.
Этот процесс активен в нервной, мышечной ткани и в почках.
Аспарагин считают своеобразной трансформенной формой аммиака, т.к, образуясь в тканях, они с кровью попадают в почки, где подвергается гидролизу под действием специфических ферментов.
Природные источники
Аспарагин находится в мясе (куриное, говядина), яйце, морепродуктах, рыбе, сое, молоке, сыворотке, спарже, томатах, бобовых, люцерне, арахисе.
Лекарственные препараты, содержащие аминокислоты (аспарагиновую кислоту и аспарагин)
В практической медицине применяются препараты отдельных аминокислот. Широко используются в клинике аспарагиновая кислота в виде калиевых и магниевых солей – преараты «панангин» и «аспаркам».
Комбинированный препарат «Панангин» содержит 0,158 г калия аспаргината и 0,14 г магния аспаргината.
Аналогичный препарат под названием «Аспаркам» содержит по 0,175 г калия и магния аспарагина (считают, что аспарагинат является переносчиком ионов калия и магния и способствует их проникновению во внутриклеточное пространство).
Аспарагиновая кислота принимает активное участие в аминокислотном обмене, являясь исходным материалом для синтеза заменимых аминокислот в организме.
Аспарагинат усиливает проницаемость клеточных мембран для ионов калия и магния, что повышает активность синтетических процессов в клетках и облегчает процесс мышечного сокращения.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Аспарагиновая кислота: структурная формула, функции, синтез

Аспарагиновая кислота иначе аспартат вместе с большим братом глутаминовой кислотой (глутаматом) относят к дикарбоновым аминокислотам, т.е. соединениям, имеющим два кислотных хвоста СООН. Важность этих соединений такова, что они вместе с амидами составляют половину всего аминного азота тканей, а в нервной системе они составляют 70% всех аминокислот. Прочитайте статью до конца и вы узнаете, в чем важность аспарагиновой кислоты и аспарагина для организма человека. С вами Галина Батуро и аспарагиновая кислота.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Аспарагиновая кислота: структурная формула
Аспарагиновая кислота (аспартат) имеет 2 оптических изомера, которые условно называются L-аспартат и D-аспартат. Природная протеиногенная аминокислота относится к L – изомерам, D- изомер встречается в организме человека в свободном виде, но выполняет свои специфические функции и в состав белка не входит. Далее речь пойдет об L-аспарагиновой кислоте и ее производном аспарагине.
Аспарагиновая кислота входит в состав практически всех белков организма. Так как атомы водорода на кислотных хвостах очень подвижны, они обеспечивают водородные связи, которые формируют вторичную и третичную структуру белковых молекул, стабилизируя их в водной среде. Благодаря наличию двух кислотных хвостов, ее относят к кислым аминокислотам. Кислотные хвосты придают аминокислоте гидрофильные свойства, т.е. она хорошо растворяется в воде. Это имеет значение, т.к. все ферментативные реакции идут в водной среде, а аспарагиновая кислота – весьма активный участник биохимического конвейера.
Аспарагиновая кислота присутствует в плазме крови в сравнительно небольшом количестве, всего 0,01-0,07 мгна 100 мл. плазмы крови. Наличие аспарагина в плазме крови заслуживает внимания, его содержание 0,6-1,4 мгна 100 мл. плазмы крови, т.е. почти в 100 раз больше. Аспарагиновая кислота является преобладающим аминокислотным компонентом животных тканей. А вот с мочой в свободном состоянии она почти не выводится.
Видео:Составление уравнений реакций горения. 11 класс.Скачать

Аспарагин: структурная формула
Аспарагин представляет собой амид аспарагиновой кислоты, т.е. у второго кислотного хвоста атом водорода замещен на вторую аминную группу. Получается, как бы вторая голова, притороченная к хвосту. В мире химических соединений этим никого не удивишь.
На наше счастье аспарагиновая кислота и аспарагин являются заменимыми аминокислотами, т.е. организм сам синтезирует их на своей биохимической фабрике из соединений — предшественников, которые всегда имеются в достатке. Аспарагин представляет собой широко-распространенное соединение. Он накапливается в значительных концентрациях у некоторых видов высших растений, а также содержится в свободном состоянии в тканях животных.
Аспарагиновая кислота и аспарагин относятся к глюкогенным соединениям. В процессе биосинтеза они превращаются в ОксалАцетат, который либо сгорает с образованием энергии, в цикле Кребса, либо идет на синтез гликогена, который является депо глюкозы в организме и по мере надобности превращается в глюкозу.
Видео:Трипептиды как составлять (РязГМУ 2 семестр последний коллок)Скачать

Функции аспарагиновой кислоты
- Структурная – входит в состав практически всех белков
- Участие в биосинтезе
- Энергетическая
- Является депо аминных групп
- Участвует в обезвреживании аммиака
- Транспортная
- Является нейромедиатором
- Иммунная активность
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Синтез аспарагиновой кислоты и фермент АСТ
Синтез аспарагиновой кислоты непрерывно идет в организме. Еще бы, ведь она вместе с глутаминовой кислотой является этаким складом аминных групп NH2. Аминокислоты превращаются друг в друга в реакциях переаминирования. При поступлении аминокислот в организм, ферменты трасферазы рубят аминные головы и насаживают их — нет, не на колья — а синтезируя глутамат и аспарагинат. Активным участником реакции переаминирования является пиридоксальфосфат или витамин В6. Он заставляет работать фермент трансферазу, принимая на себя аминную голову от глутамата и передавая ее оксалацетату, который превращается в аспарагиновую кислоту. Оксалацетат — продукт превращения глюкозы в Цикле Кребса, он сам может превратиться в глюкозу, а может стать источником аспарагиновой кислоты.
Фермент АспартатАминоТрансфераза, иначе говоря АСТ (АсАТ) имеет как цитоплазматическую, так и митохондриальную формы. В наибольшем количестве он содержится в клетках сердечной мышцы (миокарде) и печени (гепатоцитах), в значительных количествах он имеется в скелетной мускулатуре. Содержание его в крови очень низкое, т.е. данный фермент является органоспецифичным. Заметно, что максимальный уровень фермента имеется в сократительных клетках, которые выполняют механическую работу (кардиоциты, миоциты), т.е. там, где выделяется много аминного азота. Клетки печени также выполняют специфическую работу по утилизации лишнего аминного азота, синтезируя из вредного аммиака безвредную мочевину. Для всех этих целей требуется аспарагиновая кислота.
При разрушении клеток сердца, печени или скелетной мускулатуры при заболевании (инфаркт миокарда, гепатит, травмы) фермент АСТ поступает в кровь, и его содержание значительно увеличивается. Увеличение АСТ имеет диагностическое значение и свидетельствует о процессе, сопровождающемся разрушением клеток внутренних органов, в первую очередь сердечной мышцы, печени, поджелудочной железы, скелетной мускулатуры при обширных травмах.
Видео:25. Схема реакции и химическое уравнениеСкачать

Синтез аспарагина
Аспарагиновая кислота является источником аспарагина, приобретая дополнительную аминную группу NH2. Казалось бы чего проще: взять аммиак, которого всегда полно и который просто необходимо обезвредить, присоединить его к аспарагиновой кислоте — и вот он, аспарагин.
Такая реакция действительно существует. Она идет при участии АТФ под действием фермента АммиакЗависимой АспарагинСинтетазы у многих бактерий. Относительно человека мнения корифеев разнятся: некоторые считают, что данная реакция не характерна для высших животных, другие утверждают обратное. Одно можно сказать наверняка: прямой синтез аспарагина из аспарагиновой кислоты и аммиака не является ведущим у человека. У людей преимущественно протекает другая реакция: см. ниже.
Донором аминной группы для синтеза аспарагина в клетках человека выступает глутамин. При участии фермента ГлутаминЗависимой АспарагинСинтетазы, он отдает одну аминную голову аспарагиновой кислоте, и сам превращается в глутаминовую кислоту. Реакция идет при участии АТФ, от которой отщепляются два остатка фосфорной кислоты, при этом АТФ превращается в АМФ. Синтез аспарагина — энергозатратный процесс, для осуществления которого требуется химическая энергия, запасенная в фосфорных связях АТФ.
Видео:Пептидная связь. Образование пептидной связи. Запись структурной формулы пептида.Скачать

Функции аспарагиновой кислоты: синтез
Аспарагиновая кислота — родоначальник многих важных соединений. Она необходима для синтеза другой дикарбоновой кислоты — глутаминовой (глутамата), из нее образуется аспарагин, на ее основе строятся пиримидиновые нуклеотиды, она отдает атом азота для построения пуриновых нуклеотидов, она необходима для синтеза мочевины при утилизации вредного аммиака в печени, при этом образуется аминокислота аргинин. В головном мозге аспарагиновая кислота является источником N-ацетиласпарагиновой кислоты — вещества, необходимого для синтеза миелина — изолятора нервного волокна. Из аспарагиновой кислоты образуется оксалацетат, который в свою очередь запускает энергетический Цикл Кребса. Оксалацетат также является источником глюкозы, которая обеспечивает организм энергией. При участии аспарагиновой кислоты образуется АМФ (АденазинМоноФосфорная кислота), которая является заготовкой для энергетической молекулы АТФ (АденазинТриФосфорная кислота), образующейся в Цикле Кребса. Таким образом аспарагиновая кислота сопрягает пластический и энергетический обмен, а также обмен аминокислот, нуклеотидов и углеводов.
- Аспарагиновая кислота является источником аспарагина. Синтез из аммиака при участии фермента АммиакЗависимойАспарагинСинтетазы и из глутамина при участии фермента ГлутаминЗависимойАспарагинСинтетазы рассмотрен выше.
- Аспарагиновая кислота является предшественником другой дикарбоновой аминокислоты – глутаминовой (глутамата).
В организме постоянно происходит переброс аминных групп с аспартата на глутамат и наоборот. Переброс осуществляется через небезызвестный оксалацетат при участии фермента трансферазы (АСТ) и пиридоксальфосфата (витамин В6).
3. Аспарагиновая кислота является источником для построения пиримидиновых нуклеотидов, которые необходимы для обновления информационных матриц клетки ДНК и перебросе информации при синтезе белка через РНК. Синтез осуществляется через сложную цепь реакций, в которой на начальном этапе задействован КарбамилФосфат (тот же, что и в синтезе мочевины при обезвреживании аммиака). Промежуточным соединением выступает оротовая кислота, которая является строительным материалом для синтеза пиримидинов
4. Аспарагиновая кислота отдает атом азота для построения пуриновых нуклеотидов, также входящих в состав информационных матриц клетки ДНК и участвующих в синтезе белка РНК. Было установлено, что аспарагиновая кислота является источником атома N1 пуриновых нуклеотидов.
5. Синтез АМФ — АденозинМоноФосфорной кислоты. АМФ является предшественником АДФ — АденозинДиФосфорной кислоты, из которой присоединением фосфорного хвоста образуется АТФ — АденозинТриФосфорная кислота — молекула, обеспечивающая клетку химической энергией, запасенной в фосфорных связях. Заготовкой для АМФ выступает инозиновая кислота (ИМФ). Аспарагиновая кислота отдает аминную группу NH2. Энергией реакцию обеспечивает ГТФ (ГуанидинТриФосфорная кислота). Для синтеза также необходимы ионы Магния.
6. В головном мозге аспарагиновая кислота является источником для синтеза N-Ацетил Аспарагиновой кислоты. Это вещество образуется в митохондриях нейронов из аспарагиновой кислоты и АцетилКоА. Реакция идет при участии фермента Аспартат-N-АцетилТрансферазы (ANAT). Из митохондрий N-АцетилАспартат поступает в олигодендроциты и астроциты — клетки нервной глии, или клетки-помощники, питающие и поддерживающие нервные клетки. N-АцетилАспартат является предшественником другого важного нейротрансмиттера N-АцетилАспартилГлутамата. Также N-АцетилАспартат регулирует осмотическое давление в головном мозге, он участвует в синтезе миелина — вещества, образующего электроизолирующую оболочку отростков нервных клеток.
Видео:Химические свойства алканов. 1 часть. 10 класс.Скачать

Функции аспарагиновой кислоты: энергия
Аспарагиновая кислота является источником энергии для организма, недаром она содержится в наибольшем количестве в клетках, выполняющих работу: в кардиоцитах (клетках сердца), гепатоцитах (клетках печени), миоцитах (мускульных клетках). При участии фермента АСТ и пиридоксальфосфата (витамина В6) аспарагиновая кислота отдает аминную голову глутаминовой кислоте, а сама превращается в оксалацетат — вещество, запускающее энергетический Цикл Кребса. Каскад биохимических превращений способствует запасанию биохимической энергии в фосфорных связях молекул АТФ.
Оксалацетат при необходимости может стать источником для выработки глюкозы — молекулы, дающей энергию мышцам и нервной ткани. Аспартат является глюкогенной аминокислотой. При ее избытке, печень быстро переработает ее на гликоген, и это не самый печальный вариант. Глюкоза — источник жира. Жир тоже дает энергию, причем намного больше, только вот извлечь ее сложнее.
И это еще не все. Аспрагиновая кислота отдает свой азот для построения пуриновых нуклеотидов: аденина и гуанина. Аденин является основой молекулы, в которой запасена химическая энергия — АТФ — АденозинТриФосфорная кислота.
Также аспарагиновая кислота участвует в синтезе АМФ (АденозинМоноФосфорной кислоты) — это заготовка, к которой присоединяются дополнительные два фосфорных хвоста, чтобы получилась АТФ — высокоэргическая молекула, в фосфорных связях которой запасена химическая энергия.
Аспарагиновая кислота — вещество, обеспечивающее энергией биохимический конвейер.
Видео:Получение алканов. Реакция Вюрца (механизм + сложные случаи). ЕГЭ по химии.Скачать

Функции аспарагиновой кислоты: переаминирование
Аминный азот практически всех аминокислот (за исключением лизина, треонина и пролина) через посредство ферментов аминотрансфераз переходит на глутамат. Аминный азот этих трех аминокислот тоже в конечном итоге оказывается в составе глутаминовой кислоты, но более сложным путем. Так осуществляется депонирование аминного азота в организме. Накопление аминного азота в форме глутаминовой кислоты происходит в цитозоле клеток. Затем специфические ферменты транслоказы переносят глутамат в митохондрии, где активна специфическая АСТ. АСТ превращает глутамат опять в α-кетоглутарат, а тот вновь вступает в реакции переаминирования, принимая на себя аминные головы различных аминокислот, и вновь превращаясь в глутамат.
Аспартат (аспарагиновая кислота), образующийся в митохондриях в реакциях транс аминирования между оксалацетатом и глутаматом, может транспортироваться в цитозоль клетки, где он отдает аминную группу NH3 в цикл мочевины, образуя аминокислоту аргинин. Это реакция, составляющая Аспартат-АргининоСукцинатный шунт, обеспечивают связь между путями, в которых утилизируется аминогруппы и углеродный скелет аминокислот. Утилизация аминогрупп в синтезе безвредной мочевины происходит в клетках печени, и в меньшей степени почек.
Реакции трансаминирования являются начальным этапом распада аминокислот в организме. В результате аминный азот через аспарагиновую кислоту перебрасывается на глутаминовую кислоту, а углеродный скелет либо сгорает в цикле Кребса с образованием энергии, либо идет на синтез глюкозы и кетоновых тел. Аспарагиновая кислота выступает посредником в передаче аминного азота в депо, каковым выступает глутаминовая кислота. Только глутаминовая кислота в тканях человека способна подвергаться прямому окислительному дезаминированию. Все остальные аминокислоты подвергаются непрямому дезаминированию с перебросом аминных групп NH3 первоначально на глутаминовую кислоту, а вторым этапом происходит дезаминирование глутамата.
В мышечной ткани при интенсивной физической нагрузке функционирует другой путь непрямого дезаминирования с непосредственным участием аспарагиновой кислоты. Начальный путь такой же, как и при обычном непрямом дезаминировании, когда аминные группы почти всех аминокислот собираются на глутамат. Потом с глутамата они перебрасываются на аспартат (аспарагиновую кислоту), затем аминная голова с аспартата перекидывается на инозиновую кислоту (ИМФ), в результате получается АМФ. Аспартат, лишившись аминной головы, превращается в фумарат. Далее фумарат по цепочке Цикла Кребса превращается в малат, а тот в оксалацетат, который ловит аминную голову с глутамата, чтобы превратиться в аспартат. Так обеспечивается работа конвейера по переброске аминного азота со всего пула аминокислот на ИМФ. АМФ подвергается гидролитическому дезаминированию, т.е фермент АМФ-дезаминаза откусывает аминную голову у АМФ, получается ИМФ, которая опять готова к работе на конвейере и свободный аммиак NH3.
Представленная схема отражает последовательность реакций непрямого окислительного дезаминирования в мышечной ткани при интенсивной физической нагрузке.
При интенсивной мышечной работе, когда задействован данный путь дезаминирования, одновременно утилизируется глюкоза с образованием молочной кислоты (лактата), что приводит к закислению внутренней среды клетки, а это нежелательно. Выделяющийся аммиак имеет щелочную реакцию и нейтрализует избыточную кислотность.
Можно выделить 4 стадии процесса:
- Трансаминирование с α-кетоглутаратом, образование глутамата
- Трансаминирование глутамата с оксалацетатом (фермент АСТ), образование аспартата
- Реакция переноса аминогруппы с аспаратата на инозиновую кислоту (ИМФ, ИнозинМоноФосфат), образование АМФ (АденозинМоноФосфат) и фумарата
- Гидролитическое дезаминирование АМФ с выделением аммиака NH3.
Химические реакции первых двух стадий были представлены выше.
Третьей стадией является реакция переноса аминогруппы с аспартата на инозиновую кислоту происходит в два этапа. На первом этапе под воздействием фермента АденилоСукцитанСинтетазы Аспарагиновая кислота присоединяется к ИМФ, в результате образуется АденилоСукцинат. Процесс идет с затратой энергии, которую отдает ГТФ (ГуанозинТри Фосфат), при этом отщепляется остаток фосфорной кислоты, а ГТФ превращается в ГДФ (ГуанозинДиФосфат). Затем фермент АденилоСукцинат Лиаза расщепляет АденилоСукцинат на АМФ (АденозинМоноФосфат) и Фумаровую кислоту (Фумарат).
Видео:ЭТО ПОМОЖЕТ разобраться в Органической Химии — Алкены, Урок ХимииСкачать

Фумаровая кислота отправляется на синтез оксалацетата, который превратится в аспарагиновую кислоту, позаимствовав аминную голову у глутамата. Так замыкается конвейер по транспортировке аминного азота. Отходы минимальны. Все (или почти все) возвращается в биохимический цикл.
Четвертым этапом образовавшийся АденозинМоноФосфат теряет амминую голову и вновь превращается в ИнозинМоноФосфат (ИМФ), который опять отправляется ловить аминную голову у аспартата.
Видео:4.3. Алкадиены (диены): Химические свойства. ЕГЭ по химииСкачать

Обезвреживание аммиака
При богатой белками пище аминокислот оказывается больше, чем их необходимо для синтеза белка. Избыток отправляется на плаху, каковая находится в печени. Ферменты рубят аминные головы, скелеты отправляются на переработку в цикл глюконеогенеза, а вот аминная голова начинает жить жизнью зомби, превращаясь в аммиак – клеточный яд. Та же страсть происходит и при интенсивной мышечной работе. Работа – это энергия, для энергии нужна глюкоза, чтобы получить глюкозу…. Ну вы поняли. Блуждающие аминокислотные головы в форме аммиака, которые опасны не менее сказочных упырей, необходимо обезвредить. Аспарагиновая кислота – один из участников этой героической саги.
В печени происходит магическое действо, где образующийся аммиак обезвреживается через каскад реакций, в одной из которых непосредственное участие принимает аспарагиновая кислота. Она участвует в реакции синтеза аргинина, необходимого для обезвреживания аммиака и синтеза мочевины. Аминная группа аспарагиновой кислоты переходит на аргинин. Подробности можно узнать здесь: Аргинин: структурная формула и биосинтез. Заканчивается все это волшебство образованием неопасной мочевины, которая выводится через почки. Половина азота, освобождающего в процессах биохимических трансформаций аминокислот, не образует аммиака, а сразу улавливается аспарагиновой кислотой и вовлекается в синтез мочевины.
Аспарагиновая кислота вместе с глутаминовой кислотой связывают, транспортируют и утилизируют биологически активный азот. Фактически, через две эти аминокислоты проходит весь азот, задействованный в обмене веществ. Аспарагиновая кислота способствует поддержанию азотистого равновесия в организме.
С вами была Галина Батуро и аспарагиновая кислота. Делитесь информацией в соц. сетях, оставляйте комментарии.
💥 Видео
Реакции на аминогруппуСкачать

Аэробный и анаэробный гликолиз. Реакции катаболизма глюкозы. Расчет выхода АТФ в гликолизеСкачать

ДВИ по химии. Термохимия. Уравнение Аррениуса, закон Гесса, задачи на теплоемкостьСкачать

Занятие 4. "Энергетический профиль химической реакции".Скачать
Органика. Учимся составлять и читать химические уравнения в органической химии.Скачать

Химия 11 класс: Ионные уравненияСкачать

АМИНОКИСЛОТЫ. ГОТОВИМСЯ К МИКРОКОНТРОЛЮСкачать

Как рассчитать стандартную энтальпию образования вещества | Физическая химияСкачать