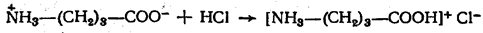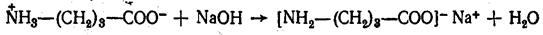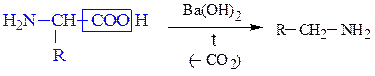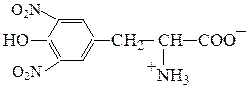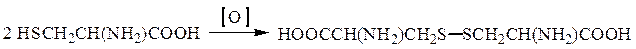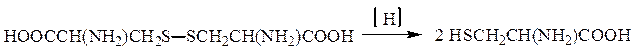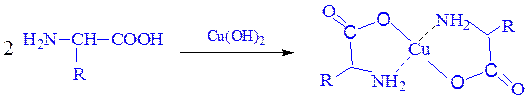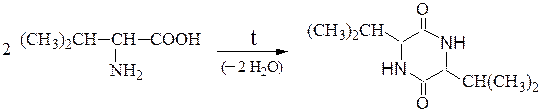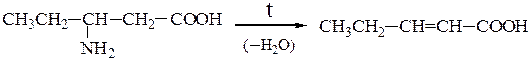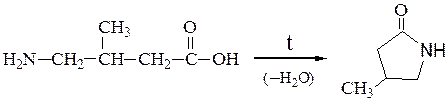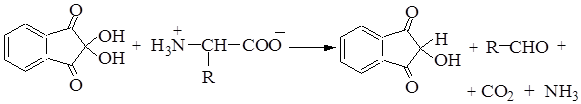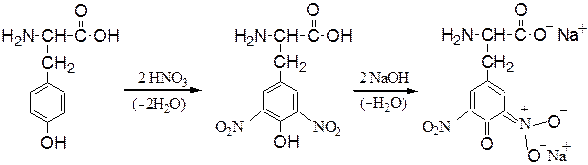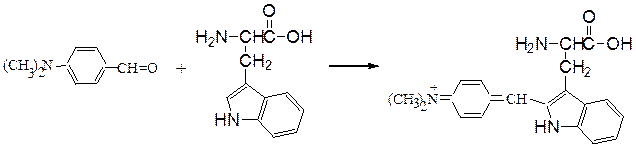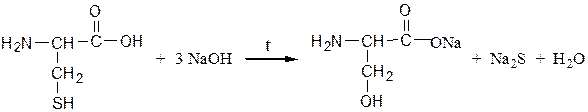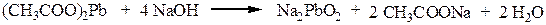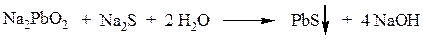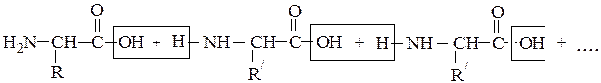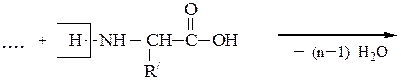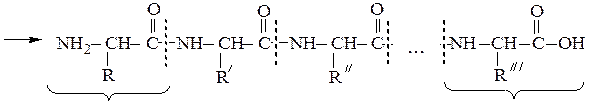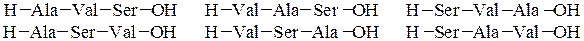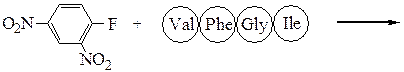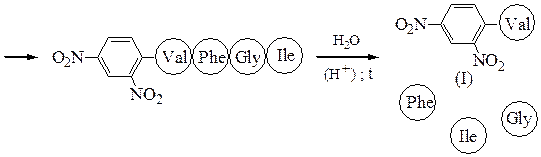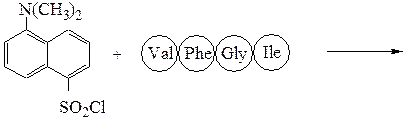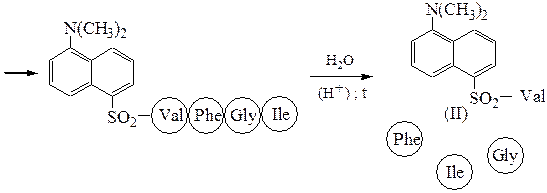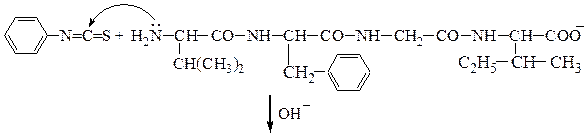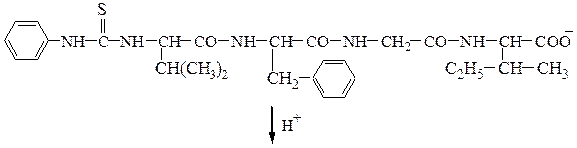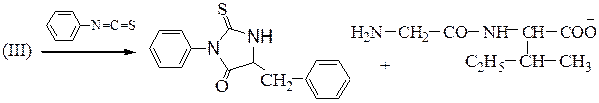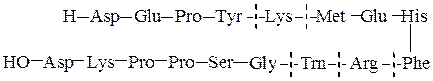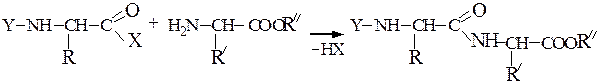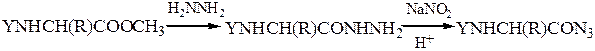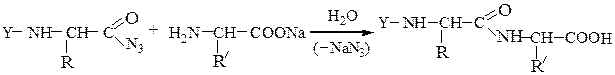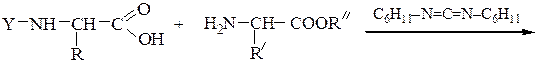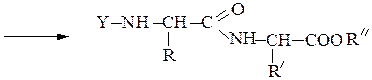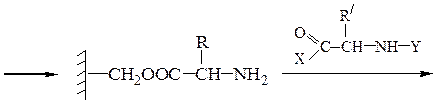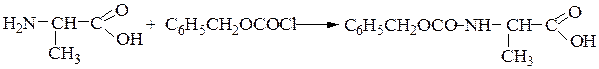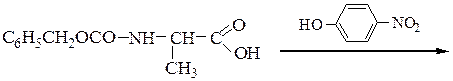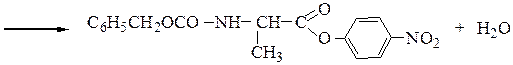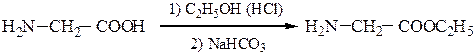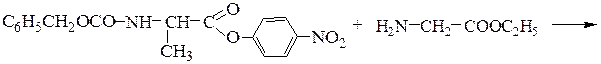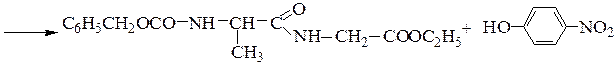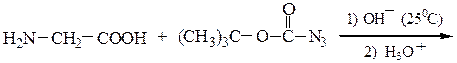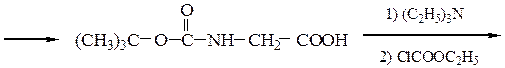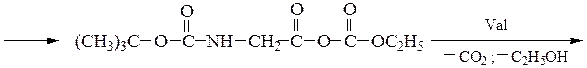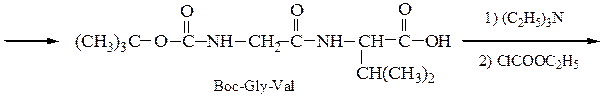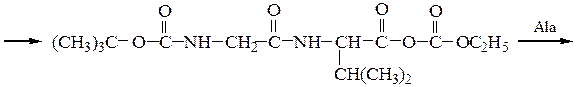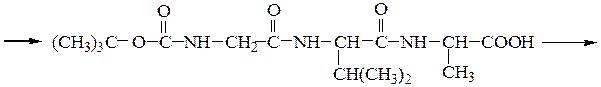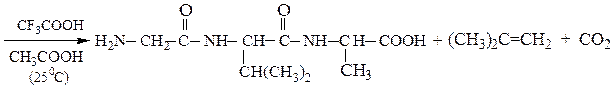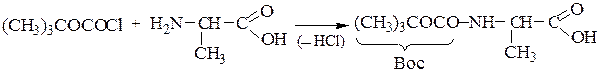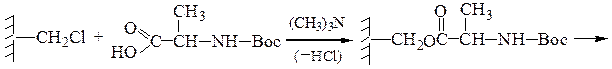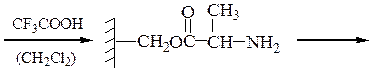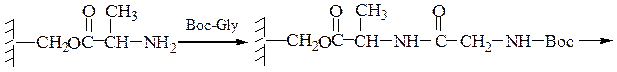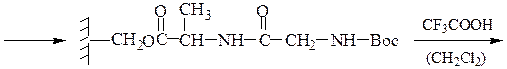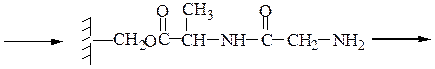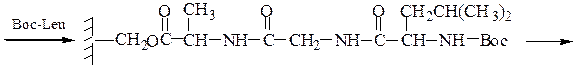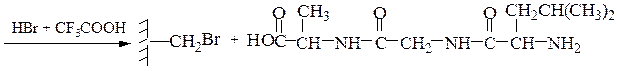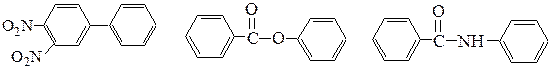FOR-DLE.ru — Всё для твоего DLE 😉
Привет, я Стас ! Я занимаюсь так называемой «вёрсткой» шаблонов под DataLife Engine.
На своем сайте я выкладываю уникальные, адаптивные, и качественные шаблоны. Все шаблоны проверяются на всех самых популярных браузерх.
Раньше я занимался простой вёрсткой одностраничных, новостных и т.п. шаблонов на HTML, Bootstrap. Однажды увидев сайты на DLE решил склеить пару шаблонов и выложить их в интернет. В итоге эта парочка шаблонов набрала неплохую популярность и хорошие отзывы, и я решил создать отдельный проект.
Кроме шаблонов я так же буду выкладывать полезную информацию для DataLife Engin и «статейки» для веб мастеров. Так же данный проект будет очень полезен для новичков и для тех, кто хочет правильно содержать свой сайт на DataLife Engine. Надеюсь моя работа вам понравится и вы поддержите этот проект. Как легко и удобно следить за обновлениями на сайте?
Достаточно просто зарегистрироваться на сайте, и уведомления о каждой новой публикации будут приходить на вашу электронную почту!
Задание 1
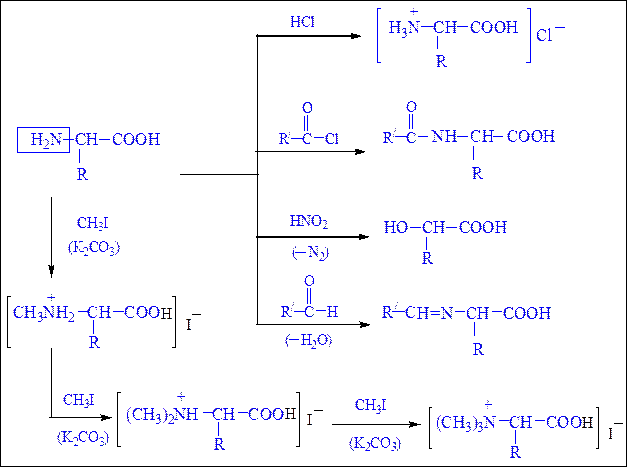
Какие органические вещества называют аминокислотами?
Органические вещества, содержащие в молекуле карбоксильную группу ―COOH и аминогруппу ― NH2.
Приведите примеры формул и названий таких соединений.
H2N ― CH2 ― COOH аминоуксусная кислота.
CH3 ― CH(NH2) ― COOH 2-аминопропионовая кислота.
C2H5 ― CH(NH2) ― COOH 2-аминобутановая кислота.
Почему их относят к амфотерным органическим соединениям? Аминокислоты могут проявлять кислотные свойства, которые определяет карбоксильная группа ― COOH, и основные свойства, которые определяет аминогруппа –NH2 , которая способна присоединять к себе катион водорода по донорно-акцепторному механизму за счёт наличия свободной электронной пары в атома азота.
Аминокислоты взаимодействуют с кислотами и щелочами:
H2N ― CH2 ― COOH + NaOH ⟶ H2N ― CH2 ― COONa + H2O
H2N ― CH2 ― COOH + HCl ⟶ [H3N ― CH2 ― COOH]Cl
Задание 2
Какие природные биополимеры называют белками?
Белки ― это природные полимеры, образованные остатками аминокислот, связанными между собой пептидными связями.
Задание 3
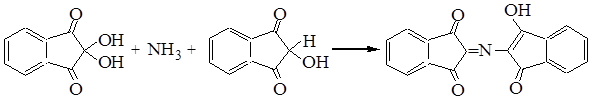
Опишите качественные реакции на белки.
1. Качественной реакцией на пептидные группы в молекулах органических соединений, является биуретовая реакция . При взаимодействии белков с раствором соли меди (II) в щелочной среде возникает фиолетовая окраска.
2. К ачественной реакцией на белок, содержащий фрагменты молекул ароматических аминокислот, является ксантопротеиновая реакция . Если белки или их растворы нагревать с концентрированной азотной кислотой, то имеющиеся в белках фрагменты молекул ароматических аминокислот взаимодействуют с этой кислотой с образованием азотсодержащих соединений желтого цвета.
Задание 4
Что называют денатурацией белка? Денатурация ― нарушение структуры белка.
Во время денатурации сохраняется только первичная структура белка, а остальные (вторичная, третичная и четвертичная) необратимо разрушаются.
Какие факторы могут её вызвать? Температура, механическое воздействие, действия химических реагентов.
Задание 5 Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
глюкоза ⟶ этиловый спирт ⟶ уксусный альдегид ⟶ уксусная кислота ⟶ хлоруксусная кислота ⟶ аминоуксусная кислота ⟶ дипептид аминоуксусной кислоты.
C6H12O6дрожжи ⟶ 2C2H5OH + 2CO2↑
2C2H5OH + O2 ⟶ 2CH3CHO + 2H2O (t 0 , кат.)
2CH3CHO + O2 ⟶ 2CH3COOH (t 0 , кат.)
CH3COOH + Cl2 ⟶ CH2ClCOOH + HCl (кат.)
CH2ClCOOH + 2NH3 ⟶ H2N ― CH2 ― COOH + NH4Cl 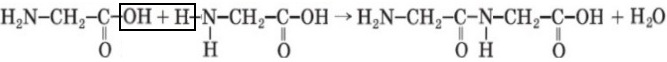
или так записать:
H2N ― CH2 ― COOH + H2N ― CH2 ― COOH ⟶ H2N ― CH2 ― CO ― NH ― CH2 ― COOH + H2O
Задание 6
В медицине для улучшения обменных процессов в центральной нервной системе применяют глицин в таблетках. Рассчитайте количество вещества глицина, содержащегося в одной таблетке массой 0,15 г, если известно, что в качестве вспомогательных веществ каждая таблетка содержит также 1% стеарата магния и 1% метилцеллюлозы.
Дано: m(таблетки)=0,15г, ω(стеарата магния)=1%, ω(метилцеллюлозы)=1%
Найти: n(NH2CH2COOH)-?
Решение
1. Рассчитываем массовую долю глицина в таблетке.
ω(NH2CH2COOH)=100%−ω(стеарата магния)−ω(метилцеллюлозы)=100%-1%-1%=98%
2. Вычисляем массу глицина в таблетке.
m(NH2CH2COOH)=ω(NH2CH2COOH) • m(таблетки):100%=98% •0,15 г:100%=0,147 г
3. Вычисляем ко личество вещества глицина массой 0,147 г по формуле: n =m/M, где M ― молярная масса.
M (NH2CH2COOH )=75 г/моль
n( NH2CH2COOH )=m( NH2CH2COOH )/M( NH2CH2COOH )=0,147 г : 75 г/моль=0,00196 моль=1,96 ммоль
Ответ: в таблетке содержится 1,96 ммоль глицина.
Задание 7
В двух пробирках находятся растворы глюкозы и белка. Как с помощью одного и того же реактива различить их?
Различить растворы глюкозы и белка можно с помощью свежеприготовленного осадка гидроксида меди (II). Под его действием белки (в щелочной среде) дают фиолетовое окрашивание (биуретовая реакция) , а глюкоза (как многоатомный спирт) образовывает с ним растворимое соединение ярко-синего цвета.
Задание 8
Какую биологическую роль играют белки в организме? При ответе используйте не только материал параграфа, но и знания, полученные на уроках биологии.
Белки ― строительный материал любого живого организма. В процессе пищеварения белки гидролизуются до аминокислот, из которых организм синтезирует необходимые для него белки.
Белки очень важны для организма:
― глицин и глутамин ― нейромедиаторы (участвуют в передаче нервных импульсов) ;
― с тирозина образуется йодтироксин (гормон щитовидной железы) ;
― белки-ферменты ускоряют реакции;
― гемоглобин в составе эритроцитов переносит кислород к тканям и углекислый газ от них;
― миоглобин запасает кислород в мышцах;
― белок коллаген, есть в составе кожи и костей, сохраняет определенную их форму и упругость;
― родопсин ― это белок-рецептор, воспринимает свет на сетчатке глаза и т.д.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Лабораторная работа №1
Лабораторная работа №1
ХИМИЯ ПРОСТЫХ БЕЛКОВ.
ЦВЕТНЫЕ РЕАКЦИИ НА БЕЛКИ И АМИНОКИСЛОТЫ
Белки представляют собой высокомолекулярные полимерные органические соединения, построенные из остатков различных α-аминокислот, соединенных ковалентной пептидной связью.
Присутствие белка в растворах можно обнаружить с помощью цветных реакций, обусловленных наличием в белке аминокислот, их специфических групп и пептидных связей. Существуют универсальные цветные реакции, т. е. на все белки (биуретовая и нингидриновая), и специфические, т. е. на определенные аминокислоты (ксантопротеиновая, Миллона, Фоля и др.).
На основании некоторых цветных реакций разработаны методы количественного определения белков и аминокислот, которые широко используются в биохимических лабораториях.
Цель: Ознакомиться с универсальными цветными реакциями на белки и специфическими реакциями на отдельные аминокислоты, содержащиеся в белковых растворах.
Работа 1. Биуретовая реакция на пептидную связь (Пиотровского)
Биуретовая реакция обусловлена наличием в белке пептидных связей, которые в щелочной среде образуют с сернокислой медью комплексы фиолетового цвета с красным или синим оттенком. Группа, образующая пептидную связь, в щелочной среде присутствует в своей таутомерной енольной форме:
При избытке щелочи происходит диссоциация ОН-группы, появляется отрицательный заряд, с помощью которого кислород взаимодействует с медью. Возникает солеобразная связь. Кроме того, медь образует дополнительные координационные связи с атомами азота, участвующими в пептидной связи, путем использования их электронных пар. Возникающий таким образом комплекс очень стабилен. Интенсивность окраски комплекса зависит от концентрации белка и количества медной соли в растворе.
Биуретовой реакцией обнаруживаются все без исключения белки, а также продукты их неполного гидролиза – пептоны и полипептиды. Для ди — и трипептидов биуретовая реакция ненадежна. Оттенок зависит от длины полипептидной цепочки. Пептоны при этой реакции дают розовое или красное окрашивание. Биуретовая реакция положительна и с веществами небелкового характера, имеющими в составе не менее двух – CO – NH2-групп, к ним относятся, например, оксамид – NH2 – CO – CO – NH2, биурет – N2H – CO – NH – CO – NH2.
Исследуемый материал: раствор яичного белка, раствор растительного белка, 1% раствор желатина.
Реактивы: 10% раствор NaOH, 1% раствор CuSO4.
Оборудование: пробирки, капельницы.
Ход работы. К 5 каплям водного раствора белка добавляют 5 капель 10% раствора NaOH и 2 капли 1% раствора CuSO4. Содержимое перемешивают. Оно приобретает сине-фиолетовый цвет. Нельзя добавлять избыток CuSO4, так как синий осадок маскирует характерное фиолетовое окрашивание биуретового комплекса.
Работа 2. Нингидриновая реакция на α-аминокислоты
Белки, полипептиды и свободные α-аминокислоты дают синее или фиолетовое окрашивание с нингидрином. При нагревании белка с водным раствором нингидрина аминокислоты окисляются и распадаются, образуя СО2, NH3 и соответствующий альдегид. Нингидрин, являясь сильным окислителем, вызывает окислительное дезаминирование α-аминокислоты, приводящее к образованию аммиака, двуокиси углерода, соответствующего альдегида и восстановленной формы нингидрина. Нингидрин восстанавливается и связывается со второй молекулой нингидрина посредством молекулы аммиака, образуя продукты конденсации, окрашенные в синий, фиолетовый, красный, а в случае пролина – в желтый цвет.
Видео:реакция меди с азотной кислотойСкачать

Химические свойства аминокислот
Химическое поведение аминокислот определяется двумя функциональными группами -NН2 и –СООН. Аминокислотам характерны реакции по аминогруппе, карбоксильной группе и по радикальной части, при этом в зависимости от реагента взаимодействие веществ может идти по одному или нескольким реакционным центрам.
Амфотерный характер аминокислот.Имея в молекуле одновременно кислотную и основную группу, аминокислоты в водных растворах ведут себя как типичные амфотерные соединения. В кислых растворах они проявляют основные свойства, реагируя как основания, в щелочных – как кислоты, образуя соответственно две группы солей:
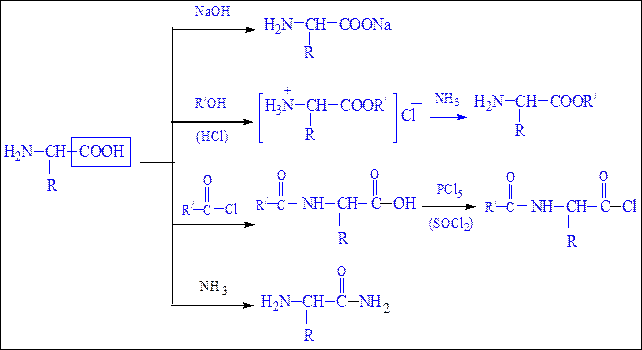
Реакции, обусловленные карбоксильной группой.При участиикарбоксильной группы аминокислоты образуют cоли, сложные эфиры, амиды, хлорангидриды в соответствии со схемой 24, представленной ниже:
Схема 24. Реакции аминокислот по карбоксильной группе.
Реакции, обусловленные аминогруппой.С участием аминогруппы аминокислоты образуют аммониевые соли с кислотами, ацилируются, алкилируются, реагируют с азотистой кислотой и альдегидами в соответствии со схемой 25 (с. 296).
Если при a-углеродном атоме в радикале имеется электроноакцепторный заместитель (-NO2, -СС13, -СООН, -COR и т.д.), поляризующий связь С-СООН, то у карбоновых кислот легко протекают реакции декарбоксилирования. Декарбоксилирование a-аминокислот, содержащих в качестве заместителя + NH3-группу, приводит к образованию биогенных аминов. В живом организме данный процесс протекает под действием фермента декарбоксилазы и витамина пиридоксальфосфата. В лабораторных условиях реакцию осуществляется при нагревании a-аминокислоты в присутствии поглотителей СО2, например, Ва(ОН)2.
Схема 25. Реакции аминокислот по аминогруппе.
При декарбоксилировании b-фенил-a-аланина, лизина, серина и гистидина образуются, соответственно, фенамин, 1,5-диаминопентан (кадаверин), 2-аминоэтанол-1 (коламин) и триптамин.
Реакции аминокислот с участием боковой группы. При нитровании аминокислоты тирозин азотной кислотой происходитобразованиединитропроизводного соединения, окрашенного в оранжевый цвет (ксантопротеиновая проба):
Окислительно-восстановительные переходы имеют место в системе цистеин – цистин:
В некоторых реакциях аминокислоты реагируют по обеим функциональным группам одновременно.
Образование комплексов с металлами.Почти все a-аминокислоты образуют комплексы с ионами двухвалентных металлов. Наиболее устойчивыми являются комплексные внутренние соли меди (хелатные соединения), образующиеся в результате взаимодействия с гидроксидом меди (II) и окрашенные в синий цвет:
Отношение аминокислот к нагреванию.При нагревании аминокислоты разлагаются с образованием различных продуктов в зависимости от их типа.
При нагревании a-аминокислот в результате межмолекулярной дегидратации образуются циклические амиды — дикетопиперазины:
При нагревании b-аминокислот от них отщепляется аммиак с образованием α,β-непредельных кислот с сопряженной системой двойных связей:
Нагревание g- и d-аминокислот сопровождается внутримолекулярной дегидратацией и образованием внутренних циклических амидов – лактамов:
Аналитически реакции.Для идентификации отдельных a-аминокислот, входящих в состав белков, применяются универсальные и специфические цветные реакции. К универсальным цветным реакциям относится нингидриновая реакция; к специфическим, которые обусловлены присутствием отдельных аминокислот, – ксантопротеиновая, Миллона, Фолина и т.д. Некоторые из цветных реакций положены в основу количественного определения аминокислот и белков.
Нингидриновая реакция.При нагревании белка с водным раствором нингидрина выделяется СО2 и NH3. Нингидрин при этом восстанавливается, a-аминокислота окисляется с образованием альдегида. Восстановленный нингидрин взаимодействует с аммиаком и гидратом трикетогидриндена с образованием соединения сине-фиолетового цвета (краситель Руэмана):
Цветная реакция предназначена для обнаружения a-аминокислот, используется для идентификации аминокислот при разделении на хроматограммах (бумага, тонкий слой) и при спектрофотометрическом определении на аминокислотных анализаторах (продукт поглощает свет в области 550 – 570 нм).
Ксантопротеиновая реакция – цветная качественная реакция на белки, содержащие остатки a-аминокислот с ароматическими или гетероцикличес-кими радикалами (Phe, Tyr, Trp). Реакция заключается в появлении желтой окраски при обработке белка (или пептида) концентрированной азотной кислотой, что обусловлено образованием окрашенных нитросоединений, которые в щелочной среде превращаются в оранжевые соли хиноидной структуры:
Реакция Эрлиха.Метод обнаружения триптофана или его остатков в белках или пептидах взаимодействием с 4-(N,N-диметиламино)бензальдегидом и концентрированной HCl, приводящим к образованию фиолетовой окраски:
Реакция Фоля.Реакция показывает присутствие в белках аминокислот – цистеина и цистина, содержащих слабосвязанную серу (сульфгидрильная проба). Метионин, практически не вступает в реакцию, так как сера в нем прочно связана. При кипячении раствора серосодержащего белка или аминокислоты с реактивом Фоля под действием щелочи образуется черный осадок. При кипячении в водном растворе щелочи вначале образуется Na2S:
Ацетат свинца реагирует со щелочью с образованием плюмбита натрия:
Затем сульфид натрия с плюмбитом дает черный или темно-коричневый осадок сульфида свинца:
Аргининможет быть обнаружен по образованию труднорастворимых солей с пикриновой, фосфорномолибденовой кислотой или по появлению розовой окраски с a-нафтолом или гипобромитом натрия NaOBr (реакция Сакагучи).
Например, пентапептид Н-Gly-Phe-Val-Туг-Met-ОН вступает в биуретовую, ксантопротеиновую и сульфгидрильную реакции.
ПЕПТИДЫ
Они представляют собой соединения, построенные из остатков α-амино-кислот, соединенных пептидной связью –СО–NH– Формально образование пептидной цепи из n молекул a-аминокислот можно представить так:
N-концевая аминокислота С-концевая аминокислота
При полном гидролизе разрываются все пептидные связи и образуются смеси a-аминокислот. Из п предметов можно составить п ! сочетаний при условии, что каждый из них встречается в любом сочетании только один раз. Из трех различных аминокислот (например, Ala, Val и Ser) можно составить 6 трипептидов, в которых каждая аминокислота встречается лишь один раз:
Пептидная цепь состоит из чередующихся пептидных и метиновых групп, которые связаны с боковыми радикалами аминокислот. Аминокислотный остаток со свободной аминогруппой на одном конце цепи называют N- концевым, а аминокислотный остаток со свободной карбоксильной группой – С – концевым. Для обнаружения пептидной природы органических соединений используется биуретовая реакция, которая проводится в щелочной среде с водным раствором солей меди (ІІ), при этом образуется хелатный комплекс сине-фиолетового цвета. Максимум поглощения продуктов лежит в области от 540 до 560 нм, что используется для количественного и качественного определения белков в биологических объектах, например, в сыворотке крови.
Аминокислотная последовательностьПервичную структуру определяют постадийным гидролизом пептидных связей и отщеплением остатков аминокислот одной от другой с одного и того же конца. Для гидролиза одной пептидной связи проводят ее активацию введением в N-концевой амино-кислотный остаток электроноакцепторного заместителя. Отщепленную аминокислоту идентифицируют, для чего вводят заместители-«метки», поглощающие в УФ-области спектра (при 265-270 нм), например 2.4-динитро-фторобензол (метод Сенгера), 5-диметиламинонафталин-1-сульфонилхлорид (метод Хартли и Грея) или фенилизотиоцианат (метод Эдмана). Производные N-концевого аминокислотного остатка (I)-(IV) идентифицируют также методами хроматографии.
Метод Сенгера:
Метод Хартли и Грея:
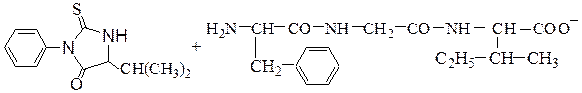
производное валина (III)
производное фенилаланина (IV)
С-концевую аминокислоту можно определить методом Акабори: при нагревании пептида с гидразином при температуре 110 0 С пептидные связи гидролизуются с образованием гидразидов аминокислот. С-концевая аминокислота освобождается в свободном виде и может быть выделена из реакционной смеси и идентифицирована.
С-концевую аминокислоту можно также индентифицировать, подвергая полипептид гидролизу с помощью фермента карбоксипептидазы, специфически разрывающий С-концевую амидную связь.
Полезную информацию о порядке соединения аминокислотных остатков в пептиде можно получить из того, что разрушение пептидных связей под действием ферментов, называемых протеазами, протекает избирательно. Так, химотрипсин катализирует гидролиз пептидных связей, образованных карбоксильными группами ароматических α-аминокислот (Туr, Phe, Trp), трипсин гидролизует связи, образованные карбоксильными группами основных α-аминокислот (Lys, Arg); термолизин расщепляет пептидные связи, включающие аминокислотные остатки с гидрофобной боковой цепью (Ile, Leu, Val, Phe, Tyr, Trp). Обрабатывая полипептид, таким образом можно расщепить его на небольшие фрагменты, в которых концевые группы могут быть определены, например, по методу Эдмана. Ниже приводится пример гидролиза:
химотрипсин трипсин химотрипсин
На основании имеющейся информации о фрагментах пептидных цепей можно установить полную аминокислотную последовательность в пептиде:
Синтез пептидов заключается в образовании пептидной связи между СООН-группой одной аминокислоты и a-NН2-группой другой аминокислоты. В соответствии с этим различают карбоксильный и аминный компоненты пептидного синтеза. Удлинение пептидной цепи проводят последовательно, присоединяя поочередно по одной аминокислоте. При проведении направленного синтеза пептидов необходима временная защита функциональных групп, не участвующих в образовании пептидной связи, и активация одного из компонентов пептидного синтеза. После окончания синтеза защитные группы удаляют.
Образование пептидных связей происходит в реакции между N-защищенной аминокислотой (защищена аминогруппа) или ее производным и аминокислотой в виде соли или сложного эфира (О-защищенная аминокислота):
N-защищенная группа обычно представлена алкоксикарбонильной группой [Y= C6H5CH2OCO-, (СНз)зСОСО-]. Такие соединения получаются при взаимодействии аминокислоты с хлоругольными эфирами R-OCOC1. Для этой цели используют также ацильные группы: формильную (НСО-), трифторацетильную (СFзСО-), п-толуолсульфонильную (тозильную), фталильную и др., а также тритильную (СбН5)3С- . Для реакции образования пептидной связи N-защищенную a-аминокислоту часто активируют, превращая в хлорангидрид (X = С1), активированный эфир (например, п-нитрофениловый, X = -О-С6Н4-NO2-n) или азид (X = N3). Исходный азид получают по схеме:
Данный метод удобен тем, что реакцию можно проводить в воде с солью аминокислоты:
Реакцию N-защищенных аминокислот с О-защищенными можно осуществлять непосредственно в присутствии, например, карбодиимидов:
Снятие третбутилокси- или бензилоксикарбонильной группы осуществляют в мягких условиях — гидролизом в присутствии CF3COOH. Тритильную защиту снимают гидрированием.
Твердофазный синтез пептидов (метод Мерифильда). Наращивание пептидной цепочки осуществляют на поверхности полимера, содержащего активные группы: СН2С1, СН2ОН. N-Защищенная аминокислота «привязывается» к нему сложноэфирной связью. Следуют отщепление защитной группы, образование пептидной связи с другой молекулой N-защищенной аминокислоты, отщепление защитной группы и т. д. После наращивания цепи достаточной длины полипептид отщепляют от носителя действием смеси НВг + CF3COOH.
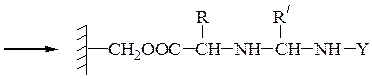
Пример 1:синтез дипептида Н-Ala-Gly-ОН
1-й этап — защита аминогруппы a-аланина ацилированием карбобенз-оксихлоридом:
2-й этап — активирование карбоксильной группы N-защищенного a-
аланина переводом его в п-нитрофениловый эфир:
3-й этап — блокирование карбоксильной группы глицина переводом ее в метиловый эфир:
4-й этап — синтез защищенного по обоим концам дипептида взаимодействием n-нитрофенилового эфира N-карбобензокси-a-аланина с этиловым эфиром глицина:
5-й этап — снятие защит (например, гидролизом в относительно мягких условиях, не допускающих разрушения пептидной связи).
Пример 3: Н-Leu-Gly-Ala-ОН (твердофазный синтез Меррифильда)
Для этого используют полимерный носитель, получаемый обработкой полистирола метил(хлорметиловым) эфиром:
1-й этап — получение ВОС- защищенного аланина:
2-й этап — «привязывание» ВОС-аланина к хлорметилированному полистиролу:
3-й этап — промывание водой и удаление защитной группы:
4-й этап — промывание водой и добавление ВОС-глицина (см. 1-й этап):
5-й этап — промывание водой и снятие защитной группы:
6-й этап — промывание водой и добавление ВОС-лейцина (см. 1-й этап:)
7-й этап — удаление ВОС-группы, промывание водой и снятие пептида с полимера:
Уровни структурной организации белков.По предложению К.У.Линдерстрема-Ланга, различают четыре уровня организации белковых молекул – первичную, вторичную, третичную и четвертичную структуры. Последовательность аминокислотных остатков в полипептидной цепи называется первичной структурой. Ее мы рассмотрели в курсе классической органической химии. Термин «вторичная структура» относится к типу укладки полипептидных цепей. Наиболее часто встречающиеся типы – правая α-спираль и β-складчатая структура за счет образования водородных связей и прочих взаимодействий (см. рис.10, с. 309). Под третичной структурой белка понимается расположение белковой полипептидной цепи в пространстве. Термин «четвертичная структура» относится к белкам, в состав которых входит несколько полипептидных цепей (субъединиц), не связанных между собой ковалентно; эта структура отражает характер взаимного расположения субъединиц в пространстве. Структуры, свойства и функции белков будут подробно рассмотрены в курсе биохимии.
Контрольные вопросы к главе 18 «Аминокислоты и белки»
№ 1Составьте схемы синтеза валина и b-фенил-α-аланина при помощи следующих методов: (а) из кетокислот восстановительным аминированием; (б)
Рис. 10. Вторичная структура белка: α-спираль (а), b-складчатая структура (б)
методом Штреккера; (в) используя реакцию фталимида калия с бром-алкилмалоновым эфиром; (г) алкилированием аминомалонового эфира;
№ 2.Какую надо выбрать стратегию, чтобы превратить глутаминовую кислоту в глутамин?
№ 3.Какой рН имеют водные растворы следующих соединений: (а) хлоргидрата этилового эфира валина; (б) глицина; (в) хлоргидрата аланина; (г) лизина; (д) аспарагиновой кислоты; (е) аспарагина. Что такое изоэлектрическая точка аминокислоты? Что такое электрофорез?
№ 4. Напишите уравнения реакций глицина со следующими реагентами: (а) хлористым бензоилом; (б) азотистой кислотой; (в) ангидридом трифторуксусной кислоты; (г) хлороводородом; (д) формальдегидом; (е) гидроксидом меди (II); (ж) метанолом (в присутствии HCI).
№ 5.Три изомерных аминокислоты А, Б и В с молекулярной формулой С5Н11O2N при нагревании превращаются в соединения А’, Б’ и В’. Вещество А’ – диизопропильное производное дикетопиперазина; образование продукта Б’ сопровождается выделением газа; озонолиз Б’ дает глиоксалевую кислоту и пропаналь. Вещество В’ представляет собой γ-лактам (γ-метилпирролидон).
Каково строение аминокислот А, Б и В?:
№ 6.Как различить валин и N-метилвалин?
№ 7.Напишите структурную формулу антибиотика грамицидина С, имеющего макроциклическое полипептидное строение:
Val — Orn — Leu — Phe — Pro
Pro — Phe — Leu — Orn — Val Какие вещества и в каком соотношении
образуются в результате полного гидролиза (24 ч., 2 н НСl, 100 0 C)?
№ 8.Какие Вы знаете уровни организации белков?
№ 9.Какие методы защиты амино- и карбоксильных групп Вы знаете? Используя их, синтезируйтедипептид: H-Val-Glу-OH
№ 10. Какие качественные реакции (биуретовую, ксантопротеиновую, Фоля, Милона, Эрлиха) дает пентапептид: H–Ala–Pro–Val–Tyr–Gly–OH ? Напишите структурную формулу пентапептида.
ЛИТЕРАТУРА
1. Петров А.А., Бальян Х.В., Трощенко А.Т. Органическая химия. – СПб.:
Иван Федоров, 2002.
2. Ким А.М. Органическая химия. – Новосибирск: Сибирское
университетское изд-во, 2001.
3. Травень В.Ф. Органическая химия: в 2 т. – М.: Академкнига, 2005.
4. Шабаров Ю.С. Органическая химия. – М.: Химия, 1999.
5. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии: в 2 т. – М.:
6. Моррисон Р., Бойд Р. Органическая химия. – М.: Мир, 1974.
7. Робертс Д., Касерио М. Основы органической химии: в 2 т. – М.: Мир, 1968.
8. Сайкс П. Механизмы органических реакций. – М.: Химия, 1991
9. Овчинников Ю.А. Биоорганическая химия. – М.: Просвещение, 1987.
10. Янковский С.А., Данилова Н.С. Задачи по органической химии. – М.:
СОДЕРЖАНИЕ
1. Предельные углеводороды. Алканы и циклоалканы ………………… ..5
3. Диеновые углеводороды………………………………………………… 38
5. Арены (ароматические углеводороды)…………………………………. 55
6. Галогенопроизводные углеводородов…………………………………..77
7. Магнийорганический синтез………………………………………… ..101
12. Карбоновые кислоты и их производные………………………………162
15. Органические соединения азота………………………………………..216
16. Органические соединения серы………………………………………. 233
18. Аминокислоты и пептиды………………………………………………286
ОТВЕТЫ НА КОНТРОЛЬНЫЕ ЗАДАНИЯ
1
№ 3. (а) При сгорании 14,4 г алкана образовалось 22,4 л СО2. Какой объем кислорода (л, н.у.) потребуется? (б)Для сжигания 5 л нормального алкана потребовалось 40 л кислорода (н.у.). Установите, какой углеводород сожгли. (в)При сгорании 11,2 л смеси метана и этана получено 13,44 л. (н.у.) СО2. Рассчитайте объемную долю (%) метана в исходной смеси. (г) Газ, образовавшийся при полном сгорании 0,02 моль алкана, пропустили через избыток известковой воды; при этом выпало 12 г осадка. Определите молекулярную формулу алкана.
№ 4.(а)Выведитемолекулярную формулу алкана, если при хлорировании 1,28 г его на свету было получено 6,84 г дихлорпроизводного. (в) Определите молекулярную формулу бромпроизводного пропана, в 4,04 г которого содержится 3,2 г брома.
№ 6. Углеводороды н-гексан и гексен-3 имеют близкие температуры кипения. Как очистить химическим путем: а) н-гексан от примеси гексена-3; б) гексен-3 от примеси н-гексана?
№ 10. Предложите схемы синтеза: (в)гексадиена-2,4 из аллилового спирта.
№ 1. Почему в случае присоединения хлороводорода к бутадиену-1,3 образуется смесь 3-хлорбутена-1 и 1-хлорбутена-2, в которой преобладает второе из названных соединений.
№ 2. При 1,4-присоединении хлороводорода к 2-метилбутадиену-1,3 (изопрену) в качестве основного продукта образуется 1-хлор-3-метилбутен-2, а не 1-хлор-2-метилбутен-2. Почему ?
№ 3. Какой из диенов – бутадиен-1,3 , изопрен (2-метилбутадиен-1,3) или пиперилен (пентадиен-1,3) при взаимодействии с 1 моль бромоводорода при 25 0 С дает только один продукт?
№ 5. При термической полимеризации бутадиена-1,3 в качестве побочного продукта образуется циклический димер, не склонный к дальнейшей полимеризации. Это вещество при гидрировании дает этилциклогексан; способно присоединять 2 моль брома; в результате деструктивного окисления образует 3-карбоксигександиовую кислоту. Какое строение имеет молекула димера бутадиена-1,3?
№ 7. Из каких реагентов можно получить следующие соединения по реакции Дильса—Альдера: 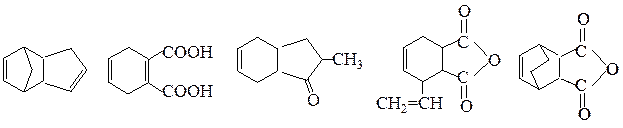
№ 3. Напишите схемы синтеза следующих соединений, используя неорганические реагенты: (а) бутанона-2 из 1-бромбутана; (б) акрилонитрила из 1,2-дибромэтана; (в) мезитилена (1,3,5-триметилбензола) из пропанола-1; (г) 1,1,2,2,3,4-гексабромбутана из ацетилена; (д) поливинилацетата из ацетилена.
№ 6. Расположите ароматические соединения в ряд по уменьшению реакционной способности в реакциях SE и укажите продукты реакций:
(а) нитрования бензойной кислоты, о-сульфобензойной кислоты, фенола, резорцина; (б) ацилирования хлористым пропионилом бензола, п-крезола, толуола, нитробензола; (в) сульфирования фенола, гидрохинона, нитробензола, п-нитротолуола; (г) бромирования бензола, м-ксилола, м-динитробензола, п-нитроизопропилбензола, м-толуидина.
№ 7. Для каждого из соединений укажите, какое кольцо будет затрагиваться при нитровании и приведите структурные формулы основных продуктов реакции:
6.
№ 7.Из ацетилена получите: (а) 2,3-дибромбутан; (б) 1,2-дибромбутен-2;
№ 3.Предложите схемы синтеза спиртов, используя химические свойства реактивов Гриньяра: (а) метилдиэтилкарбинола из этанола; (б) метилдиэтил-карбинола из этанола; (в) 3,3-диметилбутанола-1 из изобутилена и этилена; (г) диметилизопропилкарбинола из пропилена.
№ 4.Предложите схему синтеза кислот, используя химические свойства реактивов Гриньяра: (а) циклопентанкарбоновой кислоты из циклопентана; (б) 2-метилбутановой кислоты из бутена-1; (в) п-толуиловой кислоты из толуола; (г) 1-нафтилуксусной кислоты из нафталина.
№ 5.Предложите схемы синтеза соединений, меченых радиоактивными изотопами: (а) изомасляной (1- 14 С) кислоты (СН3)2СН 14 СООН из пропилена и Са 14 СО3; (б) дейтеротолуола С6H5CH2D из толуола и тяжелой воды; (в); 3-дейтеропропилена-1 CH2=CH-CH2D из хлористого аллила и D2O; (г) гексадейтеробензола из ацетилена и тяжелой воды.
№ 4. Какие продукты образуются при раскрытии эпоксидного цикла окиси изобутилена при действии метилатом натрия и метанола в кислой среде?
Глава 1. № 1.17; № 2. этан; № 4 (б) С3H7Br; № 7. 10; № 8.бромирование, затем р. Вюрца;№ 9. 2,2-диметилпропан (А), пентан (Б), 2-метилбутан (В); № 10. (а)2,2,3,3-тетраметилбутан; (б) 2,5-диметилгексан; (в) 3,4-диметилгексан.
Глава 2. № 1.84 %;№ 5.ClCH2-CH2Cl (A), CH2=CHCl (Б), СlCH2-CHCl2 (B), СlCH=CHCl (Г); Cl2CH-CHCl2 (Д); ClCH=CCl2 (Е); Cl2CH-СCl3 (Ж); Cl2C=CCl2 (З);№ 9. (а)2-метилбутан; (б)пентен-2;(в)пентадиен-1,4;(г)2-метилбутен-2; (г) циклогексадиен-1,3; № 10. (а)присоединяют, а затем отщепляют хлороводород; (б)дегидратация гексанола-1 в гексена-1, затем бромирование с последующим дегидробромированием действием водно-спиртовым раствором KOH;(г)аллильное хлорирование пропилена, затем р. Вюрца;(д)внутримолекулярная дегидратация спирта, затем бромирование алкена по Волю-Циглеру.
Глава 4. № 4. (а)4-метилгексин-1; (б)5-метилгексин-1;(в)гексин-3;(г)4-метилпентин-1;(д)винилацетилен;№ 5. (а)бромной водой; (б), (г) и (д)аммиакатом серебра;(в)малеиновым ангидридом.
Глава 5. № 1.(I), (II), (IV), (V), (VI);№ 5.толуол, этилбензол, изопропилбензол, третбутилбензол;№ 9. (а)алкилированием бензола изобутиленом получают третбутилбензол и обрабатывают нитрующей смесью; (б)бензол алкилируют пропиленом до изопропил-бензола и нитруют по Коновалову; (в)толуол окисляют в бензойную кислоту, которую нитруют;(г)изопропилбензол хлорируют в прис. AlCl3 продукт окисляют;(д)хлорируют на свету, затем р. Вюрца;(е)циклотримеризация ацетилена, нитрование, бромирование;(ж)нафталин нитруют, затем окисляют; № 10. (а)1-метил-3-этилбензол;(б)п-нитроэтилбензол;(в)винилбензол (г) фенилацетилен; (д) 1,3,5-триметилбензол; (е) 4-нитро-1-бромнафталин.
Глава 6. № 3.подвижность брома уменьшается в ряду: 4-бром-2-метилбутен-2, 5-бром-2-метилпентан, 3-бром-2-метилпентен-2; № 4.(а) 1,1-гексаналь; (б) октанон-2; (в) пентан-диол-2,3; (г) п-хлорбензойная кислота; (д) бутен-2-ол-1 и бутен-3-ол-2; (е) 3-метилцикло-пентанол-1; № 7. (в) гидратация ацетилена дает ацетальдегид, а его восстановление — этанол; cпирт превращают в бутадиен по Лебедеву и бромируют; (г) продукт димеризации ацетилена — винилацетилен обрабатывают избытком хлора.
Глава 7. № 1.йодистый метил,бромистый этил, хлористый бутил, бромистый винил, йодбензол, хлорбензол; № 6. изопропилмагнийгалогенид; № 7. CH3(CH2)2CH(C2H5)-MgBr; № 8. этилмагнийгалогенид
Глава 8. № 1.
Глава 9. № 1. примесь алкена удаляют из простого эфира промыванием серной кислотой; уменьшить выход продукта межмолекулярной реакции (простого эфира) можно разбавлением реакционной массы растворителем; при этом увеличивается выход продукта внутримолекулярной реакции (алкена); № 3. взаимодействие изопропилата натрия с йодистым метилом дает выше выход простого эфира, т.к. не будет примеси алкена jn дегидрогалогенирования галогеналкана под действием основания (алкоголята); № 4. получают этилен и далее окись этилена, которую гипохлорируют и полученный 2-хлорэтанол подвергают дегидратации; № 6. (а)этилизопентиловый эфир;(б)п-СH3O-С6Н4-СН=СН-СН3 и п-СH3O-С6Н4-СН2-СН=СН2.
Глава 10. № 2. (а) гипохлорируют, обрабатывают сульфидом натрия;(б)этанол реагирует с окисью этилена (2:1); (в)фенол реагирует с окисью этилена (1:2);(г)реакцией окиси этилена с этанолом;(д)с NH3 (1:1) получают этаноламин, в котором ОН замещают на хлор (PСl5), а затем на меркаптогруппу (NaHS).
Глава 11. № 2.(а) метилглиоксаля; (б) трихлоруксусного альдегида; № 3. кеталь из диэтилкетона и метанола; ацеталь из изомасляного альдегида и этиленгликоля; кеталь из пентаэритрита С(СН2ОН)4 и циклопентанона; все вещества гидролизуются до исходных в присутствии кислот, но устойчивы в нейтральной и щелочной средах; № 4.альдегиды, но не кетоны вступают в реакции окисления (с аммиакатом серебра, жидкостью Фелинга), Канниццаро, Тищенко, с фуксинсернистой кислотой; со слабыми нуклеофилами (водой, спиртами) и димедоном обычно реагируют только альдегиды и лишь самые активные кетоны; № 5. валериановый альдегид отличают от кетонов реакциями с аммиакатом серебра и жидкостью Фелинга, а метилпропилкетон от диэтилкетона — йодоформной реакцией; № 7. реакция Канниццаро; № 9. (а)этанол окисляют в уксусную кислоту, получают кальциевую соль и подвергают ее пиролизу; (б)действием PCl5 получают 2,2-дихлорпентан и дегидрохлорируют и спиртовым раствором КОН; (в), (г)бутен-2 окисляют по Вагнеру в бутандиол-2,3 и далее в бутандион-2,3, затем действуют избытком гидроксиламина; (д) восстанавливают продукт альдольной конденсации бутаналя; № 10. (а) 3-метилбутаналь; (б)м-этилбензальдегид;(в)коричный альдегид;(г)метилфенилкетон;(д)п-толуиловый альдегид.
№ 1. Напишите уравнения реакций нуклеофильного присоединения по карбонильной группе. Какое из соединений будет более активно в реакциях AN и почему: (а) формальдегид, уксусный альдегид, ацетон; (б) пропионовый альдегид, a-хлорпропионовый альдегид, ацетон, хлораль С13С-СНО; (в) альдегиды ароматического ряда общей формулы
(где Х=Н, NO2, CH3)? В чем суть кислотного катализа в этих реакциях?
№ 9.пентина-2 из пентанона-2; (в) 1,6-дихлоргексана из циклогексена;
📸 Видео
Азотная кислота. Химические свойства. Реакции с НЕметаллами.Скачать

Реакция меди с азотной кислотой. Химический опытСкачать

Серебро + азотная кислота .Скачать

Реакции металлов с азотной кислотой. Химический опытСкачать

Взаимодействие металлов с кислотами. 8 класс.Скачать

Получение НИТРОЦЕЛЛЮЛОЗЫ. Реакция целлюлозы (ваты) азотной и серной кислот. Опыты по химии.Скачать

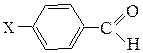
Задача 34 ЕГЭ химия/НИТРО/ДИПЕПТИДЫ/ПОДБОР СТРУКТУРНЫХ ФОРМУЛСкачать

Аминокислоты. Получение. Все 6 реакций ЕГЭ.Скачать

Химические свойства алканов. 1 часть. 10 класс.Скачать

Бензол. Механизм реакции электрофильного замещения. Нитрование бензола.Скачать

Пассивация железа азотной кислотойСкачать

Нитрование алкановСкачать

59. НитросоединенияСкачать

Реакция нейтрализации. Урок 26. Химия 7 класс.Скачать

азотный кислота чуть не взорвалась до конца смотрите химия реакция лабораторияСкачать

Опыты по химии. Аминокислоты: агрегатное состояние; отношение к воде; отношение к индикаторуСкачать

Химия | Тепловой эффект химической реакции (энтальпия)Скачать

АМИНОКИСЛОТЫ 3.2: ТИРОЗИН (КАТЕХОЛАМИНЫ, МЕЛАНИНЫ, ТИРЕОИДЫ); БИОГЕННЫЕ АМИНЫСкачать