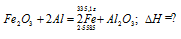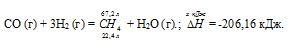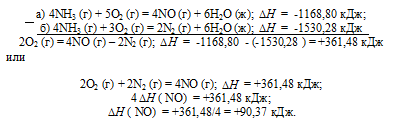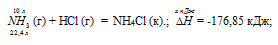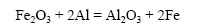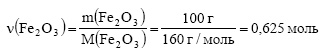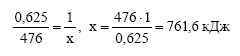- Количество теплоты
- Тепловой эффект реакции
- Tермохимическое уравнение реакции
- Теплота образования
- 2Al Fe2O3 = Al2O3 2Fe + 848 кДж рассчитайте, сколько выделится теплоты при вступлении в реакцию : а) 10, 8 г алюминия ?
- Сколько выделится теплоты при сгорании 17 кг аммиака Сколько литров кислорода (н?
- В реакцию, протекающую в соответствии с уравнением 2Al + 3S = Al2S3 + 509 кДж вступило 108гр алюминия?
- Для реакции алюминия с серой термохимическое уравнение реакции имеет вид : 2Al + 3S = Al2S3 + 509 кДж Какое количество теплоты выделится в реакции, для которых взяты 81 г алюминия и 128 г серы?
- При сжигании 1 моль этанола выделяется 1374 кДж теплоты?
- По термохимическому кравнению H2 + Br2 = 2HBr + 66?
- Вычислите тепловой эффект реакции образования оксида алюминия из простых веществ , если при окислении алюминия массой 27 грамм выделилось 838 кДж теплоты?
- Пожалуйста помогите 1?
- При сжигании 1 моль этанола выделяется 1374 кДж теплоты?
- Теплота сгорания угля равна 393?
- СРОЧНО По термохимическому уравнению реакции : 2Al + Fe2O3 = 2Fe + Al2O3 + 848 кДж рассчитайте , сколько выделится теплоты, если в реакцию вступило 0, 4 моль оксида железа (|||)?
- При восстановлении железа из 100 г оксида железа (III) алюминием выделилось 476,0 кДж. Определите тепловой эффект этой реакции.
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- 🎥 Видео
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Количество теплоты
Задание 81.
Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
Решение:
Уравнение реакции:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:



Вычисление количества теплоты, которое выделяется при получении 335,1 г железа, про-изводим из пропорции:
(2 . 55,85) : -847,7 = 335,1 : х; х = (0847,7 . 335,1)/ (2 . 55,85) = 2543,1 кДж,
где 55,85 атомная масс железа.
Ответ: 2543,1 кДж.
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Тепловой эффект реакции
Задание 82.
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж.
Решение:
Уравнение реакции имеет вид:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:




= -235,1 -[(52,28) + (-241,83)] = — 45,76 кДж
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Если в результате реакции выделяется теплота, то
Ответ: — 45,76 кДж.
Задание 83.
Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
Решение:
Уравнение реакции восстановления оксида железа (II) водородом имеет вид:
ЕеО (к) + Н2 (г) = Fe (к) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Теплота образования воды определяется уравнением
а теплоту образования оксида железа (II) можно вычислить, если из уравнения (б) вычесть уравнение (а).




Ответ: +27,99 кДж.
Задание 84.
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2 (г). Напишите термохимическое уравнение этой реакции, предварительно вычислите ее тепловой эффект. Ответ: +65,43 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:






Термохимическое уравнение будет иметь вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Ответ: +65,43 кДж.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Tермохимическое уравнение реакции
Задание 85.
Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — кое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
СО (г) + 3Н2 (г) = СН4 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:





Термохимическое уравнение будет иметь вид:
22,4 : -206,16 = 67,2 : х; х = 67,2 (-206,16)/22?4 = -618,48 кДж; Q = 618,48 кДж.
Ответ: 618,48 кДж.
Теплота образования
Задание 86.
Тепловой эффект какой реакции равен теплоте образования. Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
а) 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2O (ж); 
б) 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2O (ж); 
Ответ: 90,37 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование NO из простых веществ можно представить так:
Дана реакция (а), в которой образуется 4 моль NO и дана реакция (б), в которой образуется 2 моль N2. В обеих реакциях участвует кислород. Следовательно, для определения стандартной теплоты образования NO составим следующий цикл Гесса, т. е. нужно вычесть уравнение (а) из уравнения (б):
Таким образом, 1/2N2 + 1/2O2 = NO; 
Ответ: 618,48 кДж.
Задание 87.
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
NH3 (г) + НCl (г) = NH4Cl (к).; 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствиие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при реакции 10 л аммиака по этой реакции, определим из про-порции:
22,4 : -176,85 = 10 : х; х = 10 (-176,85)/22,4 = -78,97 кДж; Q = 78,97 кДж.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

2Al Fe2O3 = Al2O3 2Fe + 848 кДж рассчитайте, сколько выделится теплоты при вступлении в реакцию : а) 10, 8 г алюминия ?
Химия | 5 — 9 классы
2Al Fe2O3 = Al2O3 2Fe + 848 кДж рассчитайте, сколько выделится теплоты при вступлении в реакцию : а) 10, 8 г алюминия ;
2Al + Fe2O3 = Al2O3 + 2Fe + 848 кДжопределим количество вещества алюминия n(Al) = 10, 8 / 27 = 0, 4 моль Q = 848×0, 38 / 2 = 169, 6кДж.
Видео:Реакция алюминия с оксидом железа (III).Скачать

Сколько выделится теплоты при сгорании 17 кг аммиака Сколько литров кислорода (н?
Сколько выделится теплоты при сгорании 17 кг аммиака Сколько литров кислорода (н.
У. ) Вступает в реакци, если выделяется 764.
52 кДж теплоты Сколько литров азота (н.
У. ) Образуется , если выделятся 4587, 12 кДж теплоты.
Видео:Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

В реакцию, протекающую в соответствии с уравнением 2Al + 3S = Al2S3 + 509 кДж вступило 108гр алюминия?
В реакцию, протекающую в соответствии с уравнением 2Al + 3S = Al2S3 + 509 кДж вступило 108гр алюминия.
Вычислить количество выделившейся теплоты.
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Для реакции алюминия с серой термохимическое уравнение реакции имеет вид : 2Al + 3S = Al2S3 + 509 кДж Какое количество теплоты выделится в реакции, для которых взяты 81 г алюминия и 128 г серы?
Для реакции алюминия с серой термохимическое уравнение реакции имеет вид : 2Al + 3S = Al2S3 + 509 кДж Какое количество теплоты выделится в реакции, для которых взяты 81 г алюминия и 128 г серы.
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

При сжигании 1 моль этанола выделяется 1374 кДж теплоты?
При сжигании 1 моль этанола выделяется 1374 кДж теплоты.
Рассчитайте , сколько теплоты выделится при сжигании 115 г спирта.
Видео:Как решать ОРГАНИЧЕСКИЕ ЦЕПОЧКИ? Основные типы химических реакцийСкачать

По термохимическому кравнению H2 + Br2 = 2HBr + 66?
По термохимическому кравнению H2 + Br2 = 2HBr + 66.
8 кДЖ рассчитать массу брома, вступившего в реакцию, если при этом выделилось 3, 34 кДж теплоты.
Видео:Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Вычислите тепловой эффект реакции образования оксида алюминия из простых веществ , если при окислении алюминия массой 27 грамм выделилось 838 кДж теплоты?
Вычислите тепловой эффект реакции образования оксида алюминия из простых веществ , если при окислении алюминия массой 27 грамм выделилось 838 кДж теплоты.
Видео:Расчеты по уравнениям химических реакций. 1 часть. 8 класс.Скачать

Пожалуйста помогите 1?
Пожалуйста помогите 1.
Определите массовые доли всех элементов в соединении AgNO3 2.
Тепловой эффект реакции взаимодействие алюминия и серы с образованием сульфида алюминия (AL2S3 ) составляет 509 КДж.
Рассчитаете какое количество теплоты выделится , если в реакцию вступит 270г алюминия.
Видео:ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

При сжигании 1 моль этанола выделяется 1374 кДж теплоты?
При сжигании 1 моль этанола выделяется 1374 кДж теплоты.
Рассчитайте сколько теплоты выделится при сжигании 115 г спирта.
Видео:Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

Теплота сгорания угля равна 393?
Теплота сгорания угля равна 393.
Напишите термохимическое уравнение реакции.
Рассчитайте кол — во теплоты, которое выделится при сгорании 1 кг угля.
Какой объём углекислого газа образовался, если при сгорании угля выделилось 157.
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

СРОЧНО По термохимическому уравнению реакции : 2Al + Fe2O3 = 2Fe + Al2O3 + 848 кДж рассчитайте , сколько выделится теплоты, если в реакцию вступило 0, 4 моль оксида железа (|||)?
СРОЧНО По термохимическому уравнению реакции : 2Al + Fe2O3 = 2Fe + Al2O3 + 848 кДж рассчитайте , сколько выделится теплоты, если в реакцию вступило 0, 4 моль оксида железа (|||).
На этой странице вы найдете ответ на вопрос 2Al Fe2O3 = Al2O3 2Fe + 848 кДж рассчитайте, сколько выделится теплоты при вступлении в реакцию : а) 10, 8 г алюминия ?. Вопрос соответствует категории Химия и уровню подготовки учащихся 5 — 9 классов классов. Если ответ полностью не удовлетворяет критериям поиска, ниже можно ознакомиться с вариантами ответов других посетителей страницы или обсудить с ними интересующую тему. Здесь также можно воспользоваться «умным поиском», который покажет аналогичные вопросы в этой категории. Если ни один из предложенных ответов не подходит, попробуйте самостоятельно сформулировать вопрос иначе, нажав кнопку вверху страницы.
Видео:Решение цепочек превращений по химииСкачать

При восстановлении железа из 100 г оксида железа (III) алюминием выделилось 476,0 кДж. Определите тепловой эффект этой реакции.
Решение:
Вычислим молярную массу оксида железа (III):
Вычислим количество вещества оксида железа (III):
Тепловой эффект реакции равен количеству тепла, выделяющегося при восстановлении 1 моль оксида железа (III). При восстановлении 0,625 моль оксида железа (III) выделилось 476 кДж тепла. Пусть при восстановлении 1 моль оксида железа (III) выделится х кДж тепла. Составим пропорцию:
Ответ: тепловой эффект реакции равен 761,6 кДж.

задача №2
к главе «Глава IV. Химические реакции».
Видео:78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Please wait.
Видео:Реакции металлов с кислородом и водой. 8 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Расстановка Коэффициентов в Химических Реакциях // Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70645c14882f9739 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
🎥 Видео
ОКСИДЫ, КИСЛОТЫ, СОЛИ И ОСНОВАНИЯ ХИМИЯ 8 класс / Подготовка к ЕГЭ по Химии - INTENSIVСкачать