NH4NO3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
Полное ионное уравнение
NH4 + + NO3 — + HOH ⇄ NH4OH + H + + NO3 —
Сокращенное (краткое) ионное уравнение
NH4 + + HOH ⇄ NH4OH + H +
- Среда и pH раствора нитрата аммония
- Напишите уравнения гидролиза нитрата аммония в молекулярной и ионной формах?
- Напишите уравнения реакций гидролиза пропионата аммония и ацетата бария в ионной и молекулярной формах?
- Напишите уравнение реакций (в молекулярной и ионной формах) между растворами веществ : сульфат аммония и хлорид бария ; хлорид аммония и нитрат серебра?
- Написать уравнения реакций гидролиза нитрата алюминия в сокращенной ионной, ионной и молекулярных формах?
- Напишите уравнение реакции раствора иодида аммония с раствором нитрата свинца(в молекулярной и ионной формах)?
- Определить, какие из солей подвергаются в растворах гидролизу?
- Напишите молекулярные и ионные уравнения гидролиза солей : сульфата хрома и нитрата калия?
- Напишите уравнение в молекулярном, полное ионное и сокращенное уравнение гидролиза хлорида никеля, нитрата натрия, сульфит лития?
- 236. Напишите молекулярные и ионные уравнения гидролиза солей : а) йодида аммония?
- Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах?
- В трех пронумерованных проирках находится растворы хлорида аммония, нитрата аммония , карбоната натрия ?
- Гидролиз нитрата аммония (nh4no3), уравнения и примеры
- Физические свойства
- Растворимость
- Состав
- Методы получения
- Основной метод
- Метод Габера
- Нитрофосфатный метод
- Кристаллические состояния нитрата аммония
- Взрывчатые вещества
- Дополнительная информация
- Нитрат аммония: свойства, получение, применение :
- Соли аммония. Нитраты — урок. Химия, 8–9 класс
- Уравнения реакций гидролиза солей азотной и азотистой кислот
- Реакция диспропорционирования азотистой кислоты
- Раствор аммиака – формула гидролиза, равновесие — Помощник для школьников Спринт-Олимпиады
- Общее описание
- Получение
- Свойства
- Что мы узнали?
- Гидролиз солей
- 🎥 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Среда и pH раствора нитрата аммония
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Напишите уравнения гидролиза нитрата аммония в молекулярной и ионной формах?
Химия | 10 — 11 классы
Напишите уравнения гидролиза нитрата аммония в молекулярной и ионной формах.
NH4NO3 + H2O = NH4OH + HNO3
NH4[ + ] + NO3[ — ] + H2O = NH3 + H2O + H[ + ] + NO3[ — ]
NH4[ + ] + H2O = NH3 + H3O + H[ + ]
Видео:Химия | Молекулярные и ионные уравненияСкачать

Напишите уравнения реакций гидролиза пропионата аммония и ацетата бария в ионной и молекулярной формах?
Напишите уравнения реакций гидролиза пропионата аммония и ацетата бария в ионной и молекулярной формах.
Очень срочно нужно!
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Напишите уравнение реакций (в молекулярной и ионной формах) между растворами веществ : сульфат аммония и хлорид бария ; хлорид аммония и нитрат серебра?
Напишите уравнение реакций (в молекулярной и ионной формах) между растворами веществ : сульфат аммония и хлорид бария ; хлорид аммония и нитрат серебра.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Написать уравнения реакций гидролиза нитрата алюминия в сокращенной ионной, ионной и молекулярных формах?
Написать уравнения реакций гидролиза нитрата алюминия в сокращенной ионной, ионной и молекулярных формах.
Видео:8 класс. Массовая доля растворенного вещества. Решение задач.Скачать

Напишите уравнение реакции раствора иодида аммония с раствором нитрата свинца(в молекулярной и ионной формах)?
Напишите уравнение реакции раствора иодида аммония с раствором нитрата свинца(в молекулярной и ионной формах).
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Определить, какие из солей подвергаются в растворах гидролизу?
Определить, какие из солей подвергаются в растворах гидролизу.
Напишите уравнения реакции гидролиза в молекулярном и ионном виде, укажите рН среды : 1.
Бромид аммония, нитрат натрия 2.
Карбонат калия, бромид бария.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Напишите молекулярные и ионные уравнения гидролиза солей : сульфата хрома и нитрата калия?
Напишите молекулярные и ионные уравнения гидролиза солей : сульфата хрома и нитрата калия.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Напишите уравнение в молекулярном, полное ионное и сокращенное уравнение гидролиза хлорида никеля, нитрата натрия, сульфит лития?
Напишите уравнение в молекулярном, полное ионное и сокращенное уравнение гидролиза хлорида никеля, нитрата натрия, сульфит лития.
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

236. Напишите молекулярные и ионные уравнения гидролиза солей : а) йодида аммония?
236. Напишите молекулярные и ионные уравнения гидролиза солей : а) йодида аммония.
Б) сульфата цинка.
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах?
Напишите уравнение реакции гидролиза соли k2s в молекулярной и ионной формах.
Видео:Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

В трех пронумерованных проирках находится растворы хлорида аммония, нитрата аммония , карбоната натрия ?
В трех пронумерованных проирках находится растворы хлорида аммония, нитрата аммония , карбоната натрия .
Предложите план распознавания .
Составить уравнения в молекулярной и ионной форме!
Вопрос Напишите уравнения гидролиза нитрата аммония в молекулярной и ионной формах?, расположенный на этой странице сайта, относится к категории Химия и соответствует программе для 10 — 11 классов. Если ответ не удовлетворяет в полной мере, найдите с помощью автоматического поиска похожие вопросы, из этой же категории, или сформулируйте вопрос по-своему. Для этого ключевые фразы введите в строку поиска, нажав на кнопку, расположенную вверху страницы. Воспользуйтесь также подсказками посетителей, оставившими комментарии под вопросом.
Смотри + это легко ты просто складываешь электроны и их сумма будет равна порядковому номеру элемента в таблице менделеева.
Это Натрий (2 + 8 + 1 = 11) Два полностью заполненных энергетических уровня. )2 и )8.
1) KNO2 + NH4(стрелка вверх) — — — > Kl + N2(стрелка вверх) + 2H2O 2)KMnO4 + KNO2 + H2O — — — > 2MnO2 + 3KNO3 + 2KOH.
Можно было и не переводить задачу с украинского языка на русский. Я тебе напишу решение на твоем языке. Якщо елемент знаходиться в шостій групі, то він має найвищу валентність шість. Тобто його найвищий оксид має загальну формулу ХО3. Якщо вся ре..
Видео:Как ЛЕГКО понять Химию с нуля — Массовая доля вещества // ХимияСкачать

Гидролиз нитрата аммония (nh4no3), уравнения и примеры
Нитрат аммония (аммонийная (аммиачная) селитра) — химическое соединение NH4NO3, соль азотной кислоты. Впервые получена Глаубером в 1659 году. Используется в качестве компонента взрывчатых веществ и как азотное удобрение.
Видео:Химия 9 класс — Как определять Степень Окисления?Скачать

Физические свойства
Кристаллическое вещество белого цвета. Температура плавления 169,6 °C, при нагреве выше этой температуры начинается постепенное разложение вещества, а при температуре 210 °C происходит полное разложение. Температура кипения при пониженном давлении — 235 °C. Молекулярная масса 80,04 а. е.м. Скорость детонации 2570 м/с.
Растворимость
Растворимость в воде:
| 119 | |
| 10 | 150 |
| 25 | 212 |
| 50 | 346 |
| 80 | 599 |
| 100 | 1024 |
При растворении происходит сильное поглощение тепла (аналогично нитрату калия), что значительно замедляет растворение. Поэтому для приготовления насыщенных растворов нитрата аммония применяется нагревание, при этом твёрдое вещество засыпается небольшими порциями.
Также соль растворима в аммиаке, пиридине, метаноле, этаноле.
Состав
Содержание элементов в нитрате аммония в массовых процентах:
Методы получения
Основной метод
В промышленном производстве используется безводный аммиак и концентрированная азотная кислота:
NH3 + HNO3 → NH4NO3↓
Реакция протекает бурно с выделением большого количества тепла. Проведение такого процесса в кустарных условиях крайне опасно (хотя в условиях большого разбавления водой нитрат аммония может быть легко получен).
После образования раствора, обычно с концентрацией 83 %, лишняя вода выпаривается до состояния расплава, в котором содержание нитрата аммония составляет 95—99,5 % в зависимости от сорта готового продукта. Для использования в качестве удобрения расплав гранулируется в распылительных аппаратах, сушится, охлаждается и покрывается составами для предотвращения слёживания.
Цвет гранул варьируется от белого до бесцветного. Нитрат аммония для применения в химии обычно обезвоживается, так как он очень гигроскопичен и процентное количество воды в нём получить практически невозможно.
Метод Габера
По способу Габера из азота и водорода синтезируется аммиак, часть которого окисляется до азотной кислоты и реагирует с аммиаком, в результате чего образуется нитрат аммония:
3H2 + N2 ⟶ 2NH3 при давлении, высокой температуре и катализатореNH3 + 2O2 ⟶ HNO3 + H2OHNO3 + NH3 ⟶ NH4NO3
Нитрофосфатный метод
Этот способ также известен как способ Одда, названный так в честь норвежского города, в котором был разработан этот процесс. Он применяется непосредственно для получения азотных и азотно-фосфорных удобрений из широко доступного природного сырья. При этом протекают следующие процессы:
- Природный фосфат кальция (апатит) растворяют в азотной кислоте:
- Ca3(PO4)2 + 6HNO3 ⟶ 2H3PO4 + 3Ca(NO3)2
- Полученную смесь охлаждают до 0 °C, при этом нитрат кальция кристаллизуется в виде тетрагидрата — Ca(NO3)2·4H2O, и его отделяют от фосфорной кислоты.
- На полученный нитрат кальция, не очищенный от фосфорной кислоты, действуют аммиаком, получая в итоге нитрат аммония:
- Ca(NO3)2 + 4H3PO4 + 8NH3 ⟶ CaHPO4↓ + 2NH4NO3 + 3(NH4)2HPO4
А также амфотерный метод.
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
- Температура ниже 200 °C:
- Температура выше 350 °C, или детонация:
- 2NH4NO3 ⟶ 2N2 + O2 + 4H2O
Кристаллические состояния нитрата аммония
Изменения кристаллического состояния нитрата аммония под воздействием температуры и давления меняют его физические свойства. Обычно различают следующие состояния:
| — | > 169.6 | жидкость | |
| I | 169.6 — 125.2 | кубическая | −2.13 |
| II | 125.5 — 84.2 | тетрагональная | −1.33 |
| III | 84.2 — 32.3 | α-ромбическая(моноклинная) | +0.8 |
| IV | 32.3 — −16.8 | β-ромбическая(бипирамидальная) | −3.3 |
| V | −50 — −16.8 | тетрагональная | +1.65 |
| VI | существует при высоких давлениях | ||
| VII | 170 | ||
| VIII | существует при высоких давлениях | ||
| IX | существует при высоких давлениях |
Фазовый переход от IV к III при 32,3 °C приносит неприятности производителям удобрений, потому как изменения плотности приводят к разрушению частиц при хранении и применении. Это особенно важно в тропических странах, где нитрат аммония испытывает циклические изменения, приводящие к разрушению гранул, слёживанию, повышенному пылению и риску возникновения взрыва.
Бо́льшая часть нитрата аммония используется либо непосредственно как хорошее азотное удобрение, либо как полупродукт для получения прочих удобрений.
Для предотвращения создания взрывчатых веществ на основе нитрата аммония в удобрения, доступные в широкой продаже, добавляют компоненты, снижающие взрывоопасность и детонационные свойства чистого нитрата аммония, такие как мел (карбонат кальция).
В Австралии, Китае, Афганистане, Ирландии и некоторых других странах свободная продажа нитрата аммония даже в виде удобрений запрещена или ограничена. После террористического акта в Оклахома-Сити ограничения на продажу и хранение нитрата аммония были введены в некоторых штатах США.
Взрывчатые вещества
Наиболее широко в промышленности и горном деле применяются смеси аммиачной селитры с различными видами углеводородных горючих материалов, других взрывчатых веществ, а также многокомпонентные смеси:
- составы типа аммиачная селитра/дизельное топливо (АСДТ)
- жидкая смесь аммиачная селитра/гидразин (Астролит)
- водонаполненные промышленные взрывчатые вещества (Акванал, Акванит и др.)
- смеси с другими взрывчатыми веществами (Аммонит, Детонит и др.)
- смесь с алюминиевой пудрой (аммонал)
Аммиачная селитра отличается большой гигроскопичностью, поэтому в качестве взрывчатого вещества не используется, так как в сыром виде взрывчатые свойства утрачиваются.
В 2013 г. сотрудники Sandia National Laboratories объявили о разработке безопасного и эффективного состава на основе смеси нитрата аммония с сульфатом железа, который не может быть использован для создания на его основе взрывчатых веществ.
При разложении состава ион SO42− связывается с ионом аммония, а ион железа — с нитрат-ионом, что предотвращает взрыв. Введение в состав удобрения сульфата железа может улучшить и технологические характеристики удобрения, особенно на закисленных почвах.
Авторы отказались от защиты формулы удобрения патентом с тем, чтобы этот состав мог получить быстрое распространение в регионах с высокой террористической опасностью.
Дополнительная информация
Мировое производство аммиачной селитры на 1980 год составляло 14 млн т, в пересчёте на азот.
Видео:Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Нитрат аммония: свойства, получение, применение :
Введение

Определение
Нитрат аммония (формула NH4NO3) является аммонийной солью азотной кислоты. Другие его названия — аммонийная или аммиачная селитра.
Свойства
Имеет вид белого кристаллического вещества. При температуре выше 170 оС нитрат аммония постепенно разлагается. Если же tо условий достигнет отметки 210 оС, то это приведет к полному разложению данного вещества.
Нитрат аммония очень хорошо растворяется водой, при повышении температуры последней показатель растворимости увеличивается.
Но, так как реакция эндотермическая (проходит с поглощением тепла), то его водные растворы нужно готовить в условиях с высокой температурой.

- Получение
- Из-за широкого использования в промышленности люди найчились добывать аммиачную селитру разными способами:
- Взаимодействие безводного аммиака с концентрированной серной кислотой. Реакция экзотермическая, т. е. во время ее протекания выделяется очень много тепла. Поэтому проводить ее в кустарных условиях нежелательно, если не хотите травмироваться. Впрочем, если оба реагента разбавить водой, то аммонийная селитра достаточно легко получается. Тогда образуется расплав, где ее концентрация составляет 83%. Лишнюю воду можно легко выпарить, после этого процентное содержание нитрата аммония составит 95-99,5%. Такой большой промежуток обусловлен разными сортами получившейся аммиачной селитры.
- Способ Габера. Обсуждаемое вещество может быть получено и по методу Габера. Ход реакций можно кратко описать по такой схеме:
водород+азот —> аммиак+кислород —> азотная кислота+аммиак —> нитрат аммония.
- Способ Одда. Благодаря этому методу аммиачную селитру получают из природного сырья. Чаще всего для этого используют минерал апатит (фосфат кальция). Второй реагент — разбавленная азотная кислота.
Применение
Без использования аммиачной селитры (из-за ее взрывчатых свойств) не обходится горное дело. Также с ее участием проходит изготовление азотных удобрений, в которые, чтобы избежать детонации нитрата аммония, добавляют мел или другие вещества, помогающие его нейтрализовать.
Заключение
Аммонийная селитра может быть как другом, так и врагом для человека, все зависит от цели ее использования. С ней нужно крайне аккуратно обращаться, особенно в условиях с высокой температуры.
Видео:Химия | ГидролизСкачать

Соли аммония. Нитраты — урок. Химия, 8–9 класс
Соли аммония — сложные вещества, образованные катионом аммония NH4+ и кислотным остатком.
NH4Cl — хлорид аммония, (NH4)2SO4 — сульфат аммония, NH4NO3 — нитрат аммония.
Соли аммония по свойствам похожи на соли натрия или калия. Они имеют ионное строение и представляют собой твёрдые белые вещества, хорошо растворяющиеся в воде.
- Нитрат аммония
- Образуются соли аммония при взаимодействии аммиака с кислотами:
- NH3+HCl=NH4Cl,
- 2NH3+H2SO4=(NH4)2SO4.
- Солям аммония характерны как общие для всех солей свойства, так и особые.
- К общим свойствам солей можно отнести способность вступать в реакции обмена с кислотами и другими солями, если образуется газ или осадок:
- (NH4)2SO4+BaCl2=BaSO4↓+2NH4Cl.
- Особые свойства солей обусловлены неустойчивостью иона аммония и его способностью разлагаться с образованием аммиака:
- 1. Соли аммония разлагаются при нагревании:
- NH4Cl=NH3↑+HCl↑.
- 2. Соли аммония при нагревании реагируют со щелочами с выделением аммиака:
- NH4Cl+NaOH=NH3↑+H2O+NaCl.
Применяются соли аммония в качестве удобрений. Карбонат аммония используется кондитерами как разрыхлитель теста. Хлорид аммония находит применение при паянии для очистки поверхности металла.
Нитраты — соли азотной кислоты.
NaNO3 — нитрат натрия, Cu(NO3)2 — нитрат меди((II)), NH4NO3 — нитрат аммония. Нитраты щелочных металлов, кальция и аммония называют ещё селитрами: Ca(NO3)2 — кальциевая селитра, NH4NO3 — аммиачная селитра.
Все соли азотной кислоты хорошо растворяются в воде. При нагревании они разлагаются с выделением кислорода, поэтому взрывоопасны.
Используются нитраты в качестве удобрений, а также для изготовления взрывчатых смесей. Нитрат серебра используется в медицине в качестве прижигающего средства.
Видео:Реакции ионного обмена. 9 класс.Скачать

Уравнения реакций гидролиза солей азотной и азотистой кислот
Задача 901.
Какова реакция среды в растворах NaNO3, NH4NO3, NaNO2, NH4NO2? Какие из перечисленных солей взаимодействуют в подкисленном серной кислотой растворе: а) с йодидом калия; б) с перманганатом калия? Написать уравнения протекающих реакций.Решение:I Гидролиз солей.а) NaNO3 – соль сильного основания и сильной кислоты в водных растворах не гидролизуется поэтому реакция среды нейтральная, рН = 7.
- б) NH4NO3 – соль сильной кислоты и слабого основания, гидролизуется по катиону, так как ион NH4+ с ионом ОН– с образованием слабого электролита:
- NH4NO3 ↔ NH4+ + OH–;
- NH4+ + H2O ↔ NH4OH + H+.
- Образовавшийся избыток ионов Н+ придаёт раствору кислую среду, рН 7.
- г) NH4NO2 – соль слабого основания и слабой кислоты, поэтому гидролизуется как по катиону, так и по аниону, потому что ионы NH4+ связываются с ионами ОН– с образованием слабого электролита NH4OH, а ионы NO2– связываются с ионами Н+ с образованием слабого электролита НNO2:
- NH4NO2 ↔ NH4+ + NO2–;
- NH4+ + H2O ↔ NH4OH + H+;
NO2– + Н2О ? НNO2 + ОН–.
Образовавшиеся в избытке ионы Н+ и ОН– связываются с друг с другом с образованием Н2О, что придаёт раствору нейтральную среду, рН = 7. Но фактически гидролиз данной соли протекает не равномерно, наблюдается избыток ионов Н+, рН Читайте также: Формула напряжения электрического поля
Сильно разбавленная азотная кислота взаимодействует с активными металлами — цинком, магнием, алюминием – с образованием иона аммония NH4+, дающего с кислотой нитрат аммония NH4NO3. При действии азотной кислоты на металлы водород не выделяется.
- При окислении неметаллов концентрированная азотная кислота, как и в случае с металлами, восстанавливается до NO2.
- Более разбавленная азотная кислота обычно восстанавливается до NO.
- Уравнения реакций азотной кислоты с металлами и неметаллами:
- а) 4Zn + 10HNO3(конц.) ↔ 4Zn(NO3)2 + N2O↑+ 5H2O;
- 5Zn + 12HNO3(разб.) ↔ 5Zn(NO3)2 + N2↑ + 6H2O;
4Zn + 10HNO3(очень разб.) ↔ 4Zn(NO3)2 + NH4NO3 + 3H2O.
б) Hg + 4HNO3(конц.) ↔ Hg(NO3)2 + 2NO2↑ + 2H2O;
3Hg + 8HNO3(разб.) ↔ 3Hg(NO3)2 + 2NO↑+ 4H2O;
4Hg + 10HNO3(очень разб.) ↔ 4Hg(NO3)2 + N2O + 5H2O.
в) 4Mg + 10HNO3(конц.) ↔ 4Mg(NO3)2 + N2O↑+ 5H2O;
5Mg + 12HNO3(разб.) ↔ 5Mg(NO3)2 + N2↑ + 6H2O;
4Mg + 10HNO3(очень разб.) ↔ 4Mg(NO3)2 + NH4NO3 + 3H2O.
г) Cu + 4HNO3(конц.) ↔ Cu(NO3)2 + 2NO2↑ + 2H2O;
3Cu + 8HNO3(разб.) ↔ 3Cu(NO3)2 + 2NO↑ + 4H2O;
4Cu + 10HNO3(очень разб.) ↔ 4Cu(NO3)2 + N2O + 5H2O.
д) S + 6HNO3(конц.) ↔ H2SO4 + 6NO2↑ + 2H2O;
S + 2HNO3(разб.) ↔ H2SO4 + 2NO↑.
e) C + 4HNO3(конц.) ↔ CO2↑+ 4NO2↑ + 2H2O;
3C + 4HNO3(разб.) ↔ 3CO2↑ + 4NO↑ + 2H2O.
ж) I2 + 2HNO3(конц.) ↔ 2HIO + 2NO2↑;
3I2 + 2HNO3(разб.) + 2H2O ↔ 6HIO + 2NO↑.
Реакция диспропорционирования азотистой кислоты
Задача 903. Написать уравнение реакции диспропорционирования НNO2.Решение:Формула азотистой кислоты имеет вид: HNO2. Азот в азотистой кислоте находится в своей промежуточной степени окисления +3, т. е. из возможных значений для азота.
Поэтому HNO2 проявляет окислительно-восстановительную двойственность, для неё характерно внутримолекулярное самоокисление-самовосстановление. В определённых условиях азотистая кислота претерпевает процесс, в ходе которого одна часть азота окисляется, а другая – восстанавливается. Этот процесс называется самоокислением-самовосстановлением.
Самоокислением-самовосстановлением называют также диспропорционированием. Так, в ходе термической диссоциации HNO2 образуются два оксида азота NO и NO2, в которых атомы азота проявляют соответственно степень окисления +2 и +4, т. е.
часть атомов азота окисляется, степень окисления атома возрастает от +3 до +4), а другая часть — восстанавливается, степень окисления атома уменьшается от +3 до +2:
Видео:Степень электролитической диссоциации. Сильные и слабые электролиты. 9 класс.Скачать

Раствор аммиака – формула гидролиза, равновесие — Помощник для школьников Спринт-Олимпиады
Нашатырный спирт – это раствор аммиака или гидроксид аммония. Вещество используется для медицинских и бытовых нужд. О химических свойствах аммиака, о его реакции с другими веществами – говорим ниже.
- Общее описание
- Получение
- Свойства
- Что мы узнали?
Общее описание
Формула раствор аммиака – NH4OH. Нашатырный спирт – гидрат или гидроксид аммиака. Поэтому более точная запись – NH3·H2O. Нашатырный спирт также называется аммиачной водой или едким аммиаком. Это бесцветная прозрачная жидкость с резким запахом.
Рис. 1. Раствор аммиака.
Аммиак отлично растворяется в воде. В одном объёме воды при комнатной температуре можно растворить 1200 объёмов аммиака. Концентрированный раствор обычно содержит 25 % NH3.
Раствор, используемый в медицине, содержит 10 % NH3.
При увеличении объёма воды и уменьшении количества аммиака плотность раствора увеличивается. Поэтому плотность 30 % раствора – 0,897 г/см3, плотность 5 % раствора – 0,978 г/см3.
При нагревании концентрированного раствора растворимость NH3 уменьшается, т.к. аммиак переходит в газообразное состояние.
Получение
Гидрат аммония можно получить двумя основными способами:
Реакция образования нашатырного спирта обратима, гидроксид аммония находится в равновесии с аммиаком. Именно поэтому нашатырный спирт имеет резкий аммиачный запах.
Свойства
Раствор обладает слабыми щелочными свойствами. При этом гидроксид аммония может проявлять свойства растворимого и нерастворимого основания.
Свойства, показывающие, что аммиачная вода – щёлочь (растворимое основание):
- меняет окраску индикатора – метилоранж становится жёлтого цвета, лакмус – синего, фенолфталеин – малинового;
- реагирует с кислотами, образуя средние и кислые соли – 2NH3·H2O + H2SO3 → (NH4)2SO3 (средняя соль) + 2H2O или 2NH3·H2O + H2SO3 → NH4HSO3 (кислая соль);
- реагирует с кислотными оксидами с образованием нормальной соли – SO3 + 2NH3·H2O → (NH4)2SO4 + 2H2O;
- реагирует с солями – 3NH3·H2O + AlCl3 → Al(OH)3 + 3NH4Cl.
Рис. 2. Реакция на индикатор.
Сходство с нерастворимыми основаниями:
- легко разлагается – NH3·H2O → NH3 + H2O;
- реагирует с кислотами;
- не реагирует с амфотерными металлами, их оксидами и гидроксидами.
Рис. 3. Амфотерные металлы.
Гидроксид аммония, реагируя с перманганатом калия, проявляет восстановительные свойства:
2NH4OH + 2KMnO4 → 2MnO2↓ + N2↑ + 2KOH + 4H2O.
Нашатырный спирт используется в медицине, в изготовлении удобрений, красителей, соды. В пищевой промышленности используется в качестве добавки E527. В быту аммиачную воду применяют для очистки стёкол, мебели, текстиля.
Что мы узнали?
Раствор аммиака, нашатырный спирт, аммиачная вода – это гидроксид или гидрат аммония (NH3·H2O), образующийся за счёт хорошей растворимости аммиака в воде.
Помимо непосредственного взаимодействия аммиака с водой нашатырный спирт можно получить реакцией нитрата аммония с водой.
Раствор проявляет свойства растворимых и нерастворимых оснований, реагируя с кислотами, солями, кислотными оксидами и не реагируя с амфотерными металлами и их соединениями.
Видео:Химия ЕГЭ 2022 / Задание 30Скачать

Гидролиз солей
Водные растворы солей имеют разные значения рН и показывают различную реакцию среды — кислую, щелочную, нейтральную.
Например, водный раствор хлорида алюминия AlCl3 имеет кислую среду (рН 7), растворы хлорида натрия NaCl и нитрита свинца Pb(NO2)2 — нейтральную среду (pН = 7). Эти соли не содержат в своем составе ионы водорода Н + или гидроксид-ионы ОН — , которые определяют среду раствора. Чем же можно объяснить различные среды водных растворов солей? Это объясняется тем, что в водных растворах соли подвергаются гидролизу.
Слово «гидролиз» означает разложение водой («гидро» — вода, «лизис» — разложение).
Гидролиз — одно из важнейших химических свойств солей.
Гидролизом соли называется взаимодействие ионов соли с водой, в результате которого образуются слабые электролиты.
Сущность гидролиза сводится к химическому взаимодействию катионов или анионов соли с гидроксид-ионами ОН — или ионами водорода Н + из молекул воды. В результате этого взаимодействия образуется малодиссоциирующее соединение (слабый электролит). Химическое равновесие процесса диссоциации воды смещается вправо.
Поэтому в водном растворе соли появляется избыток свободных ионов Н + или ОН — , и раствор соли показывает кислую или щелочную среду.
Гидролиз — процесс обратимый для большинства солей. В состоянии равновесия только небольшая часть ионов соли гидролизуется.
Любую соль можно представить как продукт взаимодействия кислоты с основанием. Например, соль NaClO образована слабой кислотой HClO и сильным основанием NaOH.
В зависимости от силы исходной кислоты и исходного основания соли можно разделить на 4 типа:
Соли I, II, III типов подвергаются гидролизу, соли IV типа не подвергаются гидролизу
Рассмотрим примеры гидролиза различных типов солей.
I. Соли, образованные сильным основанием и слабой кислотой, подвергаются гидролизу по аниону. Эти соли образованы катионом сильного основания и анионом слабой кислоты, который связывает катион водорода Н + молекулы воды, образуя слабый электролит (кислоту).
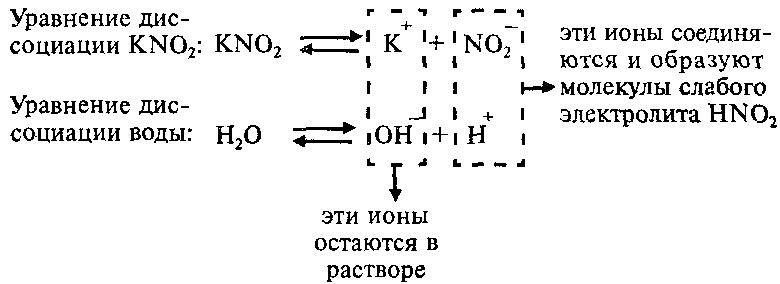
Пример: Составим молекулярное и ионные уравнения гидролиза нитрита калия KNO2.
Соль KNO2 образована слабой одноосновной кислотой HNO2 и сильным основанием KОН, что можно изобразить схематически так:
Напишем уравнение гидролиза соли KNO2:
Каков механизм гидролиза этой соли?
Так как ионы Н + соединяются в молекулы слабого электролита HNО2, их концентрация уменьшается и равновесие процесса диссоциации воды по принципу Ле-Шателье смещается вправо. В растворе увеличивается концентрация свободных гидроксид-ионов ОН — . Поэтому раствор соли KNO2 имеет щелочную реакцию (pН > 7).
Вывод: Соли, образованные сильным основанием и слабой кислотой, при растворении в воде показывают щелочную реакцию среды, pН > 7.
II. Соли, образованные слабым основанием и сильной кислотой, гидролизуются по катиону. Эти соли образованы катионом слабого основания и анионом сильной кислоты. Катион соли связывает гидроксид-ион ОН — воды, образуя слабый электролит (основание).
Пример: Составим молекулярное и ионное уравнения гидролиза йодида аммония NH4I.
Соль NH4I образована слабым однокислотным основанием NH4OH и сильной кислотой НI:
При растворении в воде соли NH4I катионы аммония NH4 + связываются с гидроксид-ионами ОН — воды, образуя слабый электролит – гидроксид аммония NH4OH. В растворе появляется избыток ионов водорода Н + . Среда раствора соли NH4I – кислая, рН — из молекулы воды и образует слабое основание, и анионом слабой кислоты, который связывает ионы Н + из молекулы воды и образует слабую кислоту. Реакция растворов этих солей может быть нейтральной, слабокислой или слабощелочной. Это зависит от констант диссоциации слабой кислоты и слабого основания, которые образуются в результате гидролиза.
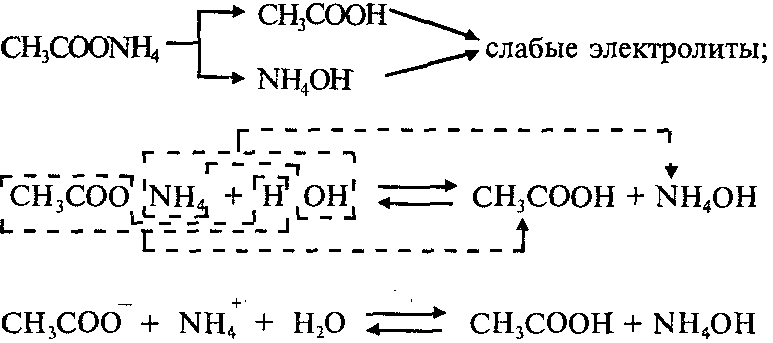
Пример 1: Составим уравнения гидролиза ацетата аммония CH3COONH4. Эта соль образована слабой уксусной кислотой СН3СООН и слабым основанием NH4ОH:
Реакция раствора соли CH3COONH4 – нейтральная (рН=7), потому что Kд(СН3СООН)=Kд(NH4ОH).
Пример 2: Составим уравнения гидролиза цианида аммония NH4CN. Эта соль образована слабой кислотой HCN и слабым основанием NH4ОH:
Реакция раствора соли NH4CN — слабощелочная (pН > 7), потому что Kд(NH4ОH)> Kд(HCN).
Как уже было отмечено, для большинства солей гидролиз является обратимым процессом. В состоянии равновесия гидролизуется только небольшая часть соли. Однако некоторые соли полностью разлагаются водой, т. е. для них гидролиз является необратимым.
Необратимому (полному) гидролизу подвергаются соли, которые образованы слабым нерастворимым или летучим основанием и слабой летучей или нерастворимой кислотой. Такие соли не могут существовать в водных растворах, К ним, например, относятся:
Пример: Составим уравнение гидролиза сульфида алюминия Al2S3:
Гидролиз сульфида алюминия протекает практически полностью до образования гидроксида алюминия Al(OH)3 и сероводорода H2S.
Поэтому в результате обменных реакций между водными растворами некоторых солей не всегда образуются две новые соли. Одна из этих солей может подвергаться необратимому гидролизу с образованием соответствующего нерастворимого основания и слабой летучей (нераствориой) кислоты. Например:
Суммируя эти уравнения, получаем:
или в ионном виде:
IV. Соли, образованные сильной кислотой и сильным основанием, не гидролизуются, потому что катионы и анионы этих солей не связываются с ионами Н + или ОН — воды, т. е. не образуют с ними молекул слабых электролитов. Равновесие диссоциации воды не смещается. Среда растворов этих солей — нейтральная (рН = 7,0), так как концентрации ионов Н + и ОН — в их растворах равны, как в чистой воде.
Вывод: Соли, образованные сильной кислотой и сильным основанием, при растворении в воде гидролизу не подвергаются и показывают нейтральную реакцию среды (рН = 7,0).
Ступенчатый гидролиз
Гидролиз солей может протекать ступенчато. Рассмотрим случаи ступенчатого гидролиза.
Если соль образована слабой многоосновной кислотой и сильным основанием, число ступеней гидролиза зависит от основности слабой кислоты. В водном растворе таких солей на первых ступенях гидролиза образуются кислая соль вместо кислоты и сильное основание. Ступенчато гидролизуюгся соли Na2SO3, Rb2CО3, K2SiO3, Li3PO4 и др.
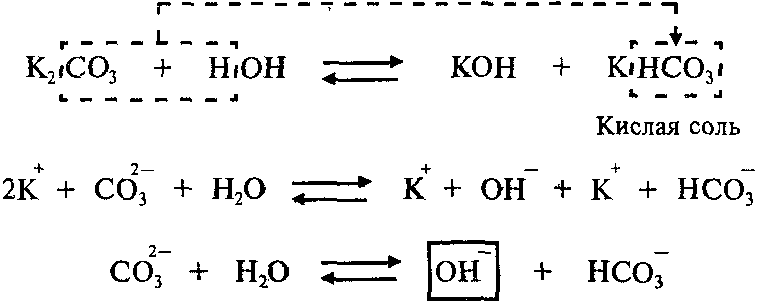
Пример: Составим молекулярное и ионное уравнения гидролиза карбоната калия K2СО3.
Гидролиз соли K2СО3 протекает по аниону, потому что соль карбонат калия образована слабой кислотой Н2СО3 и сильным основанием KОН:
Так как Н2СО3 – двухосновная кислота, гидролиз K2СО3 протекает по двум ступеням.
Продуктами первой ступени гидролиза K2СО3 являются кислая соль KHCO3 и гидроксид калия KОН.
Вторая ступень (гидролиз кислой соли, которая образовалась в результате первой ступени):
Продуктами второй ступени гидролиза K2СО3 являются гидроксид калия и слабая угольная кислота Н2СО3. Гидролиз по второй ступени протекает в значительно меньшей степени, чем по первой ступени.
Среда раствора соли K2СО3 — щелочная (рН > 7), потому что в растворе увеличивается концентрация ионов ОН — .
Если соль образована слабым многокислотным основанием и сильной кислотой, то число ступеней гидролиза зависит от кислотности слабого основания. В водных растворах таких солей на первых ступенях образуется основная соль вместо основания и сильная кислота. Ступенчато гидролизуются соли MgSО4, CoI2, Al2(SO4)3, ZnBr2 и др.
Пример: Составим молекулярное и ионное уравнения гидролиза хлорида никеля (II) NiCl2.
Гидролиз соли NiCl2 протекает по катиону, так как соль образована слабым основанием Ni(OH)2 и сильной кислотой НСl. Катион Ni 2+ связывает гидроксид-ионы ОН — воды. Ni(OH)2 — двухкислотное основание, поэтому гидролиз протекает по двум ступеням.
Продуктами первой ступени гидролиза NiCl2 являются основная соль NiOHCl и сильная кислота HCl.
Вторая ступень (гидролиз основной соли, которая образовалась в результате первой ступени гидролиза):
Продуктами второй ступени гидролиза являются слабое основание гидроксид никеля (II) и сильная хлороводородная кислота НCl. Однако степень гидролиза по второй ступени намного меньше, чем по первой ступени.
Среда раствора NiCl2 — кислая, рН + .
Гидролизу подвергаются не только соли, но и другие неорганические соединения. Гидролизуются также жиры, углеводы, белки и другие вещества, свойства которых изучаются в курсе органической химии. Поэтому можно дать более общее определение процесса гидролиза:
Гидролиз — это реакция обменного разложения веществ водой.
🎥 Видео
СОЛИ ХИМИЯ 8 КЛАСС // Урок Химии 8 класс: Классификация солей, Формулы Солей, Кислотный ОстатокСкачать