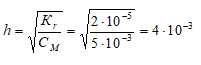CuCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора хлорида меди (II)
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
- Молекулярная и ионная формы уравнений реакций гидролиза
- а) Гидролиз сульфида калия:
- б) Гидролиз сульфата меди (ⅠⅠ):
- в) Совместный гидролиз хлорида алюминия и ацетата калия:
- Определение степени гидролиза и рН раствора цианида калия
- 📹 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Первая стадия (ступень) гидролиза
Молекулярное уравнение
CuCl2 + HOH ⇄ CuOHCl + HCl
Полное ионное уравнение
Cu 2+ + 2Cl — + HOH ⇄ CuOH + + Cl — + H + + Cl —
Сокращенное (краткое) ионное уравнение
Cu 2+ + HOH ⇄ CuOH + + H +
Видео:Гидролиз солей. 9 класс.Скачать

Вторая стадия (ступень) гидролиза
Молекулярное уравнение
CuOHCl + HOH ⇄ Cu(OH)2 + HCl
Полное ионное уравнение
CuOH + + Cl — + HOH ⇄ Cu(OH)2 + H + + Cl —
Сокращенное (краткое) ионное уравнение
CuOH + + HOH ⇄ Cu(OH)2 + H +
Видео:Реакции ионного обмена. 9 класс.Скачать

Среда и pH раствора хлорида меди (II)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:11 класс. Гидролиз солей.Скачать

Please wait.
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 702719beff2b4c20 • Your IP : 87.119.247.227 • Performance & security by Cloudflare
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Как правильно написать уравнения гидролиза и рассчитать константу и степень гидролиза соли
Видео:Электролиз. 10 класс.Скачать

Молекулярная и ионная формы уравнений реакций гидролиза
Задача 21.
Напишите в молекулярной и ионной форме уравнения реакций гидролиза следующих солей: а) сульфида калия; б) сульфата меди (ⅠⅠ); в) совместного гидролиза хлорида алюминия и ацетата калия. Константа гидролиза соли.
Решение:
а) Гидролиз сульфида калия:
K2S + H2O = KHS + KOH — (молекулярная форма);
S 2– + HOH = HS – + OH – — (ионная форма).
б) Гидролиз сульфата меди (ⅠⅠ):
Cu 2+ + HOH = CuOH + + H + — (ионная форма).
в) Совместный гидролиз хлорида алюминия и ацетата калия:
AlCl3 + 3CH3COOK + 3H2O = Al(OH)3↓ + 3CH3COOH + 3KCl — (молекулярная форма);
Al 3+ + 3CH3COO – + 3HOH = Al(OH)3↓ + 3CH3COOH — (ионная форма).
Определение степени гидролиза и рН раствора цианида калия
Задача 22.
Определите степень гидролиза и pH раствора цианида калия с молярной концентрацией 0,005 моль/л.
Решение:
Цианид калия – соль, образованная сильным основанием КОН и слабой кислотой HCN, которая в водном растворе гидролизуется по аниону.
KCN + HOH ⇔ KOH + HCN
CN – + HOH ⇔ HCN + OH –
Таким образом, при гидролизе этой соли в растворе ее будет избыток ионов OH-, что придает раствору щелочную реакцию
(pH > 7 – среда щелочная).
Константа гидролиза соли, образованной слабой кислотой и сильным основанием определяется по формуле:
Kw = 1 . 10 -14 – ионное произведение воды.
KD(HCN) = 5 . 10 -10 – константа диссоциации циановодородной кислоты
Константа гидролиза цианида калия равна:
Kr(KCN) = Kw/KD(HCN) = (1 . 10 -14 )/(5 . 10 -10 ) = 2 . 10 -5 .
Находим степень гидролиза цианида калия, получим:
Рассчитаем молярную концентрацию ионов OH? в растворе, получим:
[OH – ] = h . СM(KCN) = (4 . 10 -3 ) . 0,005 = 2 . 10 -5 моль/л.
Находим гидроксильный показатель, получим:
рОН = — lg[OH – ] = – lg2 . 10 -5 = 5 — lg2 = 5 — 0,30 = 4,7.
Находим водородный показатель, получим
📹 Видео
Получение гидроксида меди (II) и растворение его в кислотахСкачать

Все реакции гидролиза в ЕГЭ за 2 часа | Химия ЕГЭ 2022 | УмскулСкачать

Реакция замещения меди железом в растворе сульфата или хлорида меди IIСкачать

Реакции ионного обмена. 9 класс.Скачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Реакции ионного обменаСкачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

76. Гидролиз солей (часть 1)Скачать

9-класс| Химия | Реакции ионного обмена. Гидролиз солейСкачать

Опыты по химии. Получение гидроксида меди (II) и изучение его свойствСкачать