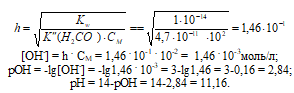K3PO4 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора ортофосфата калия
- Соли фосфорной кислоты H3PO4
- Гидролиз фосфата натрия Na3PO4
- Гидролиз гидрофосфата натрия Na2HPO4
- Гидролиз дигидрофосфата натрия NaH2PO4
- Применение фосфатов
- Как правильно написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза солей
- Составьте молекулярные и ионные уравнения гидролиза, в результате которого образуются гидрофосфат и дигидрофосфат калия.
- Описание и исходные данные задания, 50% решения + фотография:
- 🔍 Видео
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
3K + + PO4 3- + HOH ⇄ 2K + + HPO4 2- + K + + OH —
Сокращенное (краткое) ионное уравнение
PO4 3- + HOH ⇄ HPO4 2- + OH —
Видео:Гидролиз солей. 9 класс.Скачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2K + + HPO4 2- + HOH ⇄ K + + H2PO4 — + K + + OH —
Сокращенное (краткое) ионное уравнение
HPO4 2- + HOH ⇄ H2PO4 — + OH —
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Третья стадия (ступень) гидролиза
Сокращенное (краткое) ионное уравнение
H2PO4 — + HOH ⇄ H3PO4 + OH —
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Среда и pH раствора ортофосфата калия
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

Соли фосфорной кислоты H3PO4
H3PO4 образует три ряда солей:
Как видно из реакций, приведенных выше, та или иная соль получается в зависимости от соотношения молярных масс реагирующих кислот и щелочей.
Средние соли фосфорной кислоты (фосфаты) нерастворимы в воде, за исключением аммония и фосфатов щелочных металлов. Кислые соли, наоборот, хорошо растворяются в воде, лучше всего — дигидрофосфаты.
Отличительной особенностью солей фосфорной кислоты является принципиально разный характер среды, образующейся в водных растворах средних и кислых солей в результате их гидролиза.
Гидролиз фосфата натрия Na3PO4
Основная ступень гидролиза фосфата натрия выражается следующей реакцией:
Na3 PO4 3- + H2O ↔ Na2 HPO4 2- +Na OH —
Образующиеся ионы HPO4 2- очень слабо диссоциируют (см. выше диссоциацию фосфорной кислоты п.3), практически не подкисляя раствор, в таких условиях кислотность раствора определяется только гидроксид-ионами OH — , по этой причине водные растворы средних фосфатов имеют сильно щелочную среду.
Гидролиз гидрофосфата натрия Na2HPO4
Основная ступень гидролиза гидрофосфата натрия выражается следующей реакцией:
Na2 HPO4 2- + H2O ↔ Na H2PO4 — +Na OH —
Образующиеся ионы H2PO4 2- диссоциируют достаточно хорошо (см. выше диссоциацию фосфорной кислоты п.2), нейтрализуя значительную часть гидроксид-ионов OH — , по этой причине водные растворы гидрофосфатов имеют слабощелочную среду.
Гидролиз дигидрофосфата натрия NaH2PO4
В растворах дигидрофосфатов наряду с гидролизом идет процесс диссоциации дигидрофосфат-ионов:
Na H2PO4 — + H2O ↔ H3PO4 +Na OH —
H2PO4 — ↔ H + +HPO4 2-
Примечательно, что второй процесс превалирует над первым, по этой причине, все гидроксид-ионы OH — , являющиеся продуктом гидролиза, полностью нейтрализуются продуктами диссоциации — катионами водорода H + , которых присутствует в растворе в избытке, что и объясняет слабокислый характер среды растворов дигидрофосфатов.
Видео:ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Применение фосфатов
Соли фосфорной кислоты находят широчайшее применение в современной стоматологии и ортопедии, в бытовой химии:
Апатит Ca5(OH)(PO4)3 — важнейший компонент зубов и костей. Зубной кариес является результатом химической реакции фосфата с кислой средой в ротовой полости (кислоты содержатся в пище, а также образуются в результате жизнедеятельности микроорганизмов, находящихся во рту).
Фтор, входящий в состав зубной пасты, способствует образованию на зубах тонкого слоя фторапатита, более устойчивого к негативному действию кислот:
Ca5(OH)(PO4)3+F → Ca5F(PO4)3+OH —
Современные пломбировочные материалы, применяющиеся в стоматологии, содержат труднорастворимые фосфаты алюминия и цинка (AlPO4, Zn3(PO4)2), которые являются очень устойчивыми к действию кислот.
В последнее время соли фосфорной кислоты стали использоваться в ортопедии для восстановления сломанных костей — специальная паста, в состав которой входят дигидрофосфат кальция, фосфат натрия, фосфорит вводится в место перелома кости, формируя в течение нескольких минут сломанный участок — по мере сращения кости искусственная кость замещается естественной костной тканью.
Натриевая соль трифосфорной кислоты нашла применение в моющих средствах, которые используются для смягчения жесткой воды — ионы магния и кальция связываются трифосфорной кислотой, и не взаимодействуют с анионами мыла.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Как правильно написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза солей
Задача 949.
Написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза Na2СО3, КНСО3, (NH4)2СO3. Указать реакцию среды.
Решение:
а) Na2CO3 – соль сильного основания и слабой кислоты, гидролизуется по аниону:
При гидролизе соли образуется избыток ионов ОН – , которые придают раствору щелочную среду, рН > 7.
б) КНСО3 – кислая соль сильного основания и слабой кислотой гидролизуется по аниону:
При гидролизе соли образуется избыток ионов OH – , которые придают раствору щелочную среду, рН > 7.
в) (NH4)2СO3 – соль слабого основания и слабой кислоты, гидролизуется как по катиону, так и по аниону:
Гидролиз по аниону в основном протекает по 1-ой ступени. При гидролизе соли образуется дополнительное количество ионов Н + и ОН-, которые связываясь образуют молекулы Н2О ↔ Н + + ОН – ↔ Н2О. Раствор приобретает нейтральную среду, рН = 7. Но так как КDII(H2CO3) 4,7 . 10 -11 1.8 . 10 -5 , то преимущественно будет протекать гидролиз соли по аниону и в растворе будет наблюдаться некоторый избыток ионов ОН-, что придаёт ему слабощелочную среду, рН > 7.
Задача 950.
Вычислить рН 0,01 М раствора карбоната калия.
Решение:
К2СО3 – соль сильного основания и слабой кислоты гидролизуется по аниону:
Ответ: рН = 11,16.
Задача 951.
Для получения соды раствор NаОН разделили на две равные порции, одну из них насытили СО2, после чего смешали с другой порцией. Какое вещество образовалось после насыщения первой порции? Какая реакция произошла при смешении первой порции со второй? Написать уравнения реакций.
Решение:
При насыщении раствора едкого натра углекислым газом образуется гидрокарбонат натрия:
При смешивании растворов NaOH и NaHCO3 произойдёт реакция в результате которой образуется Na2CO3:
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

Составьте молекулярные и ионные уравнения гидролиза, в результате которого образуются гидрофосфат и дигидрофосфат калия.






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Составьте молекулярные и ионные уравнения гидролиза, в результате которого образуются гидрофосфат и дигидрофосфат калия.
Решение :
K 3 PO 4 – фосфат калия, соль слабой кислоты и сильного основания, , в водном растворе частично гидролизуется по аниону слабой кислоты:
3 K + + PO 4 3- + H 2 O ↔ 2 K + + HPO 4 2- + K + + OH —
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Назвать комплексное соединение. 2. Указать значение координационного числа. Комплексное соединение 1 — K3[Co(CN)4Cl2] Комплексное соединение 2 — H2[CoCl4]
- Составить для схемы реакции электронно-ионные уравнения: KI + K2Cr2O7 + H2SO4 → I2 + Cr2(SO4)3 + K2SO4 + H2O. Расставить коэффициенты в уравнении реакции. Определить молярные массы эквивалентов
- Вычислите водородный показатель 0,005 М раствора гидроксида калия, степень диссоциации КОН α = 90%.
- Произведение растворимости хлорида серебра при 25°С равно 1,56 ⋅10-10. Вычислить растворимость AgCl в г/л.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
🔍 Видео
Химия 8 класс: Гидролиз солейСкачать

Электролиз. 10 класс.Скачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Примеры решения задач на водородный показатель pH растворов. 11 класс.Скачать

11 класс. Гидролиз солей.Скачать

Лабораторная работа №3 Гидролиз. Кислотно-основные взаимодействия в растворахСкачать

Решаем все задания на гидролиз в ЕГЭСкачать

Гидролиз солейСкачать

Химия 11 класс (Урок№7 - Гидролиз органических и неорганических соединений.)Скачать

Реакции ионного обмена, задание №30 ЕГЭ | Екатерина Дацук | ХИМИЯ ЕГЭСкачать

Гидролиз солей. 2 часть. 11 класс.Скачать