Fe2(SO4)3 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Третья стадия (ступень) гидролиза
- Среда и pH раствора сульфата железа (III)
- Please wait.
- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Уравнения реакций и продукты гидролиза различных солей железа (III)
- Как усилить гидролиз хлорида железа (III)
- Продукты взаимодействия карбоната натрия с водным раствором сульфата железа (III)
- 📸 Видео
Видео:Гидролиз солей. 9 класс.Скачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Fe 3+ + 3SO4 2- + 2HOH ⇄ 2FeOH 2+ + 2SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Fe 3+ + HOH ⇄ FeOH 2+ + H +
Видео:FeSO4+KMnO4+H2SO4=Fe2(SO4)3+MnSO4+K2SO4+H2O расстановка коэффициентов методом электронного балансаСкачать
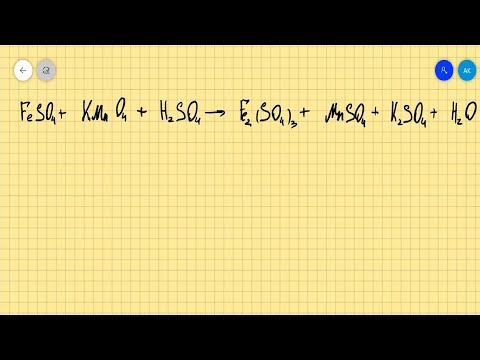
Вторая стадия (ступень) гидролиза
Полное ионное уравнение
2FeOH 2+ + 2SO4 2- + 2HOH ⇄ 2Fe(OH)2 + + SO4 2- + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
FeOH 2+ + HOH ⇄ Fe(OH)2 + + H +
Видео:Гидролиз солей. 1 часть. 11 класс.Скачать

Третья стадия (ступень) гидролиза
Полное ионное уравнение
2Fe(OH)2 + + SO4 2- + 2HOH ⇄ 2Fe(OH)3 + 2H + + SO4 2-
Сокращенное (краткое) ионное уравнение
Fe(OH)2 + + HOH ⇄ Fe(OH)3 + H +
Видео:Решаем все задания на гидролиз в ЕГЭСкачать

Среда и pH раствора сульфата железа (III)
В результате гидролиза образовались ионы водорода (H + ), поэтому раствор имеет кислую среду (pH
Видео:Гидролиз солей. Классификация солей. Решение примеров.Скачать

Please wait.
Видео:ГИДРОЛИЗ СОЛЕЙ | 9 класс | Кратко и понятноСкачать

We are checking your browser. gomolog.ru
Видео:Необратимый гидролиз карбоната алюминия Al2(CO3)3 и карбоната железа (III) Fe2(CO3)3Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Гидролиз солей. Теория для задания 23 ЕГЭ по химии.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e1d8a14dd680b80 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
Видео:Гидролиз солей. 2 часть. 11 класс.Скачать

Уравнения реакций и продукты гидролиза различных солей железа (III)
Видео:11 класс. Гидролиз солей.Скачать

Как усилить гидролиз хлорида железа (III)
Задача 1136.
Добавление каких веществ усилит гидролиз FeCl3: а) H2SO4; б) ZnCl2; в) (NH4)2CO3; г) Zn?
Решение:
а) FeCl3 – соль сильной кислоты и слабого основания гидролизуется по катиону с образованием избытка ионов водорода Н + :
Fe 3+ + H2O ⇔ FeOH 2+ + H +
При добавлении H2SO4 в раствор соли FeCl3 уменьшится степень гидролиза соли, так как дополнительное количество ионов водорода Н + от серной кислоты (H2SO4 ⇔ 2H + + SO4 2- )будет способствовать смещению равновесия в системе в сторону уменьшения концентрации ионов Н + , гидролиз соли уменьшится.
б) ZnCl2 – соль сильной кислоты и слабого основания гидролизуется по катиону с образованием избытка ионов водорода Н + :
Zn 2+ + H2O — ZnOH + + H +
Дополнительное количество ионов водорода, образуемое при гидролизе ZnCl2, будет уменьшать гидролиз FeCl3, так как, согласно принципу Ле Шателье, равновесие системы сместится влево, в сторону уменьшения концентрации ионов Н + .
в) (NH4)2CO3 – соль слабого основания и слабой кислоты гидролизуется как по катиону, так и по аниону:
При гидролизе образуется избыточное количество ионов Н + и OH – , которые связываясь друг с другом, образуют воду (Н + + OH – ⇔ Н2О). Поэтому при смешении растворов (NH4)2CO3 и FeCl3 гидролиз обеих солей будет взаимно усиливаться, так как, согласно принципу Ле Шателье, равновесие в системе сместится вправо, в сторону увеличения гидролиза.
г) Цинк в ряду напряжений металлов стоит перед водородом, поэтому при введении металлического цинка в раствор соли FeCl3 (кислая среда) будет наблюдаться окисление атомов цинка и восстановление ионов водорода:
что будет уменьшать концентрацию ионов водорода. Уменьшение концентрации ионов Н + согласно принципу Ле Шателье будет способствовать смещению равновесия системы вправо, в сторону увеличения концентрации ионов Н + , т. е. гидролиз соли будет увеличиваться.
К тому же цинк как более активный металл будет вытеснять железо из его солей, дополнительно будет протекать реакция обмена между цинком и железом:
Таким образом, цинк будет вступать в реакцию обмена с солью FeCl3 и дополнительно будет способствовать усилению гидролиза соли.
Продукты взаимодействия карбоната натрия с водным раствором сульфата железа (III)
Задача 1137.
Каковы продукты взаимодействия карбоната натрия с водным раствором Ее2(SO4)3: а) Ее(ОН)3 и СО2 б) Ее2(СО3)3 и Na2SO4?
Потому что: 1) протекает реакция обмена; 2) происходит взаимное усиление процесса гидролиза двух солей.
Решение:
N2CO3 – соль сильного основания и слабой кислоты гидролизуется по аниону с образованием избытка ионов ОН¯:
I ступень CO3 2- + H2O ⇔ HCO¯ + ОН¯;
Уравнение реакции гидролиза имеет вид:
При гидролизе образуется избыточное количество ионов ОН¯.
Ее2(SO4)3 – соль сильной кислоты и слабого основания гидролизуется по катиону с дополнительным образованием ионов Н + :
Fe 3+ + H2O ⇔ FeOH 2+ + H +
При смешении растворов N2CO3 и Ее2(SO4)3 избыточные ионы Н + и ОН¯, связываясь друг с другом образуют воду
(Н + + ОН¯ ⇔ Н2О). В результате уменьшения в системе ионов Н + и ОН¯ согласно принципу Ле Шателье равновесие сместится в сторону увеличения концентраций ионов Н + и ОН¯, т. е. гидролиз обеих солей будет усиливаться. Гидролиз Ее2(SO4)3:
Таким образом, гидролиз обеих солей будет протекать до конца с образованием Ее(ОН)3 и СО2:
I ступень Fe 3+ + H2O — FeOH 2+ + H + ;
II ступень FeOH 2+ + H2O ⇔ Fe(OH) 2+ + H +;
III ступень Fe(OH) 2+ + H2O ⇔ Fe(OH)3 ↓+ H +
Уравнение реакции гидролиза будет иметь вид:
Значит, при смешении растворов Na2CO3 и Ее2(SO4)3 будет протекать реакция по схеме:
2Fe 3+ + 3CO3 2- + 3H2O ⇔2Fe(OH)3↓ + 3CO2↑ (ионно-молекулярная форма).
Таким образом, при смешении растворов Na2CO3 и Ее2(SO4)3 образуются нерастворимый Fe(OH)3 и газообразный СО2, так как происходит взаимное усиление процесса гидролиза обеих солей.
📸 Видео
Химия 8 класс: Гидролиз солейСкачать

Гидролиз солей.ПримерыСкачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

Гидролиз солейСкачать

Летучка: все реакции гидролиза | Химия ЕГЭ 2023 | УмскулСкачать

Взаимодействие сульфата алюминия с раствором гидроксида натрия Al2(SO4)3 + NaOHСкачать

Ступенчатый гидролиз солей по аниону. Решаем примеры.Скачать

Химия 9 класс (Урок№8 - Гидролиз солей.)Скачать

Гидролиз солей. Практическая часть. 10 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать
