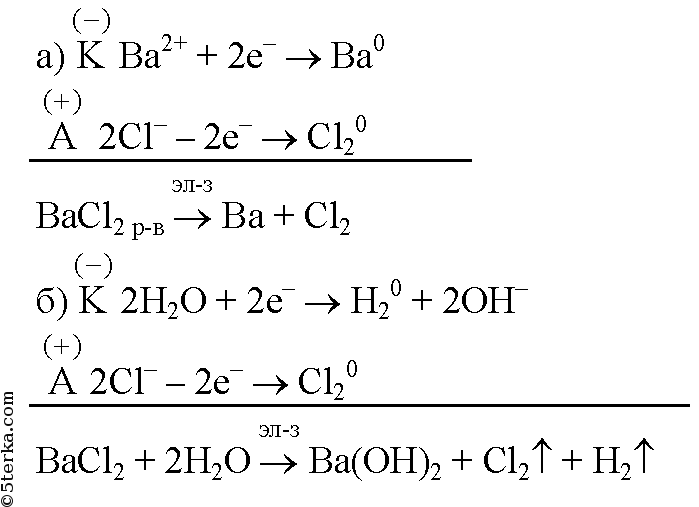задача №23
к главе «Глава 4. Вещества и их свойства. §18. Металлы».
Выделите её мышкой и нажмите CTRL + ENTER
Большое спасибо всем, кто помогает делать сайт лучше! =)
Нажмите на значок глаза возле рекламного блока, и блоки станут менее заметны. Работает до перезагрузки страницы.
Видео:Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Составьте уравнения электролиза хлорида бария в: а) расплаве, б) растворе
Видео:Электролиз. 10 класс.Скачать

Ваш ответ
Видео:Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

решение вопроса
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Похожие вопросы
- Все категории
- экономические 43,408
- гуманитарные 33,633
- юридические 17,906
- школьный раздел 608,025
- разное 16,856
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

Уравнения электродных процессов, протекающих при электролизе водных растворов солей
Задача 688.
Написать уравнения электродных процессов, протекающих при электролизе водных растворов ВаСI2 и РbNO3)2 с угольными электродами.
Решение:
а) электролиз водного раствора ВаСI2
ВаСI2 – соль активного металла и кислородной кислоты. Стандартный электродный потенциал системы: Ba 2+ = 2 
2H2O + 2 
На аноде будет происходить электрохимическое окисление хлора, стандартный потеннциал которого (+1,36 В) выше, чем воды (+1,23 В). Хлор будет окисляться, потому что наблюдается значительное перенапряжение процесса окисления воды, материал анода оказывает тормозящее воздействие на его протекание:
2Cl — — 2 
Cl* + Cl* = Cl2
Сложив уравнения катодного и анодного процессов, получим суммарное уравнение:
Таким образом, при электролизе водного раствора хлорида бария одновременно с выделением газообразного водорода (катод) и газообразного хлора (анод), образуется гидроксид бария (катодное пространство).
б) электролиз водного раствора Рb(NO3)2
Рb(NO3)2 – соль средней активности металла и кислородной кислоты, которая в водном растворе диссоциирует по схеме:
Стандартный электродный потенциал электрохимической системы Pb 2+ /Pb (-0,13В) положительнее потенциала водородного электрода в нейтральной среде (-0,41 В) незначительно. Поэтому на катоде будет выделяться свинец 

Pb2+ + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O — 4 
Ионы NO3 -, движущиеся при гидролизе к аноду, будут накапливаться в анодном пространстве. Умножим уравнение катодного процесса на два и сложим его с уравнением анодного процесса, получим суммарное уравнение:
2Pb 2+ + 2H2O = 2Pb + O2↑ + 4H +
у катода у анода
Приняв во внимание, что одновременно происходит накопление ионов NO3 — в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Таким образом, при электролизе водного раствора соли нитрата свинца одновременно с выделением свинца (катод) и газообразного кислорода (анод), образуется азотная кислота (анодное пространство).
Задача 689.
Написать уравнения электродных процессов, протекающих при электролизе водных растворов FeCl3 и Са(NO3)2 с инертным анодом.
Решение:
а) Электролиз водного раствора FeCl3
В водном растворе соль FeCl3 диссоциирует по схеме: FeCl3 ⇔ Fe 3+ + 3Cl — . Стандартный электродный потенциал системы Fe 3+ + 3 
Fe 3+ + 3 
На аноде будет происходить электролитическое окисление ионов хлора с образованием свободных атомов хлора, которые, соединяясь друг с другом, образуют молекулу хлора:
2Cl — — 2 
Cl* + Cl* = Cl2
Сложим, предварительно умножив уравнение катодного процесса на два и на три уравнения анодного процессов, получим суммарное уравнение:
2Fe 3+ + 6Cl — = 2Fe + 3Cl2
При электролизе FeCl3 в водном растворе с инертными электродами образуются металлическое железо, и выделяется газообразный хлор.
б) Электролиз водного раствора Са(NO3)2
Са(NO3)2 в водном растворе диссоциирует по схеме:
Стандартный электродный потенциал системы Ca 2+ + 2 
2H2O + 2 
а ионы кальция Са 2+ , приходящие к катоду, будут накапливаться в прилегающей к нему части раствора (катодное пространство). На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2H2O — 4 
Иионы NO3 — на аноде разряжаться не будут, а будут накапливаться в анодном пространстве.
Умножив уравнение катодного процесса на два, и сложив, его с уравнением анодного процесса получим суммарное уравнение электролиза:
Приняв во внимание, что одновременно происходить накопление ионов кальция в катодном пространстве и нитрат-ионов в анодном пространстве, суммарное уравнение процесса можно записать в следующей форме:
Молекулярная реакция после приведения членов, получим:
Таким образом, при электролизе раствора соли нитрата кальция одновременно с выделением водорода и кислорода образуется гидроксид кальция (в катодном пространстве) и азотная кислота (в анодном пространстве).
📺 Видео
уравнения электролизаСкачать

Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Опыты по химии. Электролиз раствора хлорида медиСкачать

Гальванические элементы. 1 часть. 10 класс.Скачать

Гидролиз солей. 9 класс.Скачать

Задание ЕГЭ №20. Электролиз расплавов и растворов.Скачать

Электролиз расплавов и растворов. 10 класс.Скачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Электролиз. Разбор задания №34 — ХИМИЯ | SKILLVERSEСкачать

Электролиз: как понять и научиться писать реакции электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

Электролиз растворов. 2 часть. 10 класс.Скачать

Электролиз раствора хлорида меди. Химический опытСкачать

Химия / 9 класс / ЭлектролизСкачать

ЭлектролизСкачать