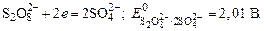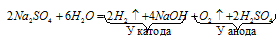Пример 1. Напишите уравнения электродных процессов, протекающих при электролизе водного раствора MgSO4 с инертными электродами.
Решение. Стандартный электродный потенциал системы Mg 2+ + 2e ® Mg равен –2,363 В. Сульфат магния является солью, обра-зованной слабым основанием и сильной кислотой, поэтому вследствие гидролиза среда в его водном растворе будет слабокислотной (рН – ,
а ионы Мg 2+ будут накапливаться в прикатодном пространстве.
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
поскольку отвечающий этой системе электродный потенциал кислородного электрода в слабокислотной среде
значительно меньше, чем стандартный потенциал, характеризующий систему:
Ионы 
Умножая уравнение катодного процесса на 2 для подведения баланса по электронам и складывая его с уравнением анодного процесса, получают суммарное уравнение процесса электролиза:
Принимая во внимание, что одновременно происходит накопление ионов магния в прикатодном пространстве и сульфат-ионов в прианодном пространстве, итоговое уравнение процесса можно записать так:
6 Н2О + 2MgSO4 = 2H2 + 2Mg(OH)2¯ + O2 + 4H + + 2
Следует учитывать, что гидроксид магния – малорастворимое соединение.
Пример 2. Написать уравнения процессов, протекающих при электролизе водного раствора, содержащего смесь солей Cu(NO3)2 и ZnBr2. Электроды графитовые.
Решение. На катоде возможно протекание следующих процессов:
Cu 2+ + 2e = Cu 
Zn 2+ + 2 e = Zn 
2H2O + 2e ® H2 + 2OH – 
Необходимо учитывать, что выделение водорода протекает со значительным перенапряжением.
Наибольший потенциал у первого процесса, поэтому на катоде будут восстанавливаться ионы меди:
На аноде возможно протекание следующих процессов:
2H2O – 4e = O2 + 4H + 
В прианодном пространстве накапливаются нитрат–ионы.
Суммарное уравнение процесса электролиза можно получить сложением уравнений катодного и анодного процессов:
Сu 2+ + 2Br – = Cu + Br2
Принимая во внимание, что одновременно происходит накопление ионов цинка в прикатодном пространстве и нитрат-ионов в прианодном, итоговое уравнение процесса можно записать так:
Сu(NO3)2 + ZnBr2 = Cu + Br2 + Zn 2+ + 2
Пример 3. Какие процессы будут протекать на железных электродах при электролизе водного раствора Al2(SO4)3 в атмосфере воздуха в нейтральной среде?
В атмосфере воздуха рН »7.
На катоде возможно протекание следующих процессов:
Fe 2+ + 2e = Fe 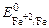
2H2O + 2e ® H2 + 2OH – 
Al 3+ + 3e = Al 
Вследствие того, что выделение водорода сопровождается перенапряжением, наибольший потенциал становится у первого процесса, поэтому на катоде будут восстанавливаться ионы железа: Fe 2+ + 2 e = Fe.
В прикатодном пространстве накапливаются ионы алюминия Al 3+ .
На железном аноде возможно протекание следующих процессов:
Fe – 2e = Fe 2+ 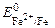


2H2O – 4e = O2 + 4H + 
При электролизе расплава хлорида натрия на электродах протекают процессы
Согласно первому закону Фарадея, время, необходимое для получения 150 г металлического натрия, определяем по формуле

где Mэк.(Na) – молярная масса эквивалента натрия, г/моль; z – число электронов, участвующих в электродном процессе; I – сила тока, А; F – постоянная Фарадея; h – выход по току.
Объем хлора образуется в количестве 1 моль и составляет
Пример 5. Серебрение изделий ведется в растворе азотнокислого электролита с плотностью тока 3 А/дм 3 . Рассчитать толщину серебряного слоя, образующегося за 2 мин, если выход по току h = 0,90. Плотность серебра r = 10 490 кг/м 3 .
Решение. Согласно закону Фарадея, масса выделившегося серебра

После преобразований находим толщину покрытия
где i = I/S – плотность тока; r – плотность металла.
Пример 6. Определите выход по току водорода, выделенного на электроде при нормальных условиях, если объем его составил 112 л при прохождении через электрод 1000 А×ч.
Решение. Объем моль эквивалента водорода при н.у. составляет 22,4/2 = 11,2 л. Для выделения такого объема водорода требуется количество электричества, равное 1F, или 26,8 А×ч., следовательно, для выделения 112 л потребуется 268 А×ч. Найдем выход по току водорода:

Пример 7. При электролизе водного раствора меди сульфата 
Решениезадачи следует начинать с описания объекта изучения – электрохимических реакций. До электролиза в растворе прошли реакции:
а) диссоциация
б) гидролиз
Электрохимическая система: (-) К С 
Процессы на катоде (–) и на аноде (+) А при электролизе:
Определим массу кислорода 
Молярная масса эквивалентов кислорода 
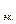
5,6 л 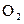
х =
На аноде выделилось 0,28/5,6 = 0,05 моль эквивалентов О2.
Вычислим массу меди 
Согласно второму закону Фарадея:
Пример 8. Через щелочной раствор, содержащий комплексные ионы двух- и четырехвалентного олова, 


Решение. Процессы диссоциации комплексных ионов в растворе:


Электрохимическая система: (–) К: Sn 
Примем, что электроосаждение происходит из ионов Sn 4+ и Sn 2+ :
(–) К: 

“Sn” (+) A: Sn
Масса олова 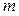
Масса олова 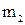
Общая масса выделившегося на катоде олова m:
Видео:уравнения электролизаСкачать

Электронные процессы, происходящие на электродах при электролизе солей
Видео:Number of Ions in MgSO4: Magnesium sulfateСкачать

Решение задач на электролиз солей
Задание 277.
При электролизе растворов MgSO4 и ZnСl2, соединенных последовательно с источником тока, на одном из катодов выделилось 0,25 г водорода. Какая масса вещества выделится на другом катоде; на анодах? Ответ: 8,17 г; 2,0 г; 8,86 г.
Решение:
При электролизе солей растворов MgSO4 и ZnСl2, соединенных последовательно с источником тока, на катоде в растворе MgSO4 будет происходить электрохимическое восстановление воды, а на катоде в растворе ZnСl2 – электрохимическое восстановление ионов цинка, поскольку стандартный электродный потенциал системы Mg 2+ -2 

На анодах будут происходить электрохимические окислительные процессы: в растворе MgSO4 будет протекать окисление воды с образованием водорода, а в растворе ZnСl2 – окисление хлрид-ионов с выделением газообразного хлора, так как стандартные электродные потенциалы систем:
2SO4 2- -2 
2Cl – -2 = Cl2 0 ;
2H2O -4 
соответственно равны -2,01 В; 1,36 В; 1,23 В.
Количества веществ, выделяющихся при электролизе эквивалентны друг другу:
Находим количество эквивалентов водорода, выделившегося на катоде:
m(O2) = (О2) . МЭ(O2) = 0,25 . 8 = 2 г;
m(Zn) = (Zn) . МЭ(Zn) = 0,25 . 32,66 = 8,17 г’
m(Cl2) = (Cl2) . МЭ(Cl2) = 0,25 . 8,86 = 2 г
Ответ: m(Zn) = 8,17 г; 2,0 г; m(Cl2) = 8,86 г.
Задание 278,
Составьте электронные уравнения процессов, происходящих на угольных электродах при электролизе раствора Na2SO4. Вычислите массу вещества, выделяющегося на катоде, если на аноде выделяется 1,12 л газа (н.у.). Какая масса H2SO4 образуется при этом возле анода? Ответ: 0,2 г; 9,8 г.
Решение:
Стандартный электродный потенциал системы Na + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода:
2Н2О — 4 
поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO4 2- — 2 
Суммарно процесс электролиза Na2SO4 можно представить в молекулярной форме:
Количества веществ, выделяющихся при электролизе эквивалентны друг другу:
На аноде выделяется кислород, поэтому количество эквивалентов кислорода равно:
Ответ: m(Н2SO4) = 0,2 г; 9,8 г.
Задание 279.
При электролизе раствора соли кадмия израсходовано 3434 Кл электричества. Выделилось 2 г кадмия. Чему равна молярная масса эквивалента кадмия? Ответ: 56,26 г/моль.
Решение:
Расход электричества, необходимый для проведения электролиза равен: Q = I . t = 3434 Кл. Эквивалентную массу металла рассчитаем из уравнения Фарадея относительно массы вещества и количества электричества, подставив в него данные из задачи, получим:
m(В) = МЭ(В) . I . t/F = МЭ(В) . Q/F
МЭ(Ме) = m(В) . F/Q = (2 . 96500)/3434 = 56,20 г/моль.
Здесь m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Ответ: М Э (Ме) = 56,26 г/моль.
Задание 280.
Составьте электронные уравнения процессов, происходящих на электродах при электролизе раствора КОН. Чему равна сила тока, если в течение 1 ч 15 мин 20 с на аноде выделилось 6,4 г газа? Сколько литров газа (н.у,) выделилось при этом на катоде? Ответ: 17,08 А; 8,96 л.
Решение:
Стандартный электродный потенциал системы К + + 
2Н2О + 2 
На аноде будет происходить электрохимическое окисление ионов ОН-, приводящее к выделению кислорода:
4ОН — 4 
поскольку отвечающий этой системе стандартный электродный потенциал (+0,54 В) значительно ниже, чем стандартный электродный потенциал (+1,23 В), характеризующий систему 2Н2О — 4 
Силу тока вычисляем из уравнения Фарадея относительно массы газа, имея в виду, что 1 ч 15 мин 20 с = 4520 с и m(О2) = 6,4 г, получим:
I = m(О2) . F/ МЭО2) . t = 6,4 . 96500/8 . 4520 = 17,08 A.
При вычислении объёмов выделившихся газов представим уравнение Фарадея в следующем виде:
V = VЭ . I . t/F
Здесь m(B) – масса выделившегося вещества, г; V – объём выделившегося газа, л; m(B) – масса выделившегося вещества, г; VЭ – эквивалентный объём газа, л/моль; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль.
Поскольку при нормальных условиях эквивалентный объём водорода равен 11,2 л/моль, получим:
V(Н2) = (11,2 . 17,08 . 5420)/96500 = 8,96 л
Ответ: V(Н2) = 17,08 А; 8,96 л.
Видео:Электролиз. 10 класс.Скачать

Please wait.
Видео:Электролиз. Часть 2. Уравнения электролиза расплавов и растворов.Скачать

We are checking your browser. gomolog.ru
Видео:Электролиз растворов. 1 часть. 10 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Как писать уравнения электролиза? | Химия ЕГЭ 2022 | УмскулСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 6e2f171ffd2d1610 • Your IP : 85.95.188.35 • Performance & security by Cloudflare
💡 Видео
Электролиз растворов. 2 часть. 10 класс.Скачать

Все об электролизе и задании 20 за 20 минут | Химия ЕГЭ 2023 | УмскулСкачать

Часть 3-2. Электролиз водных растворов. Примеры решений уравнений (подробно).Скачать

Электролиз расплавов и растворов. 10 класс.Скачать

ХИМИЯ 11 класс : Электролиз растворовСкачать

Электролиз растворов. 3 часть. 10 класс.Скачать
Type of Reaction for Mg + H2SO4 = MgSO4 + H2Скачать

Электролиз расплавов и растворов. 1 часть. 10 класс.Скачать

ЭлектролизСкачать

Электролиз раствора KIСкачать

Электролиз. Разбор задания №34 — ХИМИЯ | SKILLVERSEСкачать

Химия / 9 класс / ЭлектролизСкачать

Электролитическая диссоциация кислот, оснований и солей. 9 класс.Скачать

Опыты по химии. Электролиз раствора сульфата натрияСкачать