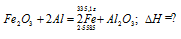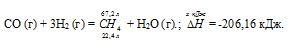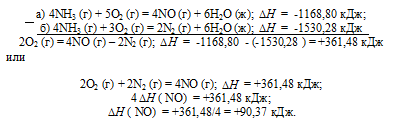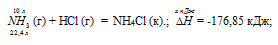ХИМИЯ
Методические указания, контрольные задания по курсу общей химии
для студентов-заочников нехимических специальностей
Составители: Ю.М. Тюрин, А.Д.Самсонова, Т.В. Сазонтьева, О.Н.Ковалева, Ю.В. Батталова
ХИМИЯ: метод. указания, контрольные задания по курсу общей химии для студентов-заочников нехимических специальностей/ НГТУ им.Р.Е.Алексеева; сост.: Ю.М.Тюрин, А.Д.Самсонова и др. Н.Новгород, 2010. 30 с.
Методические указания включают краткое теоретическое введение, примеры решения типовых задач, задания для контрольных работ.
Научный редактор Ю.М.Тюрин
Редактор Э.Б. Абросимова
Подп. к печ. 28.11.10 Формат 60х84 1/16. Бумага газетная. Печать офсетная.
Печ.л. 1,8 . Уч.-изд.л.1,7.Тираж 3000 экз. Заказ .
Нижегородский государственный технический университет им.
Типография НГТУ. 603950, Н.Новгород, ул. Минина, 24.
технический университет им.
Общие методические указания
Химия является не только общетехнической, но и общеобразовательной наукой. Современный инженер любой отрасли хозяйства должен уметь использовать в своей работе достижения химии и активно участвовать в разработке новых материалов и конструкций, формулируя специалистам химикам определенные технические задачи. Задача химической подготовки современного инженера должна заключаться в создании у него химического мышления, помогающего решать вопросы качества и надежности, а также многообразные частные физико-химические проблемы.
Изучение курса химии помогает студенту в освоении специальных дисциплин, служит основой для решения проблем физико-химического направления. Важной составной частью процесса изучения курса химии является лабораторный практикум, развивающий у студентов навыки экспериментирования, исследовательский подход к изучению химии, логическое химическое мышление.
Основной вид учебных занятий студентов-заочников — самостоятельная работа над учебным материалом. По курсу химии она слагается из следующих элементов: изучение материала по учебникам и учебным пособиям; выполнение контрольных заданий; выполнение лабораторного практикума; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу.
Работа с книгой. Изучать курс рекомендуется по темам, предварительно ознакомившись с содержанием каждой из них по программе.
Изучение отдельных глав книги целесообразно проводить в два этапа. При первом чтении создается общее представление о содержании главы и выясняются ее трудные места. При повторном изучении темы усваиваются сущность вопроса, теоретические положения, их приложения, математические зависимости, уравнения химических реакций. Изучение курса должно обязательно сопровождаться выполнением упражнений и решением задач.
Лекции.Перед изучением курса «Химия» студентам читаются установочные лекции по основным разделам.
Консультации. В помощь студентам при изучении дисциплины проводятся плановые консультации. Если у студента возникают затруднения при изучении курса, ему следует обращаться в университет к преподавателю, рецензирующему контрольные работы, или за устной консультацией — к преподавателю университета или УПК.
Контрольные задания.В процессе изучения курса химии студент должен выполнить два контрольных задания. К выполнению контрольной работы можно приступать только тогда, когда будет изучена определенная часть курса и разобраны решения примеров типовых задач, приведенных в каждом разделе.
Решения задач и ответы на теоретические вопросы должны коротко, но четко обоснованы. При решении задач нужно приводить весь ход решения и математические преобразования.
Каждая контрольная работа должна быть аккуратно оформлена; для замечаний рецензента надо оставлять достаточно широкие поля; писать четко и ясно; номера и условия задач переписывать в том порядке, в каком они указаны в задании. Работы должны быть датированы, подписаны студентом и представлены в институт на рецензирование.
Если контрольная работа не зачтена, ее нужно выполнить второй раз в соответствии с указаниями рецензента и выслать на повторное рецензирование. Исправления следует выполнять в конце тетради, а не в рецензированном тексте.
Лабораторные работы. Для глубокого изучения курса химии как науки, основанной на эксперименте, необходимо выполнить лабораторные работы. Студенты, обучающиеся в Н.Новгороде или УПК, выполняют лабораторный практикум параллельно с изучением курса, остальные — в период лабораторно-экзаменационной сессии.
Зачет.Выполнив лабораторный практикум, студенты сдают зачет. Во время сдачи зачета необходимо уметь изложить ход работы, объяснить результаты выполненных опытов и выводы из них, уметь составлять уравнения реакций.
Экзамен.К сдаче экзамена допускаются студенты, которые выполнили контрольные задания и сдали зачет по лабораторному практикуму. Студенты, сдающие экзамен, предъявляют экзаменатору зачетную книжку и зачтенные контрольные работы.
Программа
Контрольные задания
Каждый студент выполняет вариант контрольных заданий, обозначенный двумя последними цифрами номера студенческого билета (шифра). Например, номер студенческого билета 3038524, две последние цифры — 24, им соответствует вариант контрольного задания 24.
Контрольное задание 1
Пример 8.
Для реакции CH3ОН(ж) = CO2(г) + 2H2(г) определите знак изменения энтропии.
Энтропия (S 0 298) – это термодинамическая функция состояния, является мерой неупорядочности системы. Энтропия увеличивается: 1) с ростом температуры; 2) при переходе от твердого состояния к жидкому и от жидкого к газообразному состоянию; 3) в процессах расширения, например, газа; 4) в процессах растворения; 5) в химических реакциях, протекающих с увеличением объема. Наоборот, все процессы, связанные с
увеличением упорядочности (охлаждение, отвердевание, конденсация, сжатие, кристаллизация из растворов, химическая реакция, протекающая с уменьшением объема) сопровождаются уменьшением энтропии. Увеличение или уменьшения объема связано с количеством моль газа. Если в результате реакции увеличивается число моль газообразных веществ, т.е. увеличивается объем, следовательно, и энтропия возрастает (DS 0 х.р.>0), если происходит уменьшение числа моль газа, то DS 0 х.р. 0, следовательно, DS 0 х..р.>0. Т.о. в ходе реакции идет увеличение энтропии системы.
Задачи
1.Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(NH3). Сколько тепла выделится, если в результате реакции образуется 2 моль NH3?
2. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(H2O). Cколько тепла выделится при образовании 1 кг H2O(ж)?
3. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(CH3OH). Сколько тепла выделится, если прореагирует 1 г водорода?
4. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(Cr2O3). Сколько хрома окислилось, если в результате реакции выделилось 11,4 кДж тепла?
5. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(CH3COOH). Сколько грамм и м 3 (н.у.) кислорода пошло на окисление, если выделилось 87,38 кДж тепла?
6. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 сгор.(С6H6). Сколько тепла выделится, если в реакции участвуют 8 г кислорода?
7. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(CuSO4). Сколько тепла выделится, если образуется 16 г сульфата меди?
8. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(SO3.) Сколько тепла выделится, если расходуется 6,4 г серы?
9. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(FeO). Сколько тепла выделится, если образуется 144 г оксида железа?
10. Напишите термохимическое уравнение, соответствующее табличному значению DH 0 обр(KOH). Сколько тепла выделится, если образуется 2,8 г едкого кали?
11. На основании табличных данных DH 0 обр реагентов рассчитать тепловой эффект реакции 2 C(графит) + H2(г) =C2H2(г). Определить к какому типу (экзо- или эндотермическая) она относится.
12.Пользуясь DH 0 обр реагентов, рассчитать тепловой эффект реакции
13. Найти DH 0 х.р , пользуясь табличными значениями DH 0 обр для реакции
14. Пользуясь табличными значениями DH 0 сгор., определить тепловой эффект реакции
Экзо- или эндотермическая это реакция?
15. Рассчитать тепловой эффект реакции C(графит) + 2H2(г) = CH4(г) на основании табличных значений DH 0 сгор. реагентов. С выделением или поглощением тепла протекает данная реакция?
16. Рассчитать количество выделенного тепла, если в процессе алюмотермии, описываемом уравнением 2 Al(к) + Fe2O3(к) = Al2O3(к) + 2Fe(к), прореагировало 2,7 кг алюминия. Необходимые данные взять из таблицы 1.
17. В основе работы медноокисного гальванического элемента лежит суммарная реакция Zn(к) + CuO(к) = ZnO(к) + Cu(к). Сколько тепла выделится или поглотится, если в реакции
участвуют 32,5г цинка?
18. Определить DH 0 х.р для реакции 2 HCl(г) + Ca(к) = CaCl2(к) + H2(г), пользуясь DH 0 обр реагентов. Сколько молей HCl вступило в реакцию, если выделилось 171,75 кДж тепла?
19. Уравнение суммарной реакции, протекающей при получении железа в доменной печи:
Fe2O3(к) + 1,5 C(кокс) = 1,5 CO2(г) + 2 Fe(к). Найти тепловой эффект реакции, пользуясь табличными значениями DH 0 обр. Сколько тепла затрачивается на получение 10 кг железа?
20. Пользуясь табличными значениями DH 0 обр реагентов, найти тепловой эффект реакции 2 Al(к) + Cr2O3(к) =Al2O3(к) + 2Cr(к). Сколько тепла выделилось при образовании 1 г хрома?
21. Сколько тепла поглотится по реакции ZnO(к) + C(графит) = Zn(к) + CO(г), если образуется 1 т цинка?
22. Моноксид углерода СО используют для получения железа из руды по реакции:
Fe2O3(к) + 3 CO(г) = 2 Fe(к) + 3 CO2(г), DH 0 х.р.= —27,43 кДж. Сколько м 3 СО необходимо для получения 1 кг железа, какое количество теплоты при этом выделится?
23. DH 0 сгор. метана СН4 составляет – 890,31 кДж/моль. Почему метан представляет собой лучшее топливо, чем водяной газ (СО + Н2)? Горение водяного газа описывается уравнением CO(г) + H2(г) + O2(г) = CO2(г) + H2O(ж)? Ответ дать на основании расчета.
24. Пользуясь табличными данными DH 0 обр, рассчитать тепловой эффект реакции получения водяного газа С(графит) + H2O(ж) = CO(г)+ H2(г). Экзо- или эндотермическая это реакция?
25. Вычислить DH 0 сгор этилена (С2Н4) на основании энтальпии образования реагентов, учитывая, что продуктами реакции являются CO2(г) и H2O(ж). Какое количество тепла выделится при горении 1 л этилена?
26. Какое количество теплоты выделится при сгорании 1л H2S по реакции
27. Найти DH 0 сгор алмаза, если DH 0 сгор графита = -393,5 кДж/моль, а энтальпия фазового перехода С(графит) → С(алмаз) DH 0 фп =-1,88 кДж/моль.
28. На основании термохимического расчета DH 0 х..р. определите экзо- или эндотермической является реакция 3 SiO2(к) + 4 Al(к) = 2 Al2O3(к) + 3 Si(к).
29. Какое количество теплоты, потребуется на разложение 10 кг карбоната натрия по реакции Na2CO3 (к) = Na2O(к) + CO2(г)?
30.Вычислить энтальпию образования HCl(г), если при взаимодействии 1,12 л водорода с хлором выделяется 9,24 кДж тепла.
31.Вычислить энтальпию образования CO2(г), если известно, что при полном сгорании 1 г углерода выделяется 32,8 кДж тепла.
32.Вычислить энтальпию образования FeO, если при взаимодействии 5,6 г железа с кислородом выделяется 26,5 кДж тепла.
33. Какое количество теплоты выделится при переходе 1 кг красного фосфора в черный по реакции P(красный) → P(черный)?
DH 0 обр(Ркрасный) = -18,41 кДж/моль, DH 0 обр(Рчерный) = -43,2 кДж/моль?
34. При образовании 1 г CCl4 из простых веществ выделяется 0,67 кДж теплоты. Вычислите (DH 0 обр.)ССl4.
35. При окисления 10,8 г серебра выделилось 1,58 кДж тепла. Найти DH 0 обр(Ag2O).
36. Пользуясь табличными значениями DH 0 обр найти DH 0 х.р дляреакции
3Fe(к) + 4 H2O(г) = Fe3O4(к) + 4 H2(г). Определите к какому типу (экзо- или эндотермическая реакция) она относится.
37. На окисление некоторого количества алюминия пошло 10 л (н.у.) кислорода. При этом выделилось 490 кДж тепла. Определить DH 0 обр(Al2O3).
38. При окислении 10 г кальция выделилось 158,8 кДж тепла. Определить DH 0 обр(СаО).
39. Вычислить DH 0 перехода Н2О(ж)® Н2О(г), на основании
следующих термохимических уравнений:
40. На основании табличных значений DG 0 обр реагентов определить возможность самопроизвольного протекания реакции при стандартных условиях. Укажите знак DS 0 х.р. Ответ обоснуйте.
Задачи
41. Равновесие в гетерогенной системе С(графит) + 2 Cl2(г) = CCl4(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [Cl2] = 0,8, [CCl4] =0,3. Рассчитать начальную концентрацию хлора. В каком направлении сместится равновесие в данной системе при увеличении давления?
42. Равновесие в гомогенной системе N2(г) + 3 H2(г) = 2 NH3(г) установилось при следующих концентрациях (моль/л): [N2] = 11; [H2] = 2; [NH3] =3. Вычислить константу равновесия (Кс) и исходные концентрации азота и водорода. В каком направлении сместится равновесие данной реакции при увеличении давления?
43. Равновесие в гомогенной системе 4HCl(г) +O2(г)=2H2O(г)+ 2Cl2(г) установилось при следующих концентрациях (моль/л): [HCl] = 0,25; [O2] =0,3; [H2O] = 0,2; [Cl2] =0,2. Вычислить константу равновесия (Кс) и исходные концентрации HCl и О2. В каком направлении сместится равновесие в данной сиcтеме при уменьшении общего давления?
44. Константа равновесия реакции H2(г) + I2(г) = 2HI(г), DH 0 х.р.=51,8 кДж, Кс = 50. Равновесные концентрации водорода и иода (моль/л) соответственно составляют 1 и 6. Рассчитать начальные концентрации водорода и иода. Какие факторы будут способствовать увеличению равновесной концентрации продукта реакции?
45. Для реакции 2NО2(г) = 2NO(г) + O2(г) рассчитать исходную концентрацию NO2 и константу равновесия (Кс), если равновесие установилось при следующих концентрациях (моль/л): [NO2] =0,2; [NO] = 0,6; [O2] = 0,3. В каком направлении сместится равновесие в данной реакции при увеличении давления в системе? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
46. Равновесие в гетерогенной системе С(графит) + СО2(г) = 2 CО(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [CО2] = 0,6, [CO] = 0,4. Вычислить исходную концентрацию СО2 и константу равновесия Кс. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
47. Константа равновесия реакции С(графит) + 2 Н2(г) = CН4(г) при некоторой температуре Кс=21,3. Рассчитать исходную концентрацию водорода, если равновесная концентрация метана равна 0,1 моль/л. В каком направлении сместится равновесие в данной системе при уменьшении давления?
48. Исходные концентрации CO и Cl2, участвующих в реакции СО(г) + Cl2(г) = CОCl2(г), равны 1 моль/л . Рассчитать равновесные концентрации реагирующих веществ, если к моменту равновесия прореагировало 60% первоначального количества СО. Записать математическое выражение для Кр и Кс и определить совпадают ли они численно.
49. Разложение метана протекает по уравнению:
2CH4(г) = C2H2(г) + 3H2(г). Рассчитайте исходную концентрацию метана, если равновесие установилось при следующих концентрациях реагирующих веществ (моль/л): [CH4] = 0,2; [H2] = 0,3; [C2H2] = 0,1. В каком направлении сместится равновесие в данной реакции при уменьшении объема системы? Записать математическое выражение для Кр и Кс и определить совпадают ли они численно.
50. Дано уравнение реакции H2(г) + I2(г) = 2 HI(г). Сколько HI образуется к моменту равновесия из 2 моль H2 и 1 моль I2, если Кс = 50. В каком направлении сместится равновесие при увеличении давления в системе? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
51. Реакция разложения диоксида азота протекает по уравнению 2NO2(г) = 2 NO(г) + O2(г). Вычислить равновесные концентрации реагирующих веществ, если исходная концентрация NO2 равна 4 моль/л, а к моменту равновесия прореагировало 60% от его первоначального количества. В каком направлении сместится равновесие в данной реакции при увеличении давления в сиcтеме? Записать математическое выражение для Кр и Кс и определить совпадают ли они численно.
52. Рассчитать константу равновесия (Кс) реакции N2(г) + 3H2(г)= 2NH3(г), если исходные
концентрации N2 и H2 соответственно равны 0,4 и 2,24 моль/л и к моменту равновесия прореагировало 20% исходного количества азота. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
53. Рассчитать Кс реакции N2O4(г) = 2 NO2(г), если начальная концентрация N2O4 составляла 0,08 моль/л, а к моменту равновесия прореагировало 50% N2O4. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
54. Константа равновесия (Кс) реакции: СО2(г) + Н2(г) = СО(г) + Н2О(г) при некоторой температуре равна 1. Определить равновесные концентрации реагирующих веществ, если исходные концентрации СО2 и Н2 составляли соответственно 1 и 5 моль/л. Влияете ли изменение давления на смещение равновесия реакции? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
55. Рассчитать Кс реакции 2SO2(г) + O2(г) = 2SO3(г), если начальные концентрации SO2 и O2 (моль/л) соответственно равны 2 и 4 и к моменту равновесия прореагировало 25% исходного количества SO2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
56. Рассчитать Кс реакции CO(г) + Cl2(г) = COCl2(г), если из 2 моль СО и 2 моль Cl2 образовалось к моменту равновесия 0,45 моль COCl2. В каком направлении сместится равновесие в данной реакции при уменьшении объема системы? Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
57. Рассчитать Кс реакции 2H2(г) + S2(г) = 2 H2S(г), если исходные концентрации H2 и S2 составляют соответственно 4 и 3 моль/л и к моменту равновесия прореагировало 70% исходного количества Н2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
58. Для реакции H2(г) + Br2(г) = 2 HBr(г) константа равновесия при некоторой температуре Кс=1. Определить равновесные концентрации реагентов, если исходная смесь состояла из 3 молей водорода и 1 моля брома ( общий объем системы 1 л). Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
59. Рассчитать константу равновесия (Кс) для реакции PCl5(г) = PCl3(г) + Cl2(г), если к моменту равновесия прореагировало 54% PCl5, исходная концентрация которого составляла 2 моль/л. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
60. При некоторой температуре равновесие в системе 2NO2(г) = 2NO(г) + O2(г) установилось при следующих концентрациях: [NO2] = 0,06 моль/л; [NO] = 0,24 моль/л; [O2] = 0,12 моль/л. Найти константу равновесия (Кс) реакции и исходную концентрацию NO2. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
61. Константа равновесия (Кс) реакции FeO(к) + CO(г) = Fe(к) + CO2(г) при некоторой температуре равна 0,5. Найти равновесные концентрации СО и СО2, если исходная концентрация СО составляла 0,8 моль/л. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
62. Рассчитать равновесные концентрации веществ и константу равновесия Кс для реакции С2Н6(г) = С2Н4(г) + Н2(г), если исходная концентрация этана составляла 2 моль/л и к моменту равновесия прореагировало 50% исходного количества. Записать математическое выражение Кр и определить совпадают ли Кр и Кс численно.
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) указать, как влияют на концентрацию водорода в равновесной смеси: а) увеличение давления; б) увеличение концентрации водяного пара?
64. Для реакции CaCO3(к) = CO2(г) + CaO(к), DH 0 х.р. =277,4 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияют на концентрацию диоксида углерода в равновесной смеси: а) увеличение температуры; б) уменьшение давления?
65. Для реакции 4HCl(г) + O2(г) = 2 H2O(г) + 2Cl2(г), DH 0 х.р. =-88 кДж;
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, в каком направлении сместится равновесие при: а) увеличении давления; б) увеличении концентрации водяного пара; в) введении катализатора?
66. Для реакции Ag2O(к) = 2Ag(к) + 0,5O2(г), DH 0 х.р.= 31,15 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования кислорода сдвигается равновесие при: а) уменьшении давления; б) увеличении температуры; в) увеличении весового количества Ag2O?
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияют на концентрацию водяного пара в равновесной смеси: а) повышение температуры; б) увеличение концентрации водорода; в) введение катализатора.
68. Для реакции C(графит) + CO2(г) = 2CO(г), DH 0 х.р.=172,6 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияет на концентрацию оксида углерода (IV); а) повышение давления; б) увеличение весового количества графита; в) увеличение концентрации оксида углерода (II).
69. Для реакции C(графит) + 2H2(г) = CH4(г), DH 0 х.р. = —74,86кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, как влияет на концентрацию метана в равновесной смеси: а) повышение температуры; б) увеличение концентрации водорода; в) введение катализатора.
70. Для реакции С(графит) + О2(г) = СО2(г), DH 0 х.р. = —393,8 кДж,
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) Указать, в каком направлении смещается равновесие в системе при: а) нагревании; б) увеличении весового количества графита; в) увеличении концентрации кислорода.
71. Для реакции синтеза аммиака N2(г) + 3H2(г) = 2NH3(г), DH 0 х.р. = —92,4 кДж
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования аммиака сдвигается равновесие при: а) увеличении давления; б) увеличении концентрации водорода; в) введении катализатора.
1) Написать математические выражения константы равновесия Кс и Кр и установить взаимосвязь между ними;
2) В сторону расходования или образования хлора сдвигается равновесие при: а) увеличении концентрации диоксида серы;
б) увеличении температуры; в) введении катализатора.
Реакции ионного обмена
Для растворов электролитов наиболее характерны реакции ионного обмена. Обязательным условием протекания таких реакций практически до конца является удаление из раствора тех или иных ионов в следствие:
Образования осадка
FeSO4 + 2 NaOH ® Fe(OH )2¯ + Na2SO4 — молекулярное уравнение (МУ)
Fe 2+ +SO4 2- +2Na + +2OH — ®Fe(OH)2¯+2Na + +SO4 2— ионно-молекулярное уравнение (ИМУ).
Fe 2+ +2OH — ® Fe(OH)2¯ ПР (Fе(OH)2) = 4,8×10 -16 – краткое ионно-молекулярное уравнение образования осадка;
Выделение газа
Угольная кислота является нестойкой, поэтому она разлагается:
2H + + CO3 2- ® H2O + CО2 — ионно-молекулярное уравнение образования летучего соединения и слабого электролита Н2О.
Задачи
77.Будут ли протекать реакции между растворами следующих электролитов:
1) K2CO3 и HCl; 2) KNO3 и Na2S; 3) CdSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
78. С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: при смешении растворов каких солей можно получить в осадке карбонат кальция?
79. Будут ли протекать реакции между растворами следующих электролитов: Ba(OH)2 и HNO3; 2) (NH4)2SO4 и KOH; 3) CuSO4 и NaOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
80.С помощью молекулярных и ионно-молекулярных уравнений ответить на вопрос: растворы каких солей надо смешать для получения в осадке сульфата бария?
81. Написать молекулярные и ионно-молекулярные уравнения реакций между растворами следующих электролитов:
1) сульфита натрия и серной кислоты; 2) хлорида цинка и гидроксида натрия; 3) карбоната калия и соляной кислоты.
82. Написать молекулярные и ионно-молекулярные уравнения реакций: 1) растворения сульфида железа (II) в соляной кислоте; 2) взаимодействия сульфата кадмия и гидроксида натрия; 3) растворения гидроксида алюминия в избытке раствора щелочи.
83. Можно ли приготовить раствор, содержащий одновременно следующие пары веществ: 1) CuSO4 и NaNO3; 2) Na2CO3 и HCl; 3) AgNO3 и NaCl? Ответ обосновать с помощью молекулярных и ионно-молекулярных уравнений.
84. Смешивают попарно растворы: 1) NaOH и HNO3; 2) K2CO3 и HCl; 3) CuSO4 и KOH. В каких случаях протекают реакции? Составить их молекулярные и ионно-молекулярные уравнения.
85. Написать уравнения реакций между растворами следующих электролитов: 1) К2CO3 и НСl; 2) AgNO3 и K2CrO4; 3) Zn(OH)2 и KOH(избыток).
86. Будут ли протекать реакции между растворами следующих электролитов: Na2SO4 и BaCl2; 2) NaHCO3 и NaOH; 3) Pb(NO3)2 и KOH? Написать молекулярные и ионно-молекулярные уравнения возможных реакций.
87. Смешивают попарно растворы следующих электролитов: 1) NaOH и HCl; 2) K2SО3 и HCl; 3) H2SO4 и CH3COONa. Какие из реакций протекают практически до конца? Составить молекулярные и ионно-молекулярные уравнения соответствующих реакций.
88. Составить молекулярные и ионно-молекулярные уравнения реакций, происходящих в растворах между: 1) сероводородом и сульфатом никеля (II); 2) гидрокарбонатом и гидроксидом калия; 3) хлоридом аммония и гидроксидом калия.
89. Написать молекулярные и ионно-молекулярные уравнения реакций нейтрализации:
1) HCl + Ba(OH)2; 2) Fe(OH)2 + HNO3; 3) H2S + NaOH. Указать какие из этих реакций протекают обратимо.
90. Написать молекулярные и ионно-молекулярные уравнения реакций, протекающих в растворах между: 1) Na2SO3 и HCl; 2) Cr2(SO4)3 и KOH; 3) Na2CrO4 и AgNO3. Указать в каждом случае соединение, образование которого вызывает смещение равновесия.
91. Составить молекулярные уравнения к следующим ионно-молекулярным уравнениям:
Видео:Тепловой эффект реакции. ЗадачиСкачать

Напишите термохимическое уравнение, соответствующее табличному значению ( ) Hобр Cr2O3 .
| 🎓 Заказ №: 22201 |
| ⟾ Тип работы: Задача |
| 📕 Предмет: Химия |
| ✅ Статус: Выполнен (Проверен преподавателем) |
| 🔥 Цена: 153 руб. |
👉 Как получить работу? Ответ: Напишите мне в whatsapp и я вышлю вам форму оплаты, после оплаты вышлю решение.
➕ Как снизить цену? Ответ: Соберите как можно больше задач, чем больше тем дешевле, например от 10 задач цена снижается до 50 руб.
➕ Вы можете помочь с разными работами? Ответ: Да! Если вы не нашли готовую работу, я смогу вам помочь в срок 1-3 дня, присылайте работы в whatsapp и я их изучу и помогу вам.
⚡ Условие + 37% решения:
Напишите термохимическое уравнение, соответствующее табличному значению ( ) Hобр Cr2O3 . Сколько хрома окислилось, если в результате реакции выделилось 11,4 кДж тепла?
Решение: Стандартной энтальпией образования химического соединения называют стандартное изменение энтальпии реакции образования одного моля этого вещества из простых веществ, взятых в том агрегатном состоянии, в котором они находятся при стандартных условиях и данной температуре. Термохимическим называется уравнение реакции, в котором после формул химических соединений в скобках указываются их агрегатные состояния или кристаллические модификации. В конце термохимического уравнения приводится значение теплового эффекта, отделенное запятой или точкой с запятой. Термохимическое уравнение данной реакции будет иметь вид 2Cr(к) 1,5O2(г) Cr2O3(к) ; Hх . р. 1128 кДж
Научись сам решать задачи изучив химию на этой странице:
|
Услуги:
|
Готовые задачи по химии которые сегодня купили:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Видео:Решение задач на термохимические уравнения. 8 класс.Скачать

Как рассчитать количество теплоты, тепловой эффект и теплоту образования
Видео:Химия | Тепловой эффект химической реакции (энтальпия)Скачать

Количество теплоты
Задание 81.
Вычислите количество теплоты, которое выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. Ответ: 2543,1 кДж.
Решение:
Уравнение реакции:
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:



Вычисление количества теплоты, которое выделяется при получении 335,1 г железа, про-изводим из пропорции:
(2 . 55,85) : -847,7 = 335,1 : х; х = (0847,7 . 335,1)/ (2 . 55,85) = 2543,1 кДж,
где 55,85 атомная масс железа.
Ответ: 2543,1 кДж.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Тепловой эффект реакции
Задание 82.
Газообразный этиловый спирт С2Н5ОН можно получить при взаимодействии этилена С2Н4 (г) и водяных паров. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Ответ: -45,76 кДж.
Решение:
Уравнение реакции имеет вид:
С2Н4 (г) + Н2О (г) = С2Н5ОН (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Рассчитаем тепловой эффект реакции, используя следствие из закона Гесса, получим:




= -235,1 -[(52,28) + (-241,83)] = — 45,76 кДж
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы 

Если в результате реакции выделяется теплота, то
Ответ: — 45,76 кДж.
Задание 83.
Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
Решение:
Уравнение реакции восстановления оксида железа (II) водородом имеет вид:
ЕеО (к) + Н2 (г) = Fe (к) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:



Теплота образования воды определяется уравнением
а теплоту образования оксида железа (II) можно вычислить, если из уравнения (б) вычесть уравнение (а).




Ответ: +27,99 кДж.
Задание 84.
При взаимодействии газообразных сероводорода и диоксида углерода образуются пары воды и сероуглерод СS2 (г). Напишите термохимическое уравнение этой реакции, предварительно вычислите ее тепловой эффект. Ответ: +65,43 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — жидкое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:






Термохимическое уравнение будет иметь вид:
2H2S (г) + CO2 (г) = 2Н2О (г) + СS2 (г); 
Ответ: +65,43 кДж.
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Tермохимическое уравнение реакции
Задание 85.
Напишите термохимическое уравнение реакции между СО (г) и водородом, в результате которой образуются СН4 (г) и Н2О (г). Сколько теплоты выделится при этой реакции, если было получено 67,2 л метана в пересчете на нормальные условия? Ответ: 618,48 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие сокращенные обозначения агрегатного состояния вещества: г — газообразное, ж — кое, к — кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
СО (г) + 3Н2 (г) = СН4 (г) + Н2О (г); 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствии е из закона Гесса:





Термохимическое уравнение будет иметь вид:
22,4 : -206,16 = 67,2 : х; х = 67,2 (-206,16)/22?4 = -618,48 кДж; Q = 618,48 кДж.
Ответ: 618,48 кДж.
Теплота образования
Задание 86.
Тепловой эффект какой реакции равен теплоте образования. Вычислите теплоту образования NO, исходя из следующих термохимических уравнений:
а) 4NH3 (г) + 5О2 (г) = 4NO (г) + 6Н2O (ж); 
б) 4NH3 (г) + 3О2 (г) = 2N2 (г) + 6Н2O (ж); 
Ответ: 90,37 кДж.
Решение:
Стандартная теплота образования равна теплоте реакции образования 1 моль этого вещества из простых веществ при стандартных условиях (Т = 298 К; р = 1,0325 . 105 Па). Образование NO из простых веществ можно представить так:
Дана реакция (а), в которой образуется 4 моль NO и дана реакция (б), в которой образуется 2 моль N2. В обеих реакциях участвует кислород. Следовательно, для определения стандартной теплоты образования NO составим следующий цикл Гесса, т. е. нужно вычесть уравнение (а) из уравнения (б):
Таким образом, 1/2N2 + 1/2O2 = NO; 
Ответ: 618,48 кДж.
Задание 87.
Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлороводорода. Напишите термохимическое уравнение этой реакции, предварительно вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на нормальные условия? Ответ: 78,97 кДж.
Решение:
Уравнения реакций, в которых около символов химических соединений указываются их агрегатные состояния или кристаллическая модификация, а также числовое значение тепловых эффектов, называют термохимическими. В термохимических уравнениях, если это специально не оговорено, указываются значения тепловых эффектов при постоянном давлении Qp равные изменению энтальпии системы . Значение приводят обычно в правой части уравнения, отделяя его запятой или точкой c запятой. Приняты следующие кое, к —- кристаллическое. Эти символы опускаются, если агрегатное состояние веществ очевидно, например, О2, Н2 и др.
Уравнение реакции имеет вид:
NH3 (г) + НCl (г) = NH4Cl (к).; 
Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствиие из закона Гесса:





Термохимическое уравнение будет иметь вид:
Теплоту, выделившуюся при реакции 10 л аммиака по этой реакции, определим из про-порции:
22,4 : -176,85 = 10 : х; х = 10 (-176,85)/22,4 = -78,97 кДж; Q = 78,97 кДж.
💥 Видео
78. Тепловой эффект реакции. Термохимические уравнения (часть 1)Скачать

Задачи на ТЕПЛОВОЙ ЭФФЕКТ | Термохимические уравненияСкачать

Термохимическое уравнение | ХимияСкачать

Химия ЦТ | Задачи по термохимическим уравнениямСкачать

Тепловой эффект хим. реакции. Энтальпия. Закон Гесса. Капучинка ^-^Скачать

Термохимические уравнения. Решение задач из ЕГЭ на тепловой эффект.Скачать

Задача на термохимические уравнения: разбор задания 27 | ХИМИЯ ЕГЭ 2022Скачать

Решение задач по термохимическим уравнениям. Практическое занятие. Видеоурок 40. Химия 9 классСкачать

79. Тепловой эффект реакции. Термохимические уравнения (часть 2)Скачать

Решение задач по теме «Расчеты по термохимическим уравнениям». 9 и 11 класс.Скачать

Энтальпия реакции. Решение задачи.Скачать

Термохимические реакции. Практическая часть - решение задачи. 9 класс.Скачать

термохимическое уравнениеСкачать

Решение задач на первое начало термодинамики. ТермохимияСкачать

Решение задач по термохимическим уравнениям реакций, 8 классСкачать