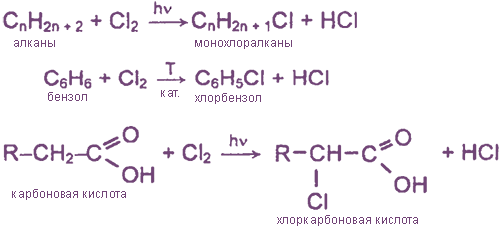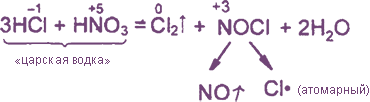- We are checking your browser. gomolog.ru
- Why do I have to complete a CAPTCHA?
- What can I do to prevent this in the future?
- Физические свойства
- Способы получения
- Промышленный
- Лабораторные
- Химические свойства
- Реакции с металлами
- Реакции с неметаллами
- Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
- Диспропорционирование хлора в воде и водных растворах щелочей
- Взаимодействие хлора с органическими веществами
- Хлороводород и соляная кислота
- Газообразный хлороводород
- Физические и химические свойства
- Способы получения
- Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
- Химические свойства соляной кислоты
- Реакции с органическими соединениями
- Оксиды и оксокислоты хлора
- Соединения хлора: решение задач методом электронного баланса
- Уравнения окислительно-восстановительных реакций соединений хлора
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 1 ч. 9 класс.Скачать

We are checking your browser. gomolog.ru
Видео:Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 70063b6ebe130b4f • Your IP : 178.45.155.83 • Performance & security by Cloudflare
Видео:Как решать задачи по химии? Расчет по уравнениям химических реакций | TutorOnlineСкачать

Физические свойства
Cl2 при об. Т — газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха — в 2,5 раза, малорастворим в воде (
6,5 г/л); х. р. в неполярных органических растворителях. В свободном виде встречается только в вулканических газах.
Видео:Решение задач по уравнениям реакций, если одно из реагирующих веществ взято в избытке. 3 ч. 9 класс.Скачать

Способы получения
Основаны на процессе окисления анионов Cl —
2Cl — — 2e — = Cl2 0
Видео:Реакции ионного обмена. 9 класс.Скачать

Промышленный
Электролиз водных растворов хлоридов, чаще — NaCl:
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Лабораторные
Окисление конц. HCI различными окислителями:
Видео:Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Химические свойства
Хлор — очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl — :
Видео:Разбор всех типов 29-30 заданий из сборника Добротина 2023 | Екатерина СтрогановаСкачать

Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлориды металлов.
Малоактивные металлы легче окисляются влажным хлором или его водными растворами:
Видео:Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Реакции с неметаллами
Хлор непосредственно не взаимодействует только с O2, N2, С. С остальными неметаллами реакции протекают при различных условиях.
Образуются галогениды неметаллов. Наиболее важной является реакция взаимодействия с водородом.
Видео:Реакции ионного обмена. 9 класс.Скачать

Вытеснение свободных неметаллов (Вr2, I2, N2, S) из их соединений
Видео:ТИПОВЫЕ ЗАДАЧИ ПО ХИМИИ: Химическое Количество Вещества, Моль, Молярная Масса и Молярный ОбъемСкачать

Диспропорционирование хлора в воде и водных растворах щелочей
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl — , а другие в положительной степени окисления входят в состав анионов ClO — или ClO3 — .
Cl2 + Н2O = HCl + НClO хлорноватистая к-та
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора:
КClO3 и Са(ClO)2 — гипохлориты; КClO3 — хлорат калия (бертолетова соль).
Видео:Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Взаимодействие хлора с органическими веществами
а) замещение атомов водорода в молекулах ОВ
б) присоединение молекул Cl2 по месту разрыва кратных углерод-углеродных связей
Хлороводород и соляная кислота
Видео:Диссоциация электролитов в водных растворах. Видеоурок 39. Химия 9 классСкачать

Газообразный хлороводород
Видео:ХИМИЧЕСКИЕ УРАВНЕНИЯ | Как составлять уравнения реакций | Химия 8 классСкачать

Физические и химические свойства
HCl — хлорид водорода. При об. Т — бесцв. газ с резким запахом, достаточно легко сжижается (т. пл. -114°С, т. кип. -85°С). Безводный НСl и в газообразном, и в жидком состояниях неэлектропроводен, химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Это означает, что в отсутствие воды хлороводород не проявляет кислотных свойств. Только при очень высокой Т газообразный HCl реагирует с металлами, причем даже такими малоактивными, как Сu и Аg.
Восстановительные свойства хпорид-аниона в HCl также проявляются в незначительной степени: он окисляется фтором при об. Т, а также при высокой Т (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
Газообразный HCl широко используется в органическом синтезе (реакции гидрохлорирования).
Видео:МАРАФОН ПО ХИМИИ | ОВР С СОЕДИНЕНИЯМИ ГАЛОГЕНОВ | ХИМИЯ ЕГЭ 2023| ТОПСКУЛСкачать

Способы получения
1. Синтез из простых веществ:
2. Образуется как побочный продукт при хлорировании УВ:
R-H + Cl2 = R-Cl + HCl
3. В лаборатории получают действием конц. H2SO4 на хлориды:
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4 (при слабом нагревании)
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4 (при очень сильном нагревании)
Видео:Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

Водный раствор HCl — сильная кислота (хлороводородная, или соляная)
HCl очень хорошо растворяется в воде: при об. Т в 1 л Н2O растворяется
450 л газа (растворение сопровождается выделением значительного количества тепла). Насыщенный раствор имеет массовую долю HCl, равную 36-37 %. Такой раствор имеет очень резкий, удушающий запах.
Молекулы HCl в воде практически полностью распадаются на ионы, т. е. водный раствор HCl является сильной кислотой.
Видео:9 класс. Галогены. Решение упражнений и задач.Скачать

Химические свойства соляной кислоты
1. Растворенный в воде HCl проявляет все общие свойства кислот, обусловленные присутствием ионов Н +
а) с металлами (до Н):
б) с основными и амфотерными оксидами:
в) с основаниями и амфотерными гидроксидами:
г) с солями более слабых кислот:
Реакции с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. Анион Cl — окисляется до свободного галогена:
2Cl — — 2e — = Cl2 0
Уравнения реакция см. «Получение хлора». Особое значение имеет ОВР между соляной и азотной кислотами:
Видео:Разбор Варианта №21 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать

Реакции с органическими соединениями
а) с аминами (как органическими основаниями)
б) с аминокислотами (как амфотерными соедимнеиями)
Оксиды и оксокислоты хлора
Кислородсодержащие соединения хлора — чрезвычайно неустойчивые вещества, так как включают атомы Cl в нестабильных положительных с. о. Тем не менее некоторые из них имеют важное практическое значение.
Видео:Разбор Варианта №1 из Сборника Добротина 2023 | Екатерина СтрогановаСкачать

Соединения хлора: решение задач методом электронного баланса
Подробно решение уравнений окислительно-восстановительных реакций (ОВР) методом электронного баланса разобраны на странице «Метод электронного баланса».
Ниже приведены примеры решения уравнений окислительно-восстановительных реакций соединений хлора:
Если в окислительно-восстановительной реакции принимают участие простые вещества, молекулы которых состоят из двух или более атомов элементов, то в электронном балансе кол-во отданных и полученных электронов определяют с учётом кол-ва атомов в молекуле: H2 0 -2e — → 2H +1 .
Уравнения окислительно-восстановительных реакций соединений хлора
1. Уравнение реакции соляной кислоты с кислородом (HCl+O2):
2. Уравнение реакции соляной кислоты с перманганатом калия (HCl+KMnO4):
Следует обратить внимание, что часть хлорид-ионов соляной кислоты окисляется до хлора, а другая часть переходит в состав молекул хлорида калия и хлорида магния без изменения своей степени окисления, поэтому, коэффициенты в первую очередь ставятся перед Cl2, KCl, MnCl2 и только потом, перед HCl.
3. Уравнение реакции соляной кислоты с хромом на воздухе (HCl+Cr):
4. Уравнение реакции соляной кислоты с манганатом калия (HCl+K2MnO4):
5. Уравнение реакции разбавленной соляной кислоты с кальцием (HCl+Ca):
6. Уравнение реакции разбавленной соляной кислоты с гидридом кальция с образованием хлорида кальция и водорода:
7. Уравнение реакции хлорида кальция с водородом с образованием гидрида кальция и соляной кислоты:
8. Уравнение реакции хлорида железа (II) с водородом с образованием железа и соляной кислоты:
9. Уравнение реакции хлорида железа с хлором в нейтральной среде с образованием метагидроксида железа и соляной кислоты:
10. Уравнение реакции окисления на воздухе хлорида железа (III):
11. Уравнение реакции хлорида железа (III) с водородом с образованием хлорида железа (II) и соляной кислоты:
12. Уравнение реакции хлорида меди с алюминием с образованием хлорида алюминия и меди:
13. Уравнение реакции хлорида аммония с нитратом калия с образованием оксида азота, хлорида калия и воды:
14. Уравнение реакции хлорида аммония с магнием с образованием хлорида магния, аммиака и водорода:
15. Уравнение реакции разложения гипохлорита натрия с образованием хлората и хлорида натрия:
16. Уравнение реакции разложения хлората калия с образованием хлорида калия и кислорода:
17. Уравнение реакции хлората калия с алюминием:
18. Уравнение реакции хлората калия с концентрированной соляной кислотой:
19. Уравнение реакции хлората калия с концентрированной серной кислотой:
20. Уравнение реакции хлората калия с серой:
21. Уравнение реакции хлората калия с красным фосфором:
22. Уравнение реакции хлората калия с гидридом кальция:
23. Уравнение реакции разложения хлорной кислоты:
24. Уравнение реакции разложения перхлората калия:
25. Уравнение реакции разложения хлорита натрия:
26. Уравнение реакции гипохлорита кальция с пероксидом водорода:
27. Уравнение реакции хлорноватистой кислоты с иодоводородом:
28. Уравнение реакции разложения оксида хлора (I):
29. Уравнение реакции разложения диоксида хлора при нагревании (сопровождается большим выделением тепла — взрывом):
30. Уравнение реакции диоксида хлора с гидроксидом калия:
31. Уравнение реакции диоксида хлора с озоном:
32. Уравнение реакции диоксида хлора с пероксидом водорода:
33. Уравнение реакции дихлоргексаоксида с гидроксидом калия:
34. Уравнение реакции разложения оксида хлора (VII):
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе