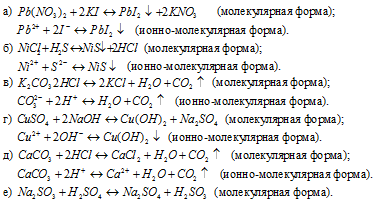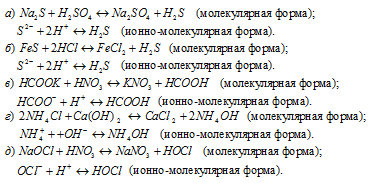Вопрос по химии:
Ba(OH)2 + H2S = BaS + H2O
Напишите сокращенное ионное уравнение из реакции
Трудности с пониманием предмета? Готовишься к экзаменам, ОГЭ или ЕГЭ?
Воспользуйся формой подбора репетитора и занимайся онлайн. Пробный урок — бесплатно!
Ответы и объяснения 1
Знаете ответ? Поделитесь им!
Как написать хороший ответ?
Чтобы добавить хороший ответ необходимо:
- Отвечать достоверно на те вопросы, на которые знаете правильный ответ;
- Писать подробно, чтобы ответ был исчерпывающий и не побуждал на дополнительные вопросы к нему;
- Писать без грамматических, орфографических и пунктуационных ошибок.
Этого делать не стоит:
- Копировать ответы со сторонних ресурсов. Хорошо ценятся уникальные и личные объяснения;
- Отвечать не по сути: «Подумай сам(а)», «Легкотня», «Не знаю» и так далее;
- Использовать мат — это неуважительно по отношению к пользователям;
- Писать в ВЕРХНЕМ РЕГИСТРЕ.
Есть сомнения?
Не нашли подходящего ответа на вопрос или ответ отсутствует? Воспользуйтесь поиском по сайту, чтобы найти все ответы на похожие вопросы в разделе Химия.
Трудности с домашними заданиями? Не стесняйтесь попросить о помощи — смело задавайте вопросы!
Химия — одна из важнейших и обширных областей естествознания, наука о веществах, их составе и строении, их свойствах, зависящих от состава и строения, их превращениях, ведущих к изменению состава — химических реакциях, а также о законах и закономерностях, которым эти превращения подчиняются.
Видео:Химия | Молекулярные и ионные уравненияСкачать

Cоставление ионно-молекулярных форм уравнений реакций
Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Please wait.
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

We are checking your browser. gomolog.ru
Видео:Реакции ионного обмена. 9 класс.Скачать

Why do I have to complete a CAPTCHA?
Completing the CAPTCHA proves you are a human and gives you temporary access to the web property.
Видео:BaCl2+KOH=Ba(OH)2+KCl Ионное и молекулярное уравнения реакции, демонстрация.Скачать

What can I do to prevent this in the future?
If you are on a personal connection, like at home, you can run an anti-virus scan on your device to make sure it is not infected with malware.
If you are at an office or shared network, you can ask the network administrator to run a scan across the network looking for misconfigured or infected devices.
Another way to prevent getting this page in the future is to use Privacy Pass. You may need to download version 2.0 now from the Chrome Web Store.
Cloudflare Ray ID: 708835111f8f975e • Your IP : 85.95.179.80 • Performance & security by Cloudflare
Видео:Реакции ионного обменаСкачать

Напишите молекулярные и ионные уравнения реакций нейтрализации ba oh 2 h2s
2. ПРИМЕРЫ РЕШЕНИЯ ЗАДАНИЙ
Задание 1. Запишите в молекулярной и ионно-молекулярной формах уравнения реакций между веществами: а) H2S + Ba(OH)2 → . ; б) Pb(NO3)2 + H2SO4 → . .
а) реакция между раствором сероводородом и гидроксидом бария относится к типу реакций ионного обмена. Поэтому в образующихся соединениях положительно заряженный ион из одного исходного вещества соединяется с отрицательно заряженным ионом из другого. Молекулярное уравнение реакции
В ионно-молекулярном уравнении сильные электролиты должны быть записаны в виде ионов, а слабые – в виде молекул. Слабо диссоциирующими веществами в этой реакции являются раствор сероводорода и вода. Поэтому ионно-молекулярное уравнение реакции имеет вид
H2S + Ba 2+ + 2OH – 
В сокращенном ионно-молекулярном уравнении должны быть исключены одинаковые частицы, находящиеся в левой и правой частях полного ионно-молекулярного уравнения, т.е. ионы, которые не претерпевают изменений в ходе реакции. В данном случае это ионы Ba 2+ . Сокращенное ионно-молекулярное уравнение реакции
H2S + 2OH – 
б) реакция между нитратом свинца и серной кислотой относится к типу реакций ионного обмена. Поэтому в образующихся соединениях положительно заряженный ион из одного исходного вещества соединяется с отрицательно заряженным ионом из другого. Молекулярное уравнение реакции
Слабо диссоциирующим веществом в этой реакции является сульфат свинца (малорастворимая соль, выпадающая в осадок, см. таблицу растворимости). Поэтому ионно-молекулярное уравнение реакции имеет вид
В сокращенном ионно-молекулярном уравнении должны быть исключены одинаковые частицы, находящиеся в левой и правой частях полного уравнения, т.е. ионы, которые не претерпевают изменений в ходе реакции. В данном случае это ионы NO3 – и H + . Сокращенное ионно-молекулярное уравнение реакции
Задание 2 . Определите, какие из солей подвергаются гидролизу ( Na 3 PO 4 , ZnSO 4, RbCl )? Cоставьте ионно-молекулярные и молекулярные уравнения реакций гидролиза солей. Укажите реакцию среды. Какое значение рН имеют растворы этих солей?
Соль ортофосфат натрия ( Na 3 PO 4 ) образована сильным основанием NaOH и слабой кислотой H 3 PO 4 . Следовательно, гидролиз этой соли протекает по аниону соли.
При растворении в воде Na 3 PO 4 диссоциирует
Na 3 PO 4 
В данном случае ионы PO 4 3- связывают катион H + , образуя ион H PO 4 2- . Ионно-молекулярное уравнение гидролиза
PO 4 3- + H2O 
Уравнение гидролиза в молекулярной форме
Na 3 PO 4 + H2O 
Практически гидролиз соли ограничивается первой ступенью с образованием кислой соли (в данном случае Na 2 H PO 4 ). Избыток ионов OH – в растворе обусловливает щелочную реакцию среды в растворе (pН>7).
Соль сульфат цинка ( ZnSO 4 ) образована слабым основанием Zn ( OH )2 и сильной кислотой H 2 SO 4 . Гидролиз этой соли протекает по катиону соли.
При растворении в воде ZnSO 4 диссоциирует
ZnSO 4 
В данном случае ионы Zn 2+ соединяются с ионами OH – , образуя гидроксоионы Zn OH + . Гидролиз соли ограничивается первой ступенью, и образование молекулы Zn (OH)2 не происходит. Ионно-молекулярное уравнение имеет вид
Zn 2+ + HOH 
В данном случае продуктами гидролиза являются основная соль и кислота. Уравнение гидролиза в молекулярной форме записывается следующим образом
2ZnSO4+ 2H2O 
Избыток ионов H + в растворе обусловливает кислую реакцию среды в растворе (рН
C оль RbCl образована сильным основанием RbOH и сильной кислотой HCl . Эта соль не подвергается гидролизу, т.к. единственным малодиссоциирующим соединением является H2O. Раствор соли имеет нейтральную среду (рН=7).
💥 Видео
Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Реакция ионного обмена. Полное и сокращенное ионное уравнение. Практика. Видеоурок 39. Химия 9 классСкачать

Ионные уравненияСкачать

Решение цепочек превращений по химииСкачать

Реакции ионного обмена. 9 класс.Скачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

ОВР и Метод Электронного Баланса — Быстрая Подготовка к ЕГЭ по ХимииСкачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Гидролиз солей. 9 класс.Скачать

Классификация реакций: ионные и радикальные реакцииСкачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать