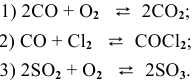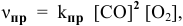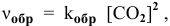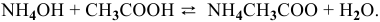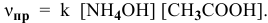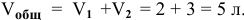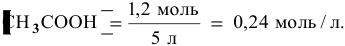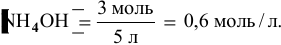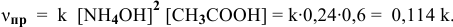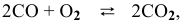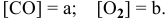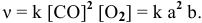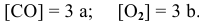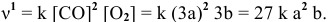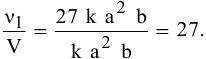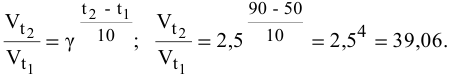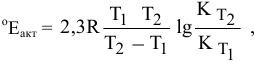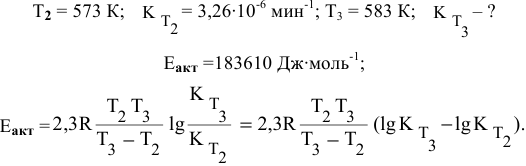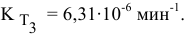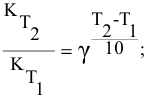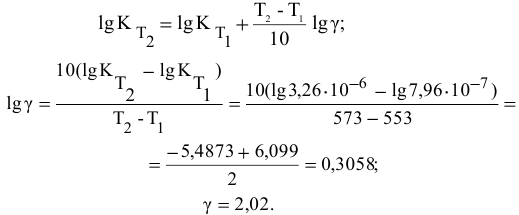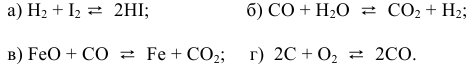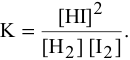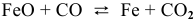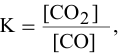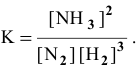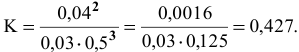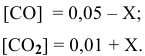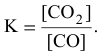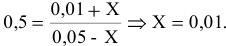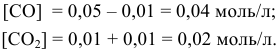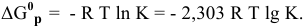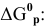Темы кодификатора ЕГЭ: Скорость реакции. Ее зависимость от разных факторов.
Скорость химической реакции показывает, как быстро происходит та или иная реакция. Взаимодействие происходит при столкновении частиц в пространстве. При этом реакция происходит не при каждом столкновении, а только когда частица обладают соответствующей энергией.
Скорость реакции – количество элементарных соударений взаимодействующих частиц, заканчивающихся химическим превращением, за единицу времени.
Определение скорости химической реакции связано с условиями ее проведения. Если реакция гомогенная – т.е. продукты и реагенты находятся в одной фазе – то скорость химической реакции определяется, как изменение концентрации вещества в единицу времени:
υ = ΔC / Δt
Если реагенты, или продукты находятся в разных фазах, и столкновение частиц происходит только на границе раздела фаз, то реакция называется гетерогенной, и скорость ее определяется изменением количества вещества в единицу времени на единицу реакционной поверхности:
υ = Δν / (S·Δt)
- Факторы, влияющие на скорость химической реакции
- 1. Температура
- 2. Концентрация
- 3. Давление
- 4. Катализатор
- 5. Площадь соприкосновения реагирующих веществ
- 6. Природа реагирующих веществ
- Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция? Номер варианта 17
- Описание и исходные данные задания, 50% решения + фотография:
- Задачи с решениями на химическую кинетику и химическое равновесие
- Химическая кинетика и химическое равновесие
- Пример 59
- Задача 43
- Задача 44
- Задача 45
- Задача 46
- Задача 47
- Задача 48
- Задача 49
- Задача 50
- Задача 51
- 📹 Видео
Видео:Скорость химических реакций. 9 класс.Скачать

Факторы, влияющие на скорость химической реакции
Видео:Влияние концентрации на скорость химических реакций. 10 класс.Скачать

1. Температура
Самый простой способ изменить скорость реакции – изменить температуру . Как вам, должно быть, известно из курса физики, температура – это мера средней кинетической энергии движения частиц вещества. Если мы повышаем температуру, то частицы любого вещества начинают двигаться быстрее, а следовательно, сталкиваться чаще.
Однако при повышении температуры скорость химических реакций увеличивается в основном благодаря тому, что увеличивается число эффективных соударений. При повышении температуры резко увеличивается число активных частиц, которые могут преодолеть энергетический барьер реакции. Если понижаем температуру – частицы начинают двигаться медленнее, число активных частиц уменьшается, и количество эффективных соударений в секунду уменьшается. Таким образом, при повышении температуры скорость химической реакции повышается, а при понижении температуры — уменьшается .
Обратите внимание! Это правило работает одинаково для всех химических реакций (в том числе для экзотермических и эндотермических). Скорость реакции не зависит от теплового эффекта. Скорость экзотермических реакций при повышении температуры возрастает, а при понижении температуры – уменьшается. Скорость эндотермических реакций также возрастает при повышении температуры, и уменьшается при понижении температуры.
Более того, еще в XIX веке голландский физик Вант-Гофф экспериментально установил, что скорость большинства реакций примерно одинаково изменяется (примерно в 2-4 раза) при изменении температуры на 10 о С.
Правило Вант-Гоффа звучит так: повышение температуры на 10 о С приводит к увеличению скорости химической реакции в 2-4 раза (эту величину называют температурный коэффициент скорости химической реакции γ).
Точное значение температурного коэффициента определяется для каждой реакции.
здесь v2 — скорость реакции при температуре T2,
v1 — скорость реакции при температуре T1,
γ — температурный коэффициент скорости реакции, коэффициент Вант-Гоффа.
В некоторых ситуациях повысить скорость реакции с помощью температуры не всегда удается, т.к. некоторые вещества разлагаются при повышении температуры, некоторые вещества или растворители испаряются при повышенной температуре, т.е. нарушаются условия проведения процесса.
Видео:Составляем кинетические уравненияСкачать

2. Концентрация
Также изменить число эффективных соударений можно, изменив концентрацию реагирующих веществ . Понятие концентрации, как правило, используется для газов и жидкостей, т.к. в газах и жидкостях частицы быстро двигаются и активно перемешиваются. Чем больше концентрация реагирующих веществ (жидкостей, газов), тем больше число эффективных соударений, и тем выше скорость химической реакции.
На основании большого числа экспериментов в 1867 году в работах норвежских ученых П. Гульденберга и П. Вааге и, независимо от них, в 1865 году русским ученым Н.И. Бекетовым был выведен основной закон химической кинетики, устанавливающий зависимость скорости химической реакции от концентрации реагирующих веществ:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных их коэффициентам в уравнении химической реакции.
Для химической реакции вида: aA + bB = cC + dD закон действующих масс записывается так:
здесь v — скорость химической реакции,
CA и CB — концентрации веществ А и В, соответственно, моль/л
k – коэффициент пропорциональности, константа скорости реакции.
Например , для реакции образования аммиака:
закон действующих масс выглядит так:
Константа скорости реакции k показывает, с какой скоростью будут реагировать вещества, если их концентрации равны 1 моль/л, или их произведение равно 1. Константа скорости химической реакции зависит от температуры и не зависит от концентрации реагирующих веществ.
В законе действующих масс не учитываются концентрации твердых веществ, т.к. они реагируют, как правило, на поверхности, и количество реагирующих частиц на единицу поверхности при этом не меняется.
В большинстве случаев химическая реакция состоит из нескольких простых этапов, в таком случае уравнение химической реакции показывает лишь суммарное или итоговое уравнение происходящих процессов. При этом скорость химической реакции сложным образом зависит (или не зависит) от концентрации реагирующих веществ, полупродуктов или катализатора, поэтому точная форма кинетического уравнения определяется экспериментально, или на основании анализа предполагаемого механизма реакции. Как правило, скорость сложной химической реакции определяется скоростью его самого медленного этапа (лимитирующей стадии).
Видео:Задачи на скорость реакции в зависимости от концентрации реагентовСкачать

3. Давление
Концентрация газов напрямую зависит от давления . При повышении давления повышается концентрация газов. Математическое выражение этой зависимости (для идеального газа) — уравнение Менделеева-Клапейрона:
pV = νRT
Таким образом, если среди реагентов есть газообразное вещество, то при повышении давления скорость химической реакции увеличивается, при понижении давления — уменьшается .
Например. Как изменится скорость реакции сплавления извести с оксидом кремния:
при повышении давления?
Правильным ответом будет – никак, т.к. среди реагентов нет газов, а карбонат кальция – твердая соль, нерастворимая в воде, оксид кремния – твердое вещество. Газом будет продукт – углекислый газ. Но продукты не влияют на скорость прямой реакции.
Видео:Как выучить Химию с нуля за 10 минут? Принцип Ле-ШательеСкачать

4. Катализатор
Еще один способ увеличить скорость химической реакции – направить ее по другому пути, заменив прямое взаимодействие, например, веществ А и В серией последовательных реакций с третьим веществом К, которые требуют гораздо меньших затрат энергии (имеют более низкий активационный энергетический барьер) и протекают при данных условиях быстрее, чем прямая реакция. Это третье вещество называют катализатором .
Катализаторы – это химические вещества, участвующие в химической реакции, изменяющие ее скорость и направление, но не расходующиеся в ходе реакции (по окончании реакции не изменяющиеся ни по количеству, ни по составу). Примерный механизм работы катализатора для реакции вида А + В можно представить так:
A + K = AK
AK + B = AB + K
Процесс изменения скорости реакции при взаимодействии с катализатором называют катализом. Катализаторы широко применяют в промышленности, когда необходимо увеличить скорость реакции, либо направить ее по определенному пути.
По фазовому состоянию катализатора различают гомогенный и гетерогенный катализ.
Гомогенный катализ – это когда реагирующие вещества и катализатор находятся в одной фазе (газ, раствор). Типичные гомогенные катализаторы – кислоты и основания. органические амины и др.
Гетерогенный катализ – это когда реагирующие вещества и катализатор находятся в разных фазах. Как правило, гетерогенные катализаторы – твердые вещества. Т.к. взаимодействие в таких катализаторах идет только на поверхности вещества, важным требованием для катализаторов является большая площадь поверхности. Гетерогенные катализаторы отличает высокая пористость, которая увеличивает площадь поверхности катализатора. Так, суммарная площадь поверхности некоторых катализаторов иногда достигает 500 квадратных метров на 1 г катализатора. Большая площадь и пористость обеспечивают эффективное взаимодействие с реагентами. К гетерогенным катализаторам относятся металлы, цеолиты — кристаллические минералы группы алюмосиликатов (соединений кремния и алюминия), и другие.
Пример гетерогенного катализа – синтез аммиака:
В качестве катализатора используется пористое железо с примесями Al2O3 и K2O.
Сам катализатор не расходуется в ходе химической реакции, но на поверхности катализатора накапливаются другие вещества, связывающие активные центры катализатора и блокирующие его работу (каталитические яды). Их необходимо регулярно удалять, путем регенерации катализатора.
В биохимических реакция очень эффективными оказываются катализаторы – ферменты. Ферментативные катализаторы действуют эффективно и избирательно, с избирательностью 100%. К сожалению, ферменты очень чувствительны к повышению температуры, кислотности среды и другим факторам, поэтому есть ряд ограничений для реализации в промышленных масштабах процессов с ферментативным катализом.
Катализаторы не стоит путать с инициаторами процесса и ингибиторами.
Например , для инициирования радикальной реакции хлорирования метана необходимо облучение ультрафиолетом. Это не катализатор. Некоторые радикальные реакции инициируются пероксидными радикалами. Это также не катализаторы.
Ингибиторы – это вещества, которые замедляют химическую реакцию. Ингибиторы могут расходоваться и участвовать в химической реакции. При этом ингибиторы не являются катализаторами наоборот. Обратный катализ в принципе невозможен – реакция в любом случае будет пытаться идти по наиболее быстрому пути.
Видео:Химическая кинетика. Скорость химической реакции | ХимияСкачать

5. Площадь соприкосновения реагирующих веществ
Для гетерогенных реакций одним из способов увеличить число эффективных соударений является увеличение площади реакционной поверхности . Чем больше площадь поверхности контакта реагирующих фаз, тем больше скорость гетерогенной химической реакции. Порошковый цинк гораздо быстрее растворяется в кислоте, чем гранулированный цинк такой же массы.
В промышленности для увеличения площади контактирующей поверхности реагирующих веществ используют метод «кипящего слоя».
Например , при производстве серной кислоты методом «кипящего слоя» производят обжиг колчедана.
Видео:Порядок реакцииСкачать

6. Природа реагирующих веществ
На скорость химических реакций при прочих равных условиях также оказывают влияние химические свойства, т.е. природа реагирующих веществ.
Менее активные вещества будут имеют более высокий активационный барьер, и вступают в реакции медленнее, чем более активные вещества.
Более активные вещества имеют более низкую энергию активации, и значительно легче и чаще вступают в химические реакции.
Более стабильные вещества — это, например, те вещества, которые окружают нас в быту, либо существуют в природе.
Например , хлорид натрия NaCl (поваренная соль), или воды H2O, или металлическое железо Fe.
Более активные вещества мы можем встретить в быту и природе сравнительно редко.
Например , оксид натрия Na2O или сам натрий Na в быту и в природе не не встречаем, т.к. они активно реагируют с водой.
При небольших значениях энергии активации (менее 40 кДж/моль) реакция проходит очень быстро и легко. Значительная часть столкновений между частицами заканчивается химическим превращением. Например, реакции ионного обмена происходят при обычных условиях очень быстро.
При высоких значениях энергии активации (более 120 кДж/моль) лишь незначительное число столкновений заканчивается химическим превращением. Скорость таких реакций пренебрежимо мала. Например, азот с кислородом практически не взаимодействует при нормальных условиях.
При средних значениях энергии активации (от 40 до 120 кДж/моль) скорость реакции будет средней. Такие реакции также идут при обычных условиях, но не очень быстро, так, что их можно наблюдать невооруженным глазом. К таким реакциям относятся взаимодействие натрия с водой, взаимодействие железа с соляной кислотой и др.
Вещества, стабильные при нормальных условиях, как правило, имеют высокие значения энергии активации.
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Дано уравнение реакции (см. вариант в табл. 4). 1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция? Номер варианта 17






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Дано уравнение реакции (см. вариант в табл. 4).
1. Запишите кинетические уравнения скоростей прямой v и обратной v реакций. Гомо- или гетерогенной является данная реакция?
2. Рассчитайте скорость прямой реакции v0 в начальный момент времени при начальных концентрациях c0 реагентов. Рассчитайте, как изменится скорость прямой реакции к моменту времени vt , когда прореагирует 20 % вещества В.
3. Рассчитайте изменение скорости прямой реакции v при одновременном повышении давления в системе в два раза и температуры T на 20 ° С при g = 2.
Задание 2. Даны уравнение реакции и исходные концентрации веществ (см. вариант табл. 4).
1. Запишите выражение для константы равновесия Kc химической реакции через концентрации веществ.
2. Рассчитайте равновесные концентрации всех веществ к моменту времени, когда прореагирует 30 % вещества А и вычислите константу равновесия.
3. Укажите направление смещения равновесия при изменении каждого из факторов (c, p, V и Т).
Решение :
1. скорость прямой и обратной реакции:
Так как все вещества находятся в газообразном и твердом состоянии, то реакция является гетерогенной
2. в начальный момент времени скорость реакции равна:
Количество вещества H 2 , вступившего в реакцию: 3*0.2 = 0.6 моль, в системе останется непрореагировавшими 3-0,6=2,4 моль
По уравнению реакции на 0,6 моль H 2 требуется 0,6/2=0,3 моль SiCl 4 , в системе останется 2-0,3=1,7 моль SiCl 4 . И скорость реакции станет равной:
| Изучите химию на странице ➔ решение заданий и задач по химии. |
| Похожие готовые решения: |
- Имеется раствор вещества данной концентрации и плотности (см. вариант в табл. 5). Определите молярную концентрацию вещества (c), молярную концентрацию эквивалентов вещества (cэк). Номер варианта 17
- Имеется раствор слабого электролита или электролита средней силы (см. вариант в табл. 7). 1. Запишите уравнения диссоциации и выражения для констант диссоциации (Kд) Номер варианта 17
- Дана схема реакции (см. вариант в табл. 2): 1) определите степень окисления атомов элементов, меняющих ее в процессе реакции; 2) составьте электронный баланс FeCl2 + HNO3 + HCl → FeCl3 + NO + H2O
- Для всех веществ, участвующих в реакции, выпишите из приложения 1 значения стандартных термодинамических величин Hf0298 и S0298 . SiCl4(г) + 2Н2(г) = Si(т) + 4HCl(г)
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
Видео:Встреча с Путиным в общежитии МГУ на Воробьевых горах!Скачать

Задачи с решениями на химическую кинетику и химическое равновесие
Химическая кинетика и химическое равновесие
Задача № 1. Написать математическое выражение скорости прямой и обратной реакций:
Пример 59
Для реакции 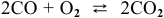
где 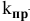
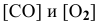
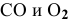
где 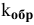
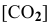
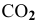
Задача 43
Определить начальную скорость реакции с константой скорости прямой реакции к в растворе, полученном смешением 2 л 0,6 М раствора 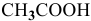
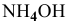
Решение:
Уравнение химической реакции, происходящей в смеси двух растворов, следующее:
Согласно закону действия масс выражение скорости химической реакции
Для определения скорости реакции необходимо знать величину концентраций веществ 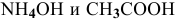
Зная, что в исходном растворе уксусной кислоты содержится 0,6-2 = = 1,2 моль 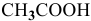
В исходном растворе гидроксида аммония содержится 1-3=3 моль 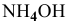
Определяем начальную скорость реакции:
Задача 44
Как изменится скорость прямой реакции
если давление увеличить в 3 раза?
Решение:
Предположим, что в начальный момент до повышения давления концентрации реагирующих веществ следующие:
Скорость реакции, определяемая по закону действия масс, до повышения давления равна:
Согласно уравнению Менделеева-Клапейрона 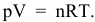
Таким образом, после повышения давления концентрации реагирующих веществ станут равными:
Скорость реакции после повышения давления
Повышение скорости реакции будет следующим:
При повышении давления в 3 раза скорость прямой реакции увеличивается в 27 раз.
Задача 45
Во сколько раз увеличится скорость реакции при увеличении температуры с 50 до 90°С? Температурный коэффициент реакции у равен 2,5.
Решение:
Согласно правилу Вант-Гоффа
Задача 46
Константа скорости реакции разложения HI равна 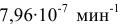
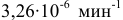
Решение:
Воспользуемся формулой, являющейся производной уравнения Аррениуса:
Теперь, зная энергию активации, можно рассчитать константу скорости реакции при 310 °C:
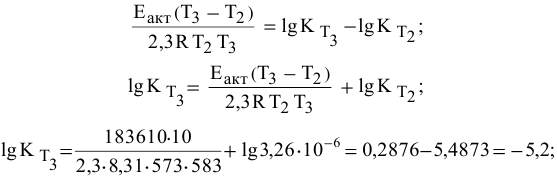
Определяем температурный коэффициент по следующей формуле:
Задача 47
Написать математические выражения констант равновесия следующих реакций:
Решение:
а) Для гомогенной реакции
б) Для гетерогенной реакции
так как концентрации твердых веществ не входят в выражение константы равновесия.
Задача 48
В состоянии равновесия системы 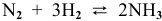
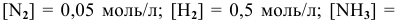
Решение:
Подставим в выражение константы равновесия значения равновесных концентрации:
Задача 49
Константа равновесия реакции 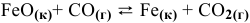

Решение:
Предположим, что в ходе реакции до момента установления состояния химического равновесия концентрация СО уменьшается на X моль/л. Тогда в состоянии химического равновесия концентрации 
Математическое выражение константы равновесия данной реакции:
Отсюда находим значение X:
В состоянии равновесия значения концентрации будут следующими:
Задача 50
Для реакции 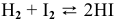
Решение:
Между энергией Гиббса и константой равновесия существует следующая взаимосвязь:
Рассчитываем вначале значение
Находим значение константы равновесия реакции в стандартных условиях 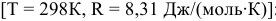
Задача 51
В каком направлении сместится равновесие следующих химических реакций:
если увеличить температуру?
если увеличить концентрацию 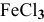
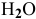
если увеличить давление?
Решение:
Воспользуемся принципом Ле Шателье.
1) Увеличение температуры смещает химическое равновесие в направлении эндотермической реакции, а уменьшение температуры — в направлении экзотермической реакции.
Для реакции 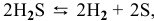
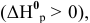
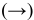
2) Увеличение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, уменьшающей концентрацию этого вещества.
Уменьшение концентрации одного из участвующих в равновесии веществ смещает химическое равновесие в сторону реакции, увеличивающей концентрацию этого вещества.
Для реакции 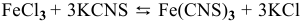
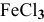
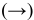
3) Увеличение давления смещает химическое равновесие в направлении реакции, вызывающей уменьшение объема системы, т.е. в сторону реакции с уменьшением числа газообразных молекул.
Для реакции 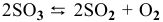


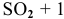
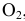
Эти задачи взяты со страницы решения задач по неорганической химии:
Возможно эти страницы вам будут полезны:




















































Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
📹 Видео
Физическая химия #3. Первый, второй и третий порядки химической реакции. Времена полупревращенияСкачать

Химическое равновесие. Константа равновесия. 10 класс.Скачать

Видеоурок "Параметрические уравнения прямой"Скачать

Экзо- и эндотермические реакции. Тепловой эффект химических реакций. 8 класс.Скачать

Влияние температуры на скорость химических реакций. 10 класс.Скачать

5 2 Кинетические уравненияСкачать

Скорость реакции. Химия – ПростоСкачать

Определение порядка реакции методом подбора кинетического уравненияСкачать

Химическая кинетика. Формальная кинетика простых гомогенных реакций в закрытых системахСкачать

Решение задач на термохимические уравнения. 8 класс.Скачать