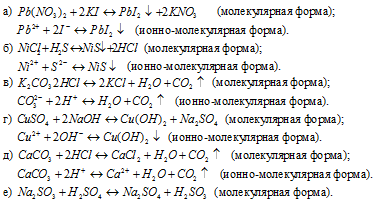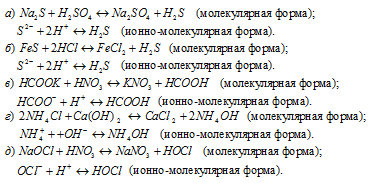Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Реакции, идущие с образованием малодиссоциирующего вещества
Теория
Согласно теории электролитической диссоциации при растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. А если в растворе одновременно присутствуют несколько веществ – электролитов, то образуется несколько катионов и анионов, и тогда между противоположно заряженными ионами возможно взаимодействие с образованием новых веществ.
Реакции между ионами называются ионными реакциями, а уравнения этих реакций – ионными уравнениями.
Реакции, протекающие в растворах электролитов, без изменения степеней окисления, называются ионнообменными.
В соответствии с правилом Бертолле реакции обмена протекают до конца только тогда, когда образуются твердое малорастворимое соединение (осадок), легколетучее вещество (газ) или малодиссоциирующее соединение (очень слабый электролит, в том числе и вода).
Реакции обмена в растворе принято изображать тремя уравнениями:
· полным ионным уравнением
· сокращенным ионным уравнением
При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, т.е. обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
В ионных уравнениях формулы веществ записываются в виде ионов или в виде молекул.
В виде ионов записывают формулы сильных кислот, сильных оснований, растворимых в воде солей.
В виде молекул записывают формулы воды, слабых кислот, слабых оснований, малорастворимых солей, амфотерных гидроксидов, оксидов, газообразных веществ.
В уравнениях реакций ставят знак ↓, если среди продуктов реакции есть осадок – нерастворимые или малорастворимые вещества. Знак ↑ показывает газообразные или летучие веества.
Реакции обмена в водных растворах электролитов могут быть:
1) практически необратимыми, т.е. протекать до конца;
2) обратимыми, т.е. протекать одновременно в двух противоположных направлениях.
Примеры реакций ионного обмена.
1. Реакции с образованием малорастворимых веществ, выпадающих в осадок.
Ag + + NO3 — + Na + + Cl — = AgCl↓ + Na + + NO3 —
Эта реакция обмена необратима, потому что один из продуктов уходит из раствора в виде нерастворимого вещества.
2. Реакции, идущие с образованием малодиссоциирующих веществ (слабых электролитов).
Na + + OH — + H + + NO3 — = Na + + NO3 — + H2O
В результате реакции нейтрализации ины водорода и гидроксид-ионы образуют малодиссоциирующие молекулы воды. Процесс нейтрализации идет до конца, т.е. эта реакция необратима.
3. Реакции, протекающие с образованием газообразных веществ.
Na + +OH — + NH4 + + Cl — = Na + + Cl — + NH3↑ + H2O
Эта реакция обмена необратима, потому что образуется газ аммиак и малодиссоциирующее вещество вода.
4. Реакции обмена, если среди исходных веществ имеются слабые электролиты или малорастворимые вещества, являются обратимыми, т.е. до конца не протекают.
Cu(OH)2 + 2H + + 2Cl — ↔ Cu 2+ + 2Cl — + 2H2O
Если исхоными веществами реакций обмена являются сильные электролиты, которые при взаимодействии не образуют малорастворимых или малодиссоциирующих веществ, то такие реакции не протекают. При смешивании их растворов образуется смесь ионов, которые не соединяются друг с другом. Примером может служить реакция между хлоридом натрия и нитратом кальция. Уравнения таких реакций обмена не записывают.
Таким образом, реакции ионного обмена идут в направлении связывания ионов.
Порядок выполнения работы
Оборудование и реактивы:
Штатив с пробирками, растворы сульфата меди (II), хлорида кальция, сульфата алюминия, гидроксида натрия, нитрата бария, сульфита натрия, карбоната натрия, серной кислоты, хлорида железа (III), фенолфталеина.
Реакции, идущие с образованием осадка
Опыт № 1.
Налейте в пробирку 3 – 4 мл раствора сульфата меди (II) и добавьте немного раствора гидроксида натрия.
Запишите наблюдения ______________________________________________________________
Составьте уравнения реакции в молекулярном, полном ионном и сокращенном ионном виде:
Опыт № 2.
Налейте в пробирку 3 – 4 мл раствора сульфата алюминия и добавьте немного раствора нитрата бария.
Запишите наблюдения _______________________________________________________________
Составьте уравнения реакции в молекулярном, полном ионном и сокращенном ионном виде:
Реакции, идущие с выделение газа
Опыт № 3
Налейте в пробирку 3 – 4 мл раствора сульфита натрия и добавьте столько же раствора серной кислоты.
Запишите наблюдения _______________________________________________________________
Составьте уравнения реакции в молекулярном, полном ионном и сокращенном ионном виде:
Опыт № 4
Налейте в пробирку 3 – 4 мл раствора карбоната натрия и добавьте столько же раствора серной кислоты.
Запишите наблюдения _______________________________________________________________
Составьте уравнения реакции в молекулярном, полном ионном и сокращенном ионном виде:
Реакции, идущие с образованием малодиссоциирующего вещества
Опыт № 5
Налейте в пробирку 3 – 4 мл раствора гидроксида натрия и добавьте 2 – 3 капли раствора фенолфталеина. Затем прилейте раствор серной кислоты.
Запишите наблюдения _______________________________________________________________
Составьте уравнения реакции в молекулярном, полном ионном и сокращенном ионном виде:
1. Какие реакции называются ионными?
2. В каких случаях реакции ионного обмена протекают до конца?
3. В каком направлении протекают реакции ионного обмена?
4. Объясните, почему в опытах № 1 и № 2 образовались осадки?
5. Объясните, почему в опытах № 3 и № 4 выделились газообразные вещества?
6. Какими еще кислотами можно было подействовать на растворы сульфита натрия и карбоната натрия (в опытах № 3 и № 4), чтобы получить аналогичные результаты?
7. Объясните, почему в опыте № 5 произощло обесцвечивание? Как называется реакция между щелочью и сильной кислотой?
8. Объясните, почему в пятом опыте сущность этой реакции нельзя выразить сокращенным ионным уравнением?
9. В каких случаях реакции ионного обмена в растворах электролитов являются обратимыми?
10. В каких случаях реакции ионного обмена в растворах электролитов являются необратимыми?
11. В каких случаях реакции ионного обмена в растворах электролитов не протекают?
12. Формулы каких веществ в ионных уравнениях записывают в виде ионов?
13.Формулы каких веществ в ионных уравнениях записывают в виде молекул?
Видео:Химия | Молекулярные и ионные уравненияСкачать

—>Решение задач по химии —>
Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В.А. Рабиновича и Х.М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 580-607
580. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: а) Pb(NO3)2+KI; б) NiCl2+H2S; в) K2CO3+HCl; г) CuSO4+NaOH; д) CaCO3+HCl; е) Na2SO3+H2SO4; ж) AlBr3+AgNO3. Решение с ключом
581. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений: а) Na2S+H2SO4; б) FeS+HCl; в) HCOOK+HNO3; г) NH4Cl+Ca(OH)2; д) NaOCl+HNO3. Решение с ключом
582. Написать в ионно-молекулярной форме уравнения реакций нейтрализации: а) HCl+Ba(OH)2; б) HF+KOH; в) Fe(OH)3+HNO3; г) CH3COOH+NH4OH; д) HNO2+NH4OH; е) H2S+NH4OH. Решение с ключом
583. Составить в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
584. Написать в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ: а) NaHCO3 и HCl; б) FeCl3 и KOH; в) Pb(CH3COO)2 и Na2S; г) KHS и H2SO4; д) Zn(NO3)2+KOH (избыток); е) Ca(OH)2+CO2; ж) Ca(OH)2+CO2 (избыток). Для каждого случая указать причину смещения равновесия в сторону прямой реакции. Решение с ключом
585. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, NH4CH3COO, CaCl2, NaClO4, KHCOO, KBr? Для каждой из гидролизующихся солей написать уравнение гидролиза в ионно-молекулярной форме и указать реакцию ее водного раствора. Решение с ключом
586. Указать, какие из перечисленных ниже солей подвергаются гидролизу: ZnBr2, K2S, Fe2(SO4)3, MgSO4, Cr(NO3)3, K2CO3, Na3PO4, CuCl2. Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза по каждой ступени, указать реакцию водного раствора соли. Решение с ключом
587. В какой цвет будет окрашен лакмус в водных растворах KCN, NH4Cl, K2SO3, NaNO3, FeCl3, Na2CO3, Na2SO4? Ответ обосновать. Решение с ключом
588. Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора. Решение с ключом
589. Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора. Решение с ключом
590. Определить pH 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
591. Сравнить степень гидролиза соли и pH среды в 0,1 М и 0,001 М растворах цианида калия. Решение с ключом
592. При 60 °С ионное произведение воды KH2O=10 -13 . Считая, что константа диссоциации хлорноватистой кислоты не изменяется с температурой, определить pH 0,001 н. раствора KOCl при 25 и при 60 °С.
593. pH 0,1 М раствора натриевой соли некоторой одноосновной органической кислоты равен 10. Вычислить константу диссоциации этой кислоты. Решение с ключом
594. Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S. Решение
595. При pH 6,3 – в желтый, при промежуточных значениях pH – в оранжевый цвет. Какова будет окраска индикатора в 0,1 М растворе NH4Br? Решение с ключом
596. Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 – сильнощелочную реакцию. Объяснить эти факты и мотивировать их соответствующими ионно-молекулярными уравнениями. Решение
597. Почему раствор NaHCO3 имеет слабощелочную, а раствор NaHSO3 – слабокислую реакцию? Решение с ключом
598. При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок гидроксида хрома (III) и выделяется газ. Составить молекулярное и ионно-молекулярное уравнения происходящей реакции.
599. В каком направлении будет смещено равновесие реакции AgI(к.)+NaCl(водн.)↔AgCl(к.)+NaI(водн.): а) в направлении прямой реакции; б) в направлении обратной реакции? Решение
600. В каком направлении будет смещено в водном растворе равновесие реакции: CH3COONa+CH2ClCOOH↔CH3COOH+CH2ClCOONa: а) в направлении прямой реакции; б) в направлении обратной реакции? Решение
601. Указать, какой порядок расположения растворов равной молекулярной концентрации соответствует возрастанию pH: а) NH4Cl – NaNO3 – CH2ClCOONa – NaF – CH3COONa – NaCN; б) NaCN – CH3COONa – NaF – CH2ClCOONa – NaNO3 – NH4Cl. Решение
602. Раствор кислоты и раствор основания смешивают в эквивалентных соотношениях. Для каких из перечисленных пар (кислота+основание) раствор будет иметь нейтральную реакцию: а) NH4OH+HCl; б) NH4OH+CH3COOH; в) NaOH+HCl; г) NaOH+CH3COOH? Решение
603. Какие из перечисленных ниже солей, подвергаясь частичному гидролизу, образуют основные соли: а) Cr2(SO4)3; б) Na2CO3; в) AgNO3; г) AlCl3? Решение
604. Лакмус изменяет окраску в интервале pH от 5 до 8,3. Какова будет окраска содержащего лакмус 0,001 М раствора ацетата натрия CH3COONa (Kг=5,6·10-9): а) красная; б) фиолетовая; в) синяя? Решение
605. Индикатор метиловый оранжевый изменяет окраску от красной до желтой в интервале pH от 3,2 до 4,4. Какова будет окраска 0,1 М водного раствора ацетата аммония CH3COONH4, содержащего метиловый оранжевый: а) красная; б) оранжевая; в) желтая? Решение
606. Константы диссоциации азидоводорода HN3 и гидроксида аммония NH4OH примерно одинаковы. Каким будет соотношение значений pH в растворах NaN3 (pH1) и NH4NO3 (pH2) одинаковой молярной концентрации: а) pH1>pH2; б) pH1≈pH2; в) pH1
607. Добавление каких из перечисленных ниже реагентов к раствору FeCl3 усилит гидролиз соли: а) HCl; б) NaOH; в) ZnCl2; г) Na2CO3; д) NH4Cl; е) Zn; ж) H2O? Решение
📹 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Химия. Молекулярные и ионные уравненияСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Реакции ионного обмена. 9 класс.Скачать

Реакции ионного обмена. 9 класс.Скачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Реакции ионного обменаСкачать

Реакции ионного обмена: от простых реакций до самых жёстких заданий на ЕГЭ! | Химия ЕГЭ | УмскулСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

Типы Химических Реакций — Химия // Урок Химии 8 КлассСкачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Ионные уравнения | Химия 8 класс #42 | ИнфоурокСкачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

Решение задач по уравнениям параллельно протекающих реакций. 1 часть. 11 класс.Скачать

Типы химических реакций. 1 часть. 8 класс.Скачать