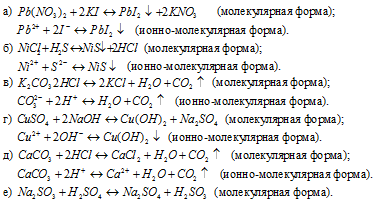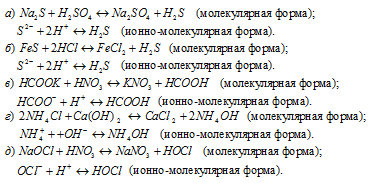Задача 580.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: 
Решение:
Так как реакция протекает с образованием сернистой кислоты – слабого электролита и при этом не выпадает осадок и не выделяется газ, то, по условию задачи, ионно-молекулярное уравнение не пишем.
Задача 581.
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссoциированных соединений: 
Решение:
Задача 582.
Написать в ионно-молекулярной форме уравнения реакций нейтрализации: 
Указать, какие из этих реакций протекают обратимо, а какие необратимо.
Решение:
а) 2HCl + Ba(OH)2 ⇔ BaCl2 + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H 2 O (ионно-молекулярная форма).
Реакция протекает до конца, так как в реакцию вступают сильные электролиты соляная кислота и гидроксид бария образуется слабый электролит вода.
б) HF + KOH ⇔ KF + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
В реакции участвуют два слабых электролита фтороводород и вода, согласно принципу Ле Шателье, равновесие реакции будет смещено в сторону более слабого электролита, т.е. вправо в сторону образования воды. Реакция обратима.
в) Fe(OH)3 + 3HNO3 ⇔ Fe(NO3)3 + 3H2O (молекулярная форма);
3H + + 3OH — ⇔ 3H2O (ионно-молекулярная форма).
В реакции участвуют слабое малорастворимое основание и сильная кислота, равновесие будет смещено в сторону образования более слабого электролита воды. Реакция будет протекать до конца.
г) CH3COOH + NH4OH ⇔ CH3COONH4 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
д) HNO2 + NH4OH ⇔ NH4NO2 + H2O (молекулярная форма);
H + + OH — ⇔ H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита уксусная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
е) H2S + 2NH4OH ⇔ (NH4)2S + 2H2O (молекулярная форма);
2H + + 2OH — ⇔ 2H2O (ионно-молекулярная форма).
Реакция обратима, так как в реакции участвуют три слабых электролита сероводородная кислота, гидроксид аммония и вода. Согласно принципу Ле Шателье равновесие системы будет смещено в сторону образования самого слабого электролита, вправо, в сторону образования воды.
Таким образом, реакции нейтрализации, в которых участвуют слабые кислоты или основания, — обратимы, т.е. могут протекать как в прямом так и в обратном направлении.
Видео:Химия | Молекулярные и ионные уравненияСкачать

—>Решение задач по химии —>
Глинка Н.Л. Задачи и упражнения по общей химии. Учебное пособие для вузов / Под ред. В.А. Рабиновича и Х.М. Рубиной. – 23-е изд., исправленное – Л.: Химия, 1985. – 264 с., ил.
Задачи 580-607
580. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков или газов: а) Pb(NO3)2+KI; б) NiCl2+H2S; в) K2CO3+HCl; г) CuSO4+NaOH; д) CaCO3+HCl; е) Na2SO3+H2SO4; ж) AlBr3+AgNO3. Решение с ключом
581. Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малодиссоциированных соединений: а) Na2S+H2SO4; б) FeS+HCl; в) HCOOK+HNO3; г) NH4Cl+Ca(OH)2; д) NaOCl+HNO3. Решение с ключом
582. Написать в ионно-молекулярной форме уравнения реакций нейтрализации: а) HCl+Ba(OH)2; б) HF+KOH; в) Fe(OH)3+HNO3; г) CH3COOH+NH4OH; д) HNO2+NH4OH; е) H2S+NH4OH. Решение с ключом
583. Составить в молекулярной форме уравнения реакций, которые выражаются следующими ионно-молекулярными уравнениями:
584. Написать в ионно-молекулярной форме уравнения реакций взаимодействия между водными растворами следующих веществ: а) NaHCO3 и HCl; б) FeCl3 и KOH; в) Pb(CH3COO)2 и Na2S; г) KHS и H2SO4; д) Zn(NO3)2+KOH (избыток); е) Ca(OH)2+CO2; ж) Ca(OH)2+CO2 (избыток). Для каждого случая указать причину смещения равновесия в сторону прямой реакции. Решение с ключом
585. Какие из перечисленных ниже солей подвергаются гидролизу: NaCN, KNO3, KOCl, NaNO2, NH4CH3COO, CaCl2, NaClO4, KHCOO, KBr? Для каждой из гидролизующихся солей написать уравнение гидролиза в ионно-молекулярной форме и указать реакцию ее водного раствора. Решение с ключом
586. Указать, какие из перечисленных ниже солей подвергаются гидролизу: ZnBr2, K2S, Fe2(SO4)3, MgSO4, Cr(NO3)3, K2CO3, Na3PO4, CuCl2. Для каждой из гидролизующихся солей написать в молекулярной и в ионно-молекулярной форме уравнения гидролиза по каждой ступени, указать реакцию водного раствора соли. Решение с ключом
587. В какой цвет будет окрашен лакмус в водных растворах KCN, NH4Cl, K2SO3, NaNO3, FeCl3, Na2CO3, Na2SO4? Ответ обосновать. Решение с ключом
588. Вычислить константу гидролиза фторида калия, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора. Решение с ключом
589. Вычислить константу гидролиза хлорида аммония, определить степень гидролиза этой соли в 0,01 М растворе и pH раствора. Решение с ключом
590. Определить pH 0,02 н. раствора соды Na2CO3, учитывая только первую ступень гидролиза.
591. Сравнить степень гидролиза соли и pH среды в 0,1 М и 0,001 М растворах цианида калия. Решение с ключом
592. При 60 °С ионное произведение воды KH2O=10 -13 . Считая, что константа диссоциации хлорноватистой кислоты не изменяется с температурой, определить pH 0,001 н. раствора KOCl при 25 и при 60 °С.
593. pH 0,1 М раствора натриевой соли некоторой одноосновной органической кислоты равен 10. Вычислить константу диссоциации этой кислоты. Решение с ключом
594. Исходя из значений констант диссоциации соответствующих кислот и оснований, указать реакцию водных растворов следующих солей: NH4CN, NH4F, (NH4)2S. Решение
595. При pH 6,3 – в желтый, при промежуточных значениях pH – в оранжевый цвет. Какова будет окраска индикатора в 0,1 М растворе NH4Br? Решение с ключом
596. Раствор NaH2PO4 имеет слабокислую, а раствор Na3PO4 – сильнощелочную реакцию. Объяснить эти факты и мотивировать их соответствующими ионно-молекулярными уравнениями. Решение
597. Почему раствор NaHCO3 имеет слабощелочную, а раствор NaHSO3 – слабокислую реакцию? Решение с ключом
598. При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок гидроксида хрома (III) и выделяется газ. Составить молекулярное и ионно-молекулярное уравнения происходящей реакции.
599. В каком направлении будет смещено равновесие реакции AgI(к.)+NaCl(водн.)↔AgCl(к.)+NaI(водн.): а) в направлении прямой реакции; б) в направлении обратной реакции? Решение
600. В каком направлении будет смещено в водном растворе равновесие реакции: CH3COONa+CH2ClCOOH↔CH3COOH+CH2ClCOONa: а) в направлении прямой реакции; б) в направлении обратной реакции? Решение
601. Указать, какой порядок расположения растворов равной молекулярной концентрации соответствует возрастанию pH: а) NH4Cl – NaNO3 – CH2ClCOONa – NaF – CH3COONa – NaCN; б) NaCN – CH3COONa – NaF – CH2ClCOONa – NaNO3 – NH4Cl. Решение
602. Раствор кислоты и раствор основания смешивают в эквивалентных соотношениях. Для каких из перечисленных пар (кислота+основание) раствор будет иметь нейтральную реакцию: а) NH4OH+HCl; б) NH4OH+CH3COOH; в) NaOH+HCl; г) NaOH+CH3COOH? Решение
603. Какие из перечисленных ниже солей, подвергаясь частичному гидролизу, образуют основные соли: а) Cr2(SO4)3; б) Na2CO3; в) AgNO3; г) AlCl3? Решение
604. Лакмус изменяет окраску в интервале pH от 5 до 8,3. Какова будет окраска содержащего лакмус 0,001 М раствора ацетата натрия CH3COONa (Kг=5,6·10-9): а) красная; б) фиолетовая; в) синяя? Решение
605. Индикатор метиловый оранжевый изменяет окраску от красной до желтой в интервале pH от 3,2 до 4,4. Какова будет окраска 0,1 М водного раствора ацетата аммония CH3COONH4, содержащего метиловый оранжевый: а) красная; б) оранжевая; в) желтая? Решение
606. Константы диссоциации азидоводорода HN3 и гидроксида аммония NH4OH примерно одинаковы. Каким будет соотношение значений pH в растворах NaN3 (pH1) и NH4NO3 (pH2) одинаковой молярной концентрации: а) pH1>pH2; б) pH1≈pH2; в) pH1
607. Добавление каких из перечисленных ниже реагентов к раствору FeCl3 усилит гидролиз соли: а) HCl; б) NaOH; в) ZnCl2; г) Na2CO3; д) NH4Cl; е) Zn; ж) H2O? Решение
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков: a) Pb(NO3)2+KI; б) NiCl2 + H2S.






Чтобы получить решение , напишите мне в WhatsApp , оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным , не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу , я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Написать в ионно-молекулярной форме уравнения реакций, приводящих к образованию малорастворимых осадков: a ) Pb ( NO 3 )2+ KI ; б) NiCl 2 + H 2 S .
Решение :
Pb 2+ + 2NO3 — + 2K + + 2I — = PbI2 ¯ + 2K + + 2NO3 —
| Если вам нужно решить химию, тогда нажмите ➔ заказать контрольную работу по химии. |
| Похожие готовые решения: |
- Определить стандартную энтальпию (ΔНº298) образования PH3, исходя из уравнения: 2РН3(г.) + 4О2 (г) = Р2О5 (к) + ЗН2О(ж.), ΔН° = -2360 кДж. Сравнить с табличной величиной.
- По стандартным энтальпиям сгорания бензола (–3268 кДж/моль) и ацетилена (–1301 кДж/моль) вычислите тепловой эффект реакции
- Найти молярную концентрацию ионов Н+ в водных растворах, в которых концентрация гидроксид-ионов (в моль/л) составляет: а) 10-4; б) 3,2×10-6; в) 7,4×10-11.
- Растворимость СаСО3 при 35°С равна 6,9×10-5 моль/л. Вычислить произведение растворимости этой соли.
Присылайте задания в любое время дня и ночи в ➔
Официальный сайт Брильёновой Натальи Валерьевны преподавателя кафедры информатики и электроники Екатеринбургского государственного института.
Все авторские права на размещённые материалы сохранены за правообладателями этих материалов. Любое коммерческое и/или иное использование кроме предварительного ознакомления материалов сайта natalibrilenova.ru запрещено. Публикация и распространение размещённых материалов не преследует за собой коммерческой и/или любой другой выгоды.
Сайт предназначен для облегчения образовательного путешествия студентам очникам и заочникам по вопросам обучения . Наталья Брильёнова не предлагает и не оказывает товары и услуги.
📹 Видео
РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Химия. Молекулярные и ионные уравненияСкачать

как составить к сокращенному ионному уравнению молекулярноеСкачать

Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Реакции ионного обмена. 9 класс.Скачать

Уравнения химический реакций на ОГЭ: как составлять без ошибок?Скачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

Ионные уравнения реакций. Составляем полные и сокращенные ионные уравнения. Часть 1.Скачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

Реакции ионного обмена. 9 класс.Скачать

Химические уравнения. СЕКРЕТНЫЙ СПОСОБ: Как составлять химические уравнения? Химия 8 классСкачать

8 класс. Составление уравнений химических реакций.Скачать

Как Решать Задачи по Химии // Задачи с Уравнением Химической Реакции // Подготовка к ЕГЭ по ХимииСкачать

Реакции ионного обменаСкачать