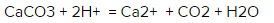CaCO3 — соль образованная сильным основанием и слабой кислотой, поэтому реакция гидролиза протекает по аниону.
- Первая стадия (ступень) гидролиза
- Вторая стадия (ступень) гидролиза
- Среда и pH раствора карбоната кальция
- Какое ионное уравнение реакции CaCO3 + 2HCl?
- Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
- Написать уравнения реакций в ионном виде caco3
- Образование осадка сульфата бария
- Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
- 🎦 Видео
Видео:РЕАКЦИИ ИОННОГО ОБМЕНА, ИОННОЕ УРАВНЕНИЕ - Урок Химия 9 класс / Подготовка к ЕГЭ по ХимииСкачать

Первая стадия (ступень) гидролиза
Полное ионное уравнение
2Ca 2+ + 2CO3 2- + 2HOH ⇄ Ca 2+ + 2HCO3 — + Ca 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
CO3 2- + HOH ⇄ HCO3 — + OH —
Видео:Химия | Молекулярные и ионные уравненияСкачать

Вторая стадия (ступень) гидролиза
Полное ионное уравнение
Ca 2+ + 2HCO3 — + 2HOH ⇄ 2H2CO3 + Ca 2+ + 2OH —
Сокращенное (краткое) ионное уравнение
HCO3 — + HOH ⇄ H2CO3 + OH —
Видео:Ионные уравнения реакций. Как составлять полные и сокращенные уравненияСкачать

Среда и pH раствора карбоната кальция
В результате гидролиза образовались гидроксид-ионы (OH — ), поэтому раствор имеет щелочную среду (pH > 7).
Видео:Ионные уравнения реакций. По сокращенному ионному уравнению составляем полное ионное и молекулярное.Скачать

Какое ионное уравнение реакции CaCO3 + 2HCl?
Каким будет ионное уравнение реакции CaCO3 + 2HCl = CaCl2 + CO2 + H20?
Объясните как составить ионное уравнение этой реакции?
Видео:Химия. Молекулярные и ионные уравненияСкачать

Как составить ионное уравнение реакции CaCO3 (карбоната кальция) и 2HCl (хлорной кислоты)?
Тип реакции: кислотно-основный.
В результате реакции карбонат кальция и 2 молекул хлорной кислоты, HCl нейтрализуется с образованием слабой неустойчивой кислоты H2CO3, которая не может оставаться в таком виде, потому распадается на углекислый газ CO2 и воду H2O.
Чтобы составить ионную реакцию, нужно сделать следующее:
- Проанализировать компоненты молекулярной реакции.
- Разложить на ионы газы, жидкости и растворы, а твердые вещества не трогать.
- Убрать с обоих сторон одинаковые ионы, записать конечный вид ионной реакции CaCO3 и 2HCl.
Итак, вот молекулярное уравнение:
Теперь нужно разобрать каждую составляющую этого уравнения, чтобы составить правильное ионное уравнение:
- CaCO3 не растворяется (ведь это обычный мел);
- HCl — кислота, растворяющаяся в воде;
- CaCl2 — хлорид кальция, растворяющийся в воде.
- H20 — это вода, в ионной реакции она не участвует;
- CO2 — газ, в данной ионной реакции он не участвует.
Теперь можно разложить составляющие на ионы (раскладывается только 2HCL и CaCl2):
CaCO3 (твердый элемент) + 2Cl- + 2H+ = Ca2+ + 2Cl- + CO2 + H2O
Что мы имеем? В обеих частях уравнения есть ионы хлора, потому их можно сократить. И вот что мы получаем в итоге:
Если вы любознательны и хотите знать больше, читайте также вопросы:
Видео:как составить к сокращенному ионному уравнению молекулярноеСкачать

Написать уравнения реакций в ионном виде caco3
Реакции ионного обмена, протекающие между растворами солей
I. Запишем уравнение реакции между растворами карбоната натрия и хлорида кальция.
В результате этого взаимодействия образуется осадок карбоната кальция и хлорид натрия.
Рис. 1. Осадок карбоната кальция
Na 2CO 3 +CaCl 2 = CaCO 3 ↓ + 2NaCl — молекулярное уравнение
Рассмотрим сущность данной реакции обмена. Вы знаете, что карбонат натрия в воде диссоциирует на два катиона натрия и карбонат-анион.
Хлорид кальция в воде также диссоциирует на катион кальция и хлорид — анионы.
В ходе реакции осуществляется обмен ионами, приводящий к образованию осадка карбоната кальция.
2Na + + CO3 2- + Ca 2+ + 2Cl — = CaCO 3 ↓ + 2Na + + 2Cl — — полное ионное уравнение.
Ca 2+ + CO 3 2- = CaCO 3 ↓ – сокращённое ионное уравнение
Химические реакции, протекающие в растворах с участием свободных ионов, называются ионными реакциями.
Запись уравнения реакции с участием ионов называют уравнением в ионной форме (ионное уравнение)
II. Запишем ещё одно уравнение химической реакции, приводящей к образованию осадка карбоната кальция.
При взаимодействии карбоната натрия с нитратом кальция образуется осадок карбоната кальция и нитрат натрия. Запишем уравнение в молекулярной форме:
Na 2CO 3 +Ca(NO 3) 2 = CaCO 3 ↓ + 2NaNO 3 — молекулярное уравнение
Запишем уравнение в ионной форме:
2Na + + CO 3 2- + Ca 2+ + 2NO 3 — = CaCO 3 ↓ + 2Na + + 2 NO 3 — – полное ионное уравнение
Ca 2+ + CO 3 2- = CaCO 3 ↓ – сокращённое ионное уравнение
Обратите внимание: суть обеих реакций взаимодействия карбоната натрия с нитратом кальция и с хлоридом кальциям сводится к тому, что из катиона кальция и карбонат — аниона образуется нерастворимый карбонат кальция.
Теперь мы видим, что для получения карбоната кальция надо взять такие вещества, чтобы в состав одного вещества входили катионы кальция, а в состав другого – карбонат — ионы.
Сущность реакции ионного обмена отражают с помощью сокращённого ионного уравнения.
Видео:Реакции ионного обмена. 9 класс.Скачать

Образование осадка сульфата бария
Видео:Химические уравнения // Как Составлять Уравнения Реакций // Химия 9 классСкачать

Рассмотрим еще пример реакции ионного обмена, приводящей к образованию осадка.
Запишем уравнение реакции между сульфатом калия и хлоридом бария в молекулярном виде, в сокращённом ионном виде и в полном ионном виде.
K 2SO 4 +BaCl 2 = BaSO 4 ↓ + 2KCl – молекулярное уравнение
При взаимодействии сульфата калия и хлоридом бария образуется осадок сульфата бария и хлорид калия. Это молекулярная форма уравнения.
Ниже записана полная ионная форма.
2K + + SO 4 2- + Ba 2+ + 2Cl — = BaSO 4 ↓ + 2K + + 2Cl — – полное ионное уравнение
Если мы зачеркнём слева и справа одинаковые ионы, то получим сокращённое ионное уравнение.
Ba 2+ + SO 4 2- = BaSO 4 ↓ – сокращённое ионное уравнение
Таким образом, для получения сульфата бария необходимо, чтобы в состав одного вещества входили катионы бария, а в состав другого – сульфат – анионы.
1. Какой из приведенных реакций не соответствует сокращенное ионное уравнение: Ba 2+ + SO4 2- = BaSO4?
Ответ: уравнению №2, т.к. вода тоже является неэлектролитом и на ионы не распадается: Ba 2+ + 2OH — + 2H + + SO4 2- = BaSO4 + 2H2O
2. Какой из приведенных реакций соответствует сокращенное ионное уравнение Ca 2+ + CO3 2- = CaCO3?
Ответ: уравнение №1, т.к. оба исходных вещества — растворимые соли, распадаются на ионы, а в продуктах реакции только одно вещество CaCO3выпадает в осадок
3. Реакция между какой парой веществ сопровождается одновременным выпадением осадка и образованием воды?
1) Нитрат калия и хлорид кальция
2) карбонат бария и соляная кислота
3) гидроксид бария и соляная кислота
4) гидроксид бария и серная кислота
4. Реакция между какой парой веществ сопровождается одновременным выделением газа и образованием воды?
1) сульфид натрия и соляная кислота
2) силикат натрия и соляная кислота
3) карбонат натрия и соляная кислота
4) хлорид натрия и серная кислота
5. Какая пара ионов не может одновременно присутствовать в растворе?
Ответ: №2, т.к. ионы меди и сульфид-ионы образуют нерастворимую соль сульфид меди (II)
6. При сливании каких двух растворов в воде практически не остается ионов?
Ответ: №2, т.к. Ba(OH)2 + H2SO4 = BaSO4 + 2H2O происходит связывание всех ионов с образованием осадка и воды
7. При добавлении какого вещества к раствору гидроксида натрия происходит выделение газа?
Ответ: №1, т.к. NH4Cl + NaOH = NaCl + NH3 + H2O
🎦 Видео
Реакции ионного обмена. 9 класс.Скачать

Решение цепочек превращений по химииСкачать

9 класс. Реакции ионного обмена. Ионные уравнения.Скачать

Реакции ионного обменаСкачать

составляем молекулярные уравнения по сокращённым ионнымСкачать

Составление уравнений химических реакций. 1 часть. 8 класс.Скачать

ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ ХИМИЯ 8 класс // Подготовка к ЕГЭ по Химии - INTENSIVСкачать

Химические уравнения - Как составлять уравнения реакций // Составление Уравнений Химических РеакцийСкачать

Как составлять ХИМИЧЕСКИЕ УРАВНЕНИЯ | 4 лайфхака - 95 ВСЕХ РЕАКЦИЙ в химии!Скачать

8 класс. Составление уравнений химических реакций.Скачать

Как расставлять коэффициенты в уравнении реакции? Химия с нуля 7-8 класс | TutorOnlineСкачать

РЕАКЦИИ ИОННОГО ОБМЕНА и условия их протекания | Как составлять молекулярные и ионные уравненияСкачать